ETV5基因敲除对小鼠肌肉基因表达谱的影响
万伟粲,张仙玉,赵 鑫,李 彬,蔡更元,杨化强,徐 铮
(华南农业大学 动物科学学院,广东 广州 510642)
转录因子能够调控基因的转录,在发育过程中发挥着重要的作用,并且转录因子的突变和许多疾病的发生有着紧密的联系[1]。E26转录因子(E26 transcription-specific,ETS)家族是转录因子家族之一,它们在细胞的增殖、分化、迁移以及细胞的互作过程中起着重要的作用,而根据序列的相似性,又将ETS家族分成几个亚家族,在哺乳动物中发现了将近20多个亚家族,其中包括ETS、ELG、TEL、PEA3等[2]。PEA3亚家族由3个成员组成:ETV1、ETV4和ETV5[3]。ETV5也称ETS相关分子(ETS related molecule,ERM),在成年哺乳动物的组织中有着广泛的表达,尤其在睾丸[4]和卵巢[5]中表达量较高。
精原干细胞是雄性动物产生精子的基础,精原干细胞的研究对解决雄性不育症以及畜禽育种有着重要的推动作用,精原干细胞移植是近年来比较难以攻克的研究问题,其中如何制备内源性精原细胞消融的受体就是一个棘手的问题,传统方法常将白消安注射到雄性受体的睾丸中使其内源性的精原细胞消融[6],但是此方法对动物的伤害很大,并且雄性受体睾丸的精原细胞也无法做到完全消融,不可避免地会有一定程度的恢复,对后续试验的影响很大。随着基因编辑技术的发展,研究者常利用基因修饰的手段敲除或失活某种在雄性哺乳动物睾丸精子发生过程中起关键作用的基因,进而获得雄性睾丸内源性精原细胞消融理想的移植受体。Chen等[7]利用Cre-LoxP技术靶向敲除了小鼠的ETV5基因,制备了ETV5纯合敲除(ETV5-/-)小鼠,并发现敲除小鼠内源性精原细胞发生了消融且呈现出“唯支持细胞综合征”的表型,成功地制备了内源性精原细胞消融的移植受体。同时研究发现,ETV5-/-雄性小鼠对雌性小鼠失去了性欲,精子也没有受精能力,无论是自然交配、人工授精还是体外受精都不能使野生型(WT)的雌性小鼠受孕。而且,有报道称ETV5-/-雌性小鼠也是不孕的[8],这是因为它们的卵巢出现了结构上的缺陷,完全无法排卵,和野生型公鼠交配后不能形成阴道栓。ETV5敲除小鼠的成功制备实现了内源性精原细胞完全消融的雄性受体,为精原干细胞的研究提供了重要的材料。
然而,ETV5敲除小鼠不仅生殖系统的发育受到阻碍,在其他身体发育机能上也有缺陷。Schlesser等[9]靶向干扰小鼠的ETV5基因,和野生型相比ETV5纯合突变小鼠的体质量减少12%~31%。Jamsai等[10]利用ENU诱变将小鼠的ETV5基因产生错义突变,纯合ETV5突变的小鼠除了出现“唯支持细胞综合征”外,还产生了肾脏不对称、多趾以及发育不良等症状。Zhang等[11]为研究精原干细胞的移植,利用CRISPR/Cas9技术制备了ETV5敲除小鼠,试验结果和Schlesser等[9]以及Jamsai等[10]的研究结果相似,敲除ETV5基因的小鼠除了出现内源性精原细胞的消融,也出现了生长发育缓慢以及多趾的现象。
为了探究ETV5敲除小鼠生长发育缓慢的分子机制,我们通过对ETV5纯合敲除公鼠和野生型公鼠的肌肉组织进行了转录组测序,获得了2组小鼠肌肉组织的转录本数据,并且通过生物信息学分析筛选了ETV5-/-公鼠和野生型公鼠肌肉组织的差异表达基因,以及敲除ETV5影响了小鼠其他哪些功能基因及信号通路。
1 材料与方法
1.1 ETV5敲除小鼠的制备及基因型的检测
ETV5敲除小鼠的制备是通过CRISPR/Cas9技术对C57BL/6小鼠的ETV5基因(GenBank accession number:NM_023794.2;Ensembl:ENSMUSG000000 13089) 进行靶向敲除得到的(由苏州赛业生物科技有限公司完成)。设计了ETV5敲除小鼠的sgRNA,包括 sgRNA1(GAACGGCCATTGTCGGTGGCAGG)和 sgRNA2(CTTCTATGCTAATAACGGGTGGG)共获得49只F0代小鼠,1周龄时剪小鼠脚趾抽提DNA,通过PCR检测筛选出3只F0代ETV5基因杂合敲除小鼠(2公1母)。将杂合子公鼠和母鼠进行合笼繁殖,留下它们的公鼠后代,采集这些公鼠的尾巴,抽提组织DNA,并进行基因型的PCR鉴定,鉴定小鼠基因型的PCR引物包括上游引物(Primer-F:5′-CAACTGGTGCCCTTCCCAGTCT-3′)、中间引物(Primer-M:5′-TTAGACATTAGGCAGAGCCAGTGATG-3′)、下游引物(Primer-R:5′-GCCGCTCTTAAACCTGTTCATTCG-3′)。
1.2 小鼠的体质量测量
留下基因型检测结果为野生型(WT)的公鼠(C57BL/6小鼠)和纯合敲除(ETV5-/-)的公鼠,待小鼠6周龄时,选择WT公鼠和ETV5-/-公鼠各3只,依次放在电子秤上称量6只小鼠的体质量并记录。
1.3 样品收集和准备
1.3.1 肌肉样本的采集 称量过体质量的6只小鼠,分别进行颈椎脱臼法处死,将小鼠解剖采取小鼠后腿部位的肌肉,分别放入标记好的冻存管中,立即置于液氮中。
1.3.2 RNA 提取与检测 采用 Trizol法提取小鼠肌肉组织的总RNA,用琼脂糖凝胶电泳检测分析样品RNA的完整性,用Nanodrop 2000检测RNA浓度和纯度,用 Agilent 2100 bioanalyzer精确检测 RNA 完整性。
1.4 文库的构建及测序
转录组测序由北京诺禾致源科技股份有限公司完成,将2组小鼠肌肉的总RNA分别构建测序文库。首先通过磁珠法Oligo(dT)对带有PolyA尾的mRNA进行富集,随后将其分割成短片段mRNA,用随机引物进行扩增,逆转录合成第1条cDNA 链,随后采用 RNaseH、DNA Polymerase I、dNTPs为原料降解RNA并且合成第2条cDNA链。使用AMPure XP beads 纯化双链产物,最后将DNA末端修复成平末端,加PolyA尾、接头,最终获得文库。文库质量合格后进行Illumina测序。
1.5 数据分析
1.5.1 数据质控 将测序片段的图像数据转化为序列数据(Reads),对原始数据进行过滤,去除带接头的、无法确定碱基信息的、低质量的Reads。同时,对Clean data进行Q20、Q30和GC含量计算,供后续分析。
1.5.2 RNA比对及基因表达水平的测定 获得基础数据后,直接从基因组网站下载参考基因组和基因模型注释文件,使用HISAT2构建参考基因组的索引,并将Clean data与参照基因组进行比对,HISAT2可以基于基因模型注释文件生成拼接连接的数据库。利用featureCounts软件计算映射到每个基因的读数,再根据基因的长度计算每个基因的FPKM(FPKM指每百万碱基对测序的转录本序列片段的每千碱基片段的预期数量),并计算映射到该基因的读数。
1.5.3 差异表达分析 使用 DESeq2 软件进行 2 个组合之间差异表达分析[12](每个组3个生物学重复)。差异表达基因 (Differentially expressed gene,DEG)是通过 DESeq2 选择阈值为Padj<0.05,|log2(差异倍数)|≥0筛选出来的基因(Padj是Benjamini和Hochberg法矫正后的P值)。通过clusterProfiler软件使用Gene Ontology数据库对差异表达基因进行GO富集分析。利用KEGG(Kyoto encyclopedia of genes and genomes)数据库找出差异表达基因显著富集的信号通路[13],用于分析分子水平的信息,使用clusterProfiler软件分析KEGG 通路中差异表达基因的统计富集。
1.5.4 实时荧光定量PCR验证 从差异表达基因中挑选了一部分进行了实时荧光定量PCR(qPCR)验证。反应体系为 10 μL:5 μL 的 2×SYBR Green MasterMix,1 μL cDNA 模板,0.3 μL 上、下游引物和 3.4 μL ddH2O。反应条件为:95 ℃10 min;95 ℃15 s,60 ℃15 s,72 ℃10 s,共 40 个循环;72 ℃10 min。每个基因做3个重复,以β-actin作为内参基因,用2-ΔΔCt方法计算基因相对表达量。
2 结果与分析
2.1 小鼠的基因型鉴定
如图1所示,如果小鼠是野生型小鼠,经过PCR能根据引物Primer-M和Primer-R得到460 bp长度的片段,如果小鼠是ETV5纯合敲除的小鼠,则扩增出Primer-F到Primer-R之间的1段710 bp的序列,同理,如果是杂合敲除的小鼠,则2种片段都有。因此,可以根据PCR产物的大小判断小鼠的基因型。

图1 ETV5敲除小鼠基因型鉴定原理图Fig.1 Identification principle of ETV5 knockout mouse genotype
选取部分后代小鼠中的公鼠,提取组织DNA后,用PCR法检测基因型,结果如图2所示,泳道2、3、4 只扩增到 1 个条带 (460 bp),说明所代表的这3只小鼠是野生型,泳道5、6、7只扩增到1个条带(710 bp),说明所代表的这3只小鼠是纯合敲除,泳道 8、9、10扩增到 2个条带 (710和 460 bp),说明所代表的这3只小鼠是杂合敲除。
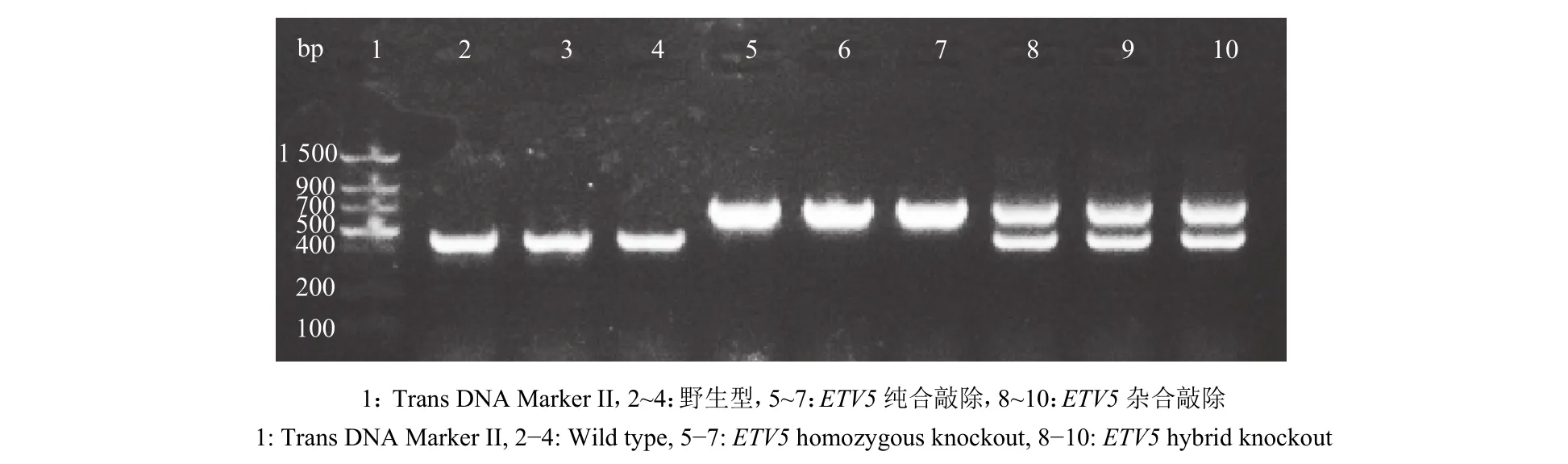
图2 ETV5基因敲除小鼠基因型鉴定Fig.2 Genotype identification of ETV5 knockout mice
ETV5纯合敲除小鼠的PCR产物测序结果如图3所示,将测序结果和NCBI上的小鼠ETV5基因序列进行比对,结果显示,从 22 253 855~22 259 641缺失了5 607个碱基。
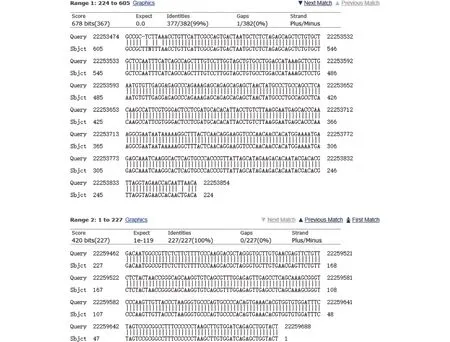
图3 ETV5纯合敲除小鼠测序结果和NCBI序列的比对Fig.3 Comparison of sequencing results of ETV5 homozygous knockout mice and NCBI sequence
2.2 2组小鼠的体质量比较
在2组公鼠42日龄时,对它们的体质量进行测量,得到结果如图4所示,WT组的体质量显著高于ETV5-/-组的体质量。

图4 ETV5基因敲除与野生型小鼠在42日龄时的体质量Fig.4 The body weight of the ETV5 knockout mice and wild type mice at 42 days of age
2.3 参考基因组比对结果
根据比对结果,分别统计Reads在基因组外显子区域(Exon)、内含子区域(Intron)以及基因间区(Intergenic)所占的比例。WT和ETV5-/-组的比对结果基本一致,大约95%的Reads比对到外显子区域。
2.4 差异表达基因
我们筛选出了574个差异表达基因,其中上调基因292个,下调基因282个。对这574个差异表达基因进行染色体定位,结果如图5所示,发现差异表达基因在11号染色体最多,其次是5号染色体。图6的热图显示筛选出的差异表达基因的上、下调水平。部分差异表达基因见表1。
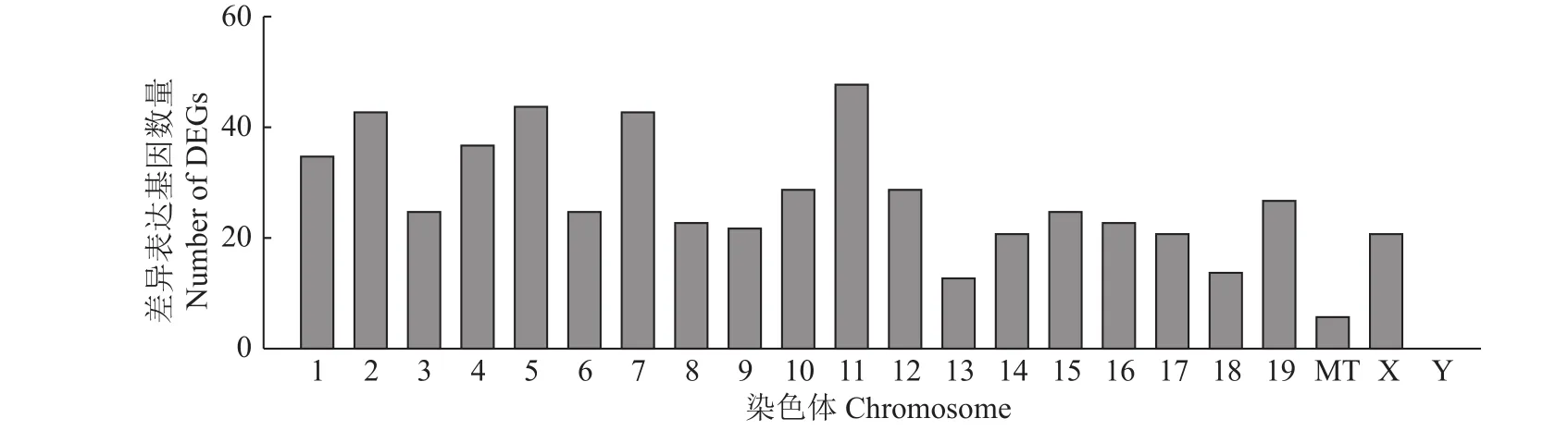
图5 差异表达基因在各染色体上的分布Fig.5 Distribution of DEGs on each chromosome
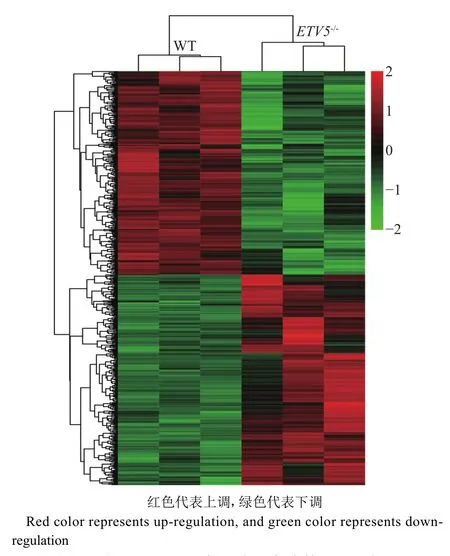
图6 小鼠肌肉组织中的差异表达基因聚类热图Fig.6 Clustering heat map of DEGs in mouse muscle tissue
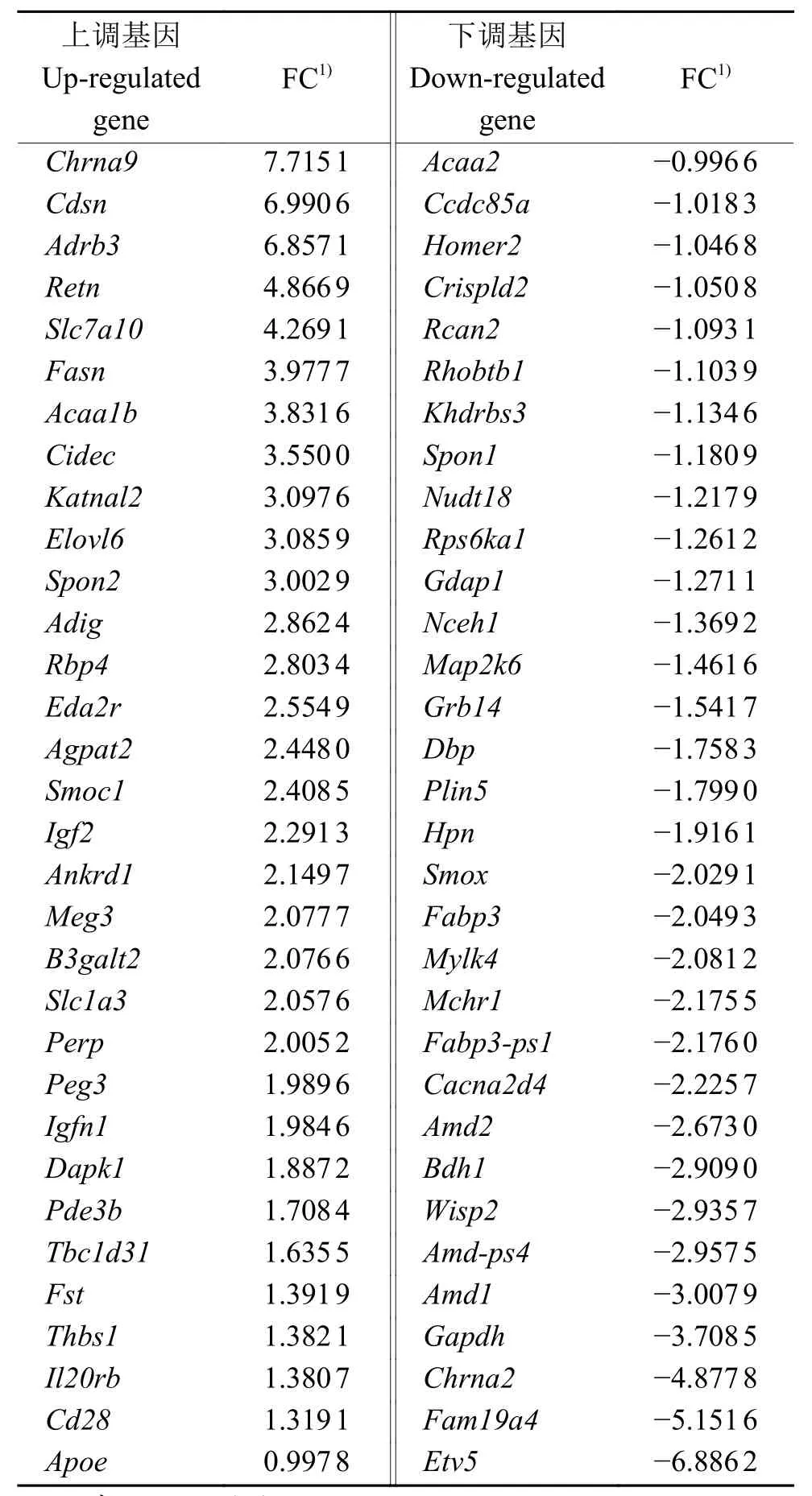
表1 部分差异表达基因Table 1 Partial DEGs
2.5 GO富集分析
为了进一步解析筛选出来的差异表达基因的功能,我们进行了GO富集分析,结果如图7所示。富集在生物学过程的最多,其中在生物过程中富集程度前5的都与脂肪代谢相关,包括:脂肪酸代谢、脂质氧化、脂质分解代谢、脂肪细胞分化、脂肪酸氧化。显著富集的细胞组成相对较少,只有5个,分别是:线粒体内膜、细胞器内膜、脂滴、细胞外基质、受体复合体。前5个显著富集的分子功能分别是:辅酶结合、生长因子结合、硫化合物结合、脂肪-酰基-辅酶A结合、胰岛素样生长因子结合。

图7 ETV5基因敲除与野生型小鼠肌肉组织差异表达基因GO富集分析Fig.7 Enrichment analysis of DEGs between ETV5 knockout mice and wild type mice muscle
2.6 KEGG富集分析
我们还对差异表达基因进行了KEGG富集分析,图8结果表明有20条KEGG通路得到显著富集,其中差异表达基因主要富集到代谢通路中,例如:脂肪酸代谢、cAMP信号通路、PPAR信号通路、AMPK信号通路、不饱和脂肪酸生物合成、脂肪酸降解和丙酮酸代谢等。
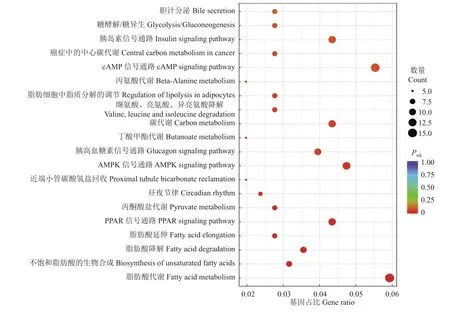
图8 ETV5基因敲除与野生型小鼠肌肉组织差异表达基因的KEGG富集分析Fig.8 KEGG enrichment analysis of DEGs between ETV5 knockout mice and wild type mice muscle
2.7 qPCR验证分析
将分析得到的部分差异表达基因进行了qPCR验证,结果显示与测序结果一致(图9),敲除ETV5基因影响了部分其他基因的表达,其中腺苷甲硫氨酸脱羧酶 1(Adenosylmethionine decarboxylase 1,Amd1)[14]的cDNA编码肌源性碱性螺旋-环-螺旋(Basic helix-loop-helix,bHLH)因子的一个家族成员,此外,Amd1基因在成人体壁肌肉中有明显表达,但在心脏和其他非肌肉组织中未见表达,肌源性bHLH因子参与了肌肉发育和形成。另外,胆碱能受体烟碱 α2(Cholinergic receptor nicotinic alpha 2,Chrna2)对脂肪的形成和代谢有重要作用,Jun等[15]敲除了小鼠的Chrna2基因,发现由于小鼠体内脂肪细胞自主调节异常,导致了小鼠在寒冷环境中产热和代谢功能的障碍,揭示了Chrna2通路在米色脂肪生物发生和能量稳态中的生物学意义。除此之外,差异表达基因中还有Hpn[16],Wisp2[17],Cxcl14[18],Mylk4[19],Plin5[20],Mchr1[21]等一些基因影响了ETV5敲除小鼠的肌肉发育、脂肪累积和体质量变化。
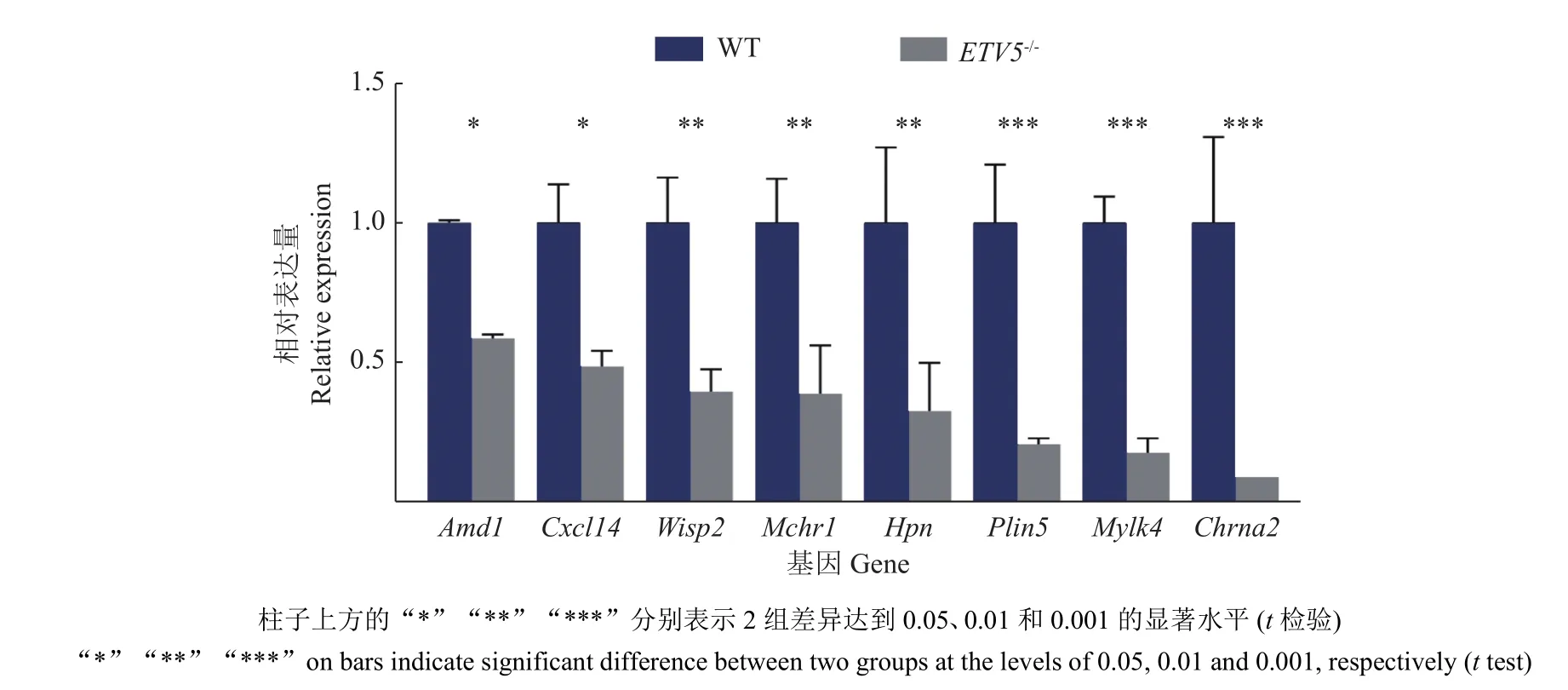
图9 qPCR检验差异表达基因在ETV5基因敲除和野生型小鼠肌肉组织的相对表达量Fig.9 Detecting the relative expression of DEGs in muscle tissue of ETV5 knockout and wild type mice by qPCR
3 讨论与结论
Wang等[22]前期通过基因编辑技术制备了ETV5基因敲除的小鼠模型用来研究该基因与精原干细胞发育的关系,但是基因编辑带来的影响并不是单一的,虽然敲除小鼠的ETV5基因的确得到了内源性精原细胞消融的“唯支持细胞综合征”表型,但是同时也影响了小鼠的整体发育和生长,而产生这些表型的分子机制很少有人报道。为此,我们通过转录组测序得到了ETV5敲除小鼠和野生型小鼠的转录本,分析两者之间存在的差异表达基因,通过生物信息学的方法分析得到了敲除ETV5基因可能对小鼠产生影响的分子机制。结果表明,敲除ETV5后的小鼠与野生型小鼠相比差异表达基因大部分为编码蛋白的基因,差异表达基因中的部分基因对动物的生长发育、肌肉发育以及脂肪累积等有不同的影响,从而影响了ETV5敲除小鼠的肌肉发育和脂肪累积,出现体质量下降以及发育不良的现象。
GO富集分析的结果显示,富集前5的生物学过程都与脂肪代谢相关,分别是:脂肪酸代谢、脂质氧化、脂质分解代谢、脂肪细胞分化、脂肪酸氧化。这表明,敲除ETV5基因对小鼠的脂肪代谢影响很大,可能导致了小鼠储存脂肪的障碍。KEGG富集分析的结果显示,所有差异表达基因主要富集在脂肪酸代谢、cAMP信号通路、PPAR信号通路、AMPK信号通路等方面。PPAR通路可以调节脂质代谢、脂肪形成、维持代谢的稳态以及炎症基因的表达。PPAR在不同的物种中找到了3种亚型,PPARα通过调节参与肝脏和骨骼肌脂质代谢基因的表达以在细胞脂质中发挥作用[23],PPARβ/δ参与脂质分解代谢、葡萄糖稳态、炎症、生存、增殖、分化以及哺乳动物皮肤、骨骼和肝脏的再生[24],PPARγ可调节糖和脂代谢、内皮功能和炎症[25]。测序结果中的Plin5、Fabp3等部分差异表达基因在PPAR通路中起作用。GO和KEGG分析的结果表明,敲除ETV5基因可能会影响小鼠的脂肪代谢、能量代谢以及整体的发育。
本研究对ETV5敲除小鼠和野生型小鼠的肌肉组织进行了转录组测序分析,以探究敲除ETV5基因对小鼠肌肉形成以及生长发育相关基因和信号通路的影响。结果表明,我们筛选出了574个差异表达基因,这些差异表达基因大多与脂肪代谢以及生长发育相关,其中发现Amd1可能影响了ETV5敲除小鼠的肌肉发育,Chrna2可能影响了ETV5敲除小鼠的脂肪代谢。GO和KEGG分析显示差异表达基因主要富集在脂肪代谢、能量代谢的通路,这也能对应我们观察到ETV5敲除小鼠发育不良的表型。这些结果为敲除ETV5基因导致小鼠发育的缓慢和延迟提供了解释,以及为研究ETV5基因的体内多样性功能提供了参考。

