PKM2促进子宫内膜癌细胞增殖的作用及机制研究*
孙丽丽,车晓霞,冯炜炜
(上海交通大学医学院附属瑞金医院妇产科,上海 200025)
子宫内膜癌(endometrial cancer,EC)是女性生殖系统常见的三大恶性肿瘤之一,占女性生殖道恶性肿瘤的20%~30%,占女性恶性肿瘤的7%。最新流行病学数据显示,全球范围内每年有320000例新发病例及76000例死亡病例[1]。尽管近20年大多数癌症患者的预后有所改善,但子宫体肿瘤的死亡率增加了20%以上[2]。因此,迫切需要开发有效策略来诊断和治疗EC。
在肿瘤组织中,即使氧气充足,恶性肿瘤细胞仍可进行活跃的葡萄糖糖酵解,这种特殊的代谢特征被称为Warburg效应[3]。丙酮酸激酶(pyruvate kinase,PK)作为糖酵解的关键酶之一,作用于其底物磷酸烯醇式丙酮酸形成丙酮酸[4],包括四种不同的亚型:L,R,M1,M2[5]。其中PKM2广泛分布于脑组织和肝组织[6],且在大多数肿瘤细胞中表达上调,表明PKM2有希望作为癌症治疗的靶点[7]。PKM2的低聚物存在高活性的四聚体和低活性的二聚体两种形式,PKM2蛋白在健康组织中可以从高活性的四聚体切换至低活性的二聚体[8]。然而在肿瘤细胞中,PKM2通常以低活性的二聚体存在,调节糖酵解的限速步骤,导致肿瘤细胞通过磷酸戊糖途径产生过多乳酸等分子,从而促进肿瘤细胞的增殖和生长[9-10]。PKM2作为糖酵解途径的关键酶之一,已在多种肿瘤中被发现高表达,如直肠癌、乳腺癌、肺癌、肝癌和胃癌等[11]。PKM2在内膜癌中的研究甚少,机制尚不明确。本文将通过TCGA数据库及瑞金样本RNA表达谱数据库分析PKM2在内膜癌及正常内膜中的表达差异,在内膜癌细胞株中通过慢病毒转染干扰PKM2后,检测内膜癌细胞增殖能力的变化及相关机制。
1 资料与方法
1.1 临床样本 用于荧光定量PCR的15例正常内膜组织(行宫腔镜检查的患者,术后病理提示:增殖期子宫内膜)和40例内膜癌组织及用于免疫组化的90例子宫内膜样腺癌的癌旁和癌组织芯片均来自于2013~2017年就诊于上海交通大学医学院附属瑞金医院的患者。用于RNA表达谱测定的5例正常内膜组织来自于瑞金医院妇产科行宫腔镜检查的患者,术后病理提示:增殖期子宫内膜,21例内膜癌组织(3例透明细胞癌,5例浆液性癌,13例子宫内膜样腺癌)来自于复旦大学附属妇产科医院。
1.2 内膜癌细胞株和培养试剂 AN3-CA、ECC-1、Ishikawa、RL95-2、KLE、HEC-1A和HEC-1B 7株细胞株均购于上海中科院。所有细胞均包含细胞鉴定报告,每6个月进行支原体检测,均提示阴性。所有细胞株均用添加100μg/mL青链霉素、含10%胎牛血清的RPMI 1640培养基于37℃、5%CO2孵箱进行培养。
1.3 实验方法
1.3.1 PKM2敲低稳转株构建 RL95-2细胞PKM2敲低稳转株(RL95-2-NC,RL95-2-shPKM2-1,RL95-2-shPKM2-2)是通过亚克隆到 RNAi pLenti hU6-MCS-CMV-zsGreen1-PGK-Puro 载体中,基于慢病毒的稳定 shRNA 建立的(中国上海领恪有限公司)。NC靶序列: 5'-UUCUCCGAACGUGUCACGU-3' ; sh-PKM2-1靶序列: 5'-GGAAAGAACAUCAAGAUUAUC-3'; shPKM2-2靶序列:5'-UUGGUGAGGACGAUUAUGGTT-3'。
1.3.2 平板克隆实验 将RL95-2-NC、RL95-2-shPKM2-1、RL95-2-shPKM2-2按600细胞/孔接种于6孔板中培养12~14天。4%多聚甲醛固定30min,20%结晶紫染色15min,拍照,应用Image J软件进行计数。
1.3.3 CCK-8实验 将细胞稳转株RL95-2-NC、RL95-2-shPKM2-1、RL95-2-shPKM2-2按5000细胞/孔分别接种于96孔板中培养6天。在特定的培养时间下,每孔加10μL CCK-8试剂孵育1h,应用酶标仪检测450nm的OD值。
1.3.4 实时定量PCR方法 TRIzol法提取7株细胞株、15例正常内膜组织及40例内膜癌组织的总RNA。应用PrimeScriptTM试剂盒和SYBR Premix Ex TaqTMII试剂盒(Takara Bio Inc.,Shiga,Japan)将mRNA逆转录为cDNA,进行PCR反应。引物均购自上海BioTNT公司。反应条件:95℃ 10min,95℃ 15s,60℃ 1min,共40个循环,72℃延伸10min。引物序列:GAPDH上游为5'-CGGAGTCAACGGATTTGGTCGTAT-3';下游为5'-AGCCTTCTCCATGGTGGTGAAGAC-3'。PKM2上游为5'-ATTATTTGAGGAACTCCGCCGCCT-3';下游为5'-GTTGAAGGTAGTTTCGTGGA-3'。
1.3.5 组织芯片染色法 90对福尔马林固定石蜡包埋的内膜癌和癌旁组织微阵列芯片均出自上海交通大学医学院附属瑞金医院。将患者组织的载玻片与抗PKM2兔单克隆抗体(1∶100,ab210114)和Ki67(1∶100,GB13030-2,Goodbiotechnology,中国武汉)抗体进行孵育。通过阳性染色细胞的百分比评估PKM2表达水平,并根据染色强度和免疫反应细胞的百分比确定IHC指数。染色强度分为0分(阴性)、1分(弱阳性)、2分(中度阳性)或3分(强阳性),染色百分比分为0分(0%)、1分(1%~25%)、2分(26%~50%)、3分(51%~75%)或4分(76%~100%)。IHS(免疫组化评分)计算方法是将数量和强度评分相乘,范围从0到12分。如前所述,0~6分的IHS评分为低表达,7~12分的IHC评分为高表达。
1.3.6 免疫印迹法 7株细胞株沉淀应用RIPA(50mmol/L Tris-HCl,150mmol/L NaCl,1% NP-40,0.5% sodium deoxycholate和0.1% SDS)在冰上裂解30min。4℃,12000g离心20min。吸取蛋白上清至新的EP管,加5*loading buffer,100℃金属浴蛋白变性10min。随后进行凝胶电泳,一抗4℃孵育过夜,PKM2,1∶1000(ab85555);HIF-1α,1∶1000(ab216842);GAPDH,1∶1000(ab8245);二抗冰上孵育2h,显像拍照。
1.3.7 RNA表达谱测定 RNA表达谱测定应用NEBNext Ultra TM RNA Library Prep Kit for Illumina(NEB公司,美国)生成的测序文库。应用TruSeq PE Cluster Kit v3-cBot-HS系统进行样品聚类,并在Illumina NovaSeq平台上对文库制备物进行测序。

2 结 果
2.1 PKM2在TCGA数据库内膜癌组织中表达显著上调 下载并整合TCGA数据库(https://cancergenome.nih.gov/)中内膜癌RNA表达谱结果,发现相对于24例内膜癌癌旁组织,PKM2在177例内膜癌组织中表达显著上调(P<0.001),见图1A;PKM2高表达与组织学级别呈正相关(P<0.05),见图1B;通过临床数据分析,PKM2高表达的内膜癌患者提示不良预后(P<0.05),见图1C。通过对瑞金样本库中5例正常内膜组织及21例内膜癌组织进行RNA表达谱测定。结果显示,相对于正常内膜组织,PKM2在内膜癌组织中表达显著上调(P<0.05),图1D。RT-PCR法测定15例正常内膜组织和40例内膜癌组织中PKM2 mRNA水平,结果显示内膜癌组织中PKM2 mRNA表达显著上调(P<0.001),见图1E。
2.2 内膜癌组织中PKM2高表达的临床病理学特征 免疫组化法结果显示,相对于癌旁组织,PKM2表达在内膜癌组织中明显上调,并随着组织学级别的升高而升高(图2)。内膜癌组织及癌旁组织中PKM2高表达率分别为68.4%和24.6%,提示PKM2在内膜癌组织中表达升高。
2.3 敲低PKM2显著抑制内膜癌细胞的增殖 7株内膜癌细胞株中,RL95-2细胞株中PKM2 mRNA及蛋白表达最高(图3A、B),选该细胞株进行后续功能验证。在RL95-2细胞株中,通过慢病毒质粒构建PKM2敲低稳转株,RL95-2-NC,RL95-2-shPKM2-1,RL95-2-shPKM2-2,PCR及免疫印迹验证PKM2干扰效率(图3C、D)。CCK-8及平板克隆实验结果显示,相对于NC组,干扰PKM2后,细胞增殖能力及克隆形成能力显著减弱(图4A、B,P<0.01)。

图1 内膜癌组织中PKM2表达上调

图2 免疫组化法
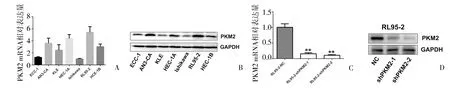
图3 内膜癌细胞株中PKM2表达及RL95-2细胞株中敲低PKM2表达效率验证
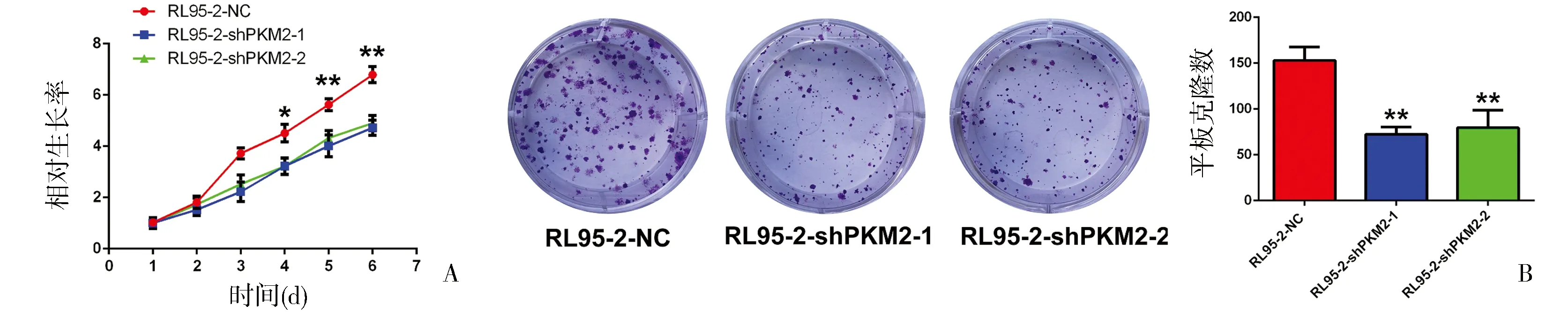
图4 在RL95-2细胞株中,敲低PKM2表达后,抑制了细胞增殖
2.4 PKM2诱导HIF-1α蓄积并激活NF-κB信号通路 通过GEPIA(http://gepia.cancer-pku.cn)数据库分析网站,Pearson相关分析结果显示,HIF-1α与PKM2的mRNA表达呈正相关(P<0.05)(图5A)。RL95-2细胞中,干扰PKM2表达后,HIF-1α、p65及p-IKB-α蛋白表达显著下调(图5B)。
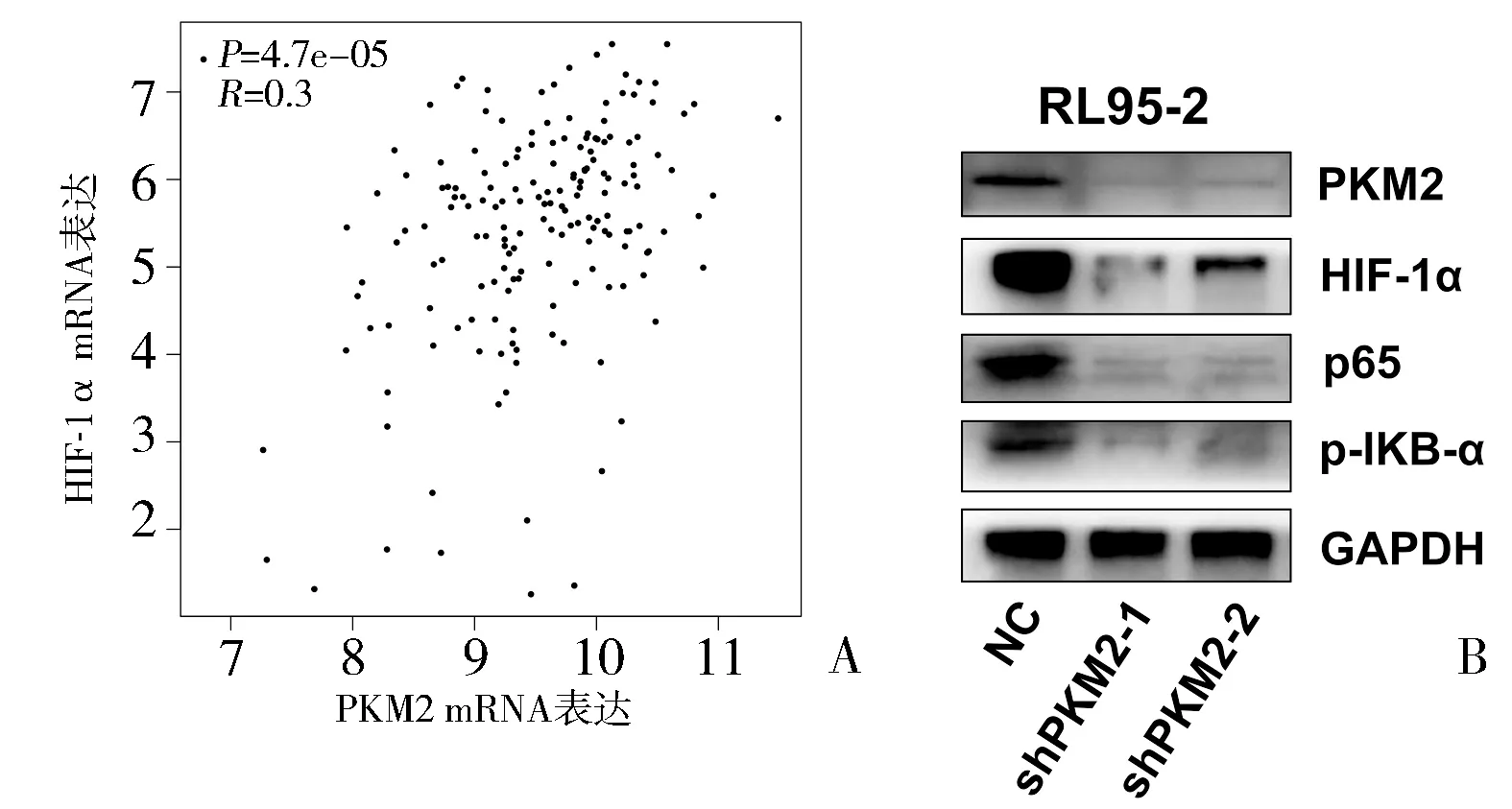
图5 PKM2诱导HIF-1α蓄积并激活NF-κB信号通路
3 讨 论
肿瘤细胞在改变新陈代谢的情况下有效地将葡萄糖等营养物质整合到生物质中以促进肿瘤细胞的异常增殖。作为糖酵解的最终和限速反应酶,与正常组织相比,PKM2在肺癌、乳腺癌、前列腺癌、血液、宫颈癌、肾癌、膀胱癌、甲状腺乳头状癌和结肠癌等多种人类肿瘤组织及细胞中表达显著增加[12],提示PKM2在多种肿瘤中作为治疗靶点的可能性。本研究中,通过下载、整合、分析TCGA内膜癌公共mRNA数据库,发现相对于癌旁组织,PKM2在内膜癌组织中表达显著上调,其高表达的PKM2与内膜癌组织学分级及不良预后相关。结合瑞金标本库RNA表达谱测定结果及RT-PCR验证显示,相对于正常内膜组织,PKM2 mRNA在内膜癌组织中表达上调。通过组织芯片免疫组化法结果显示,相对于癌旁组织,PKM2蛋白在内膜癌组织中表达显著上调,且随着组织学级别升高,表达升高。
PKM2除了作为丙酮酸激酶的作用外,还具有蛋白激酶的作用,参与细胞增殖、迁移和凋亡基因的转录共激活因子的功能[13]。研究证实,宫颈癌、肝癌及肾癌细胞中,PKM2可转运至细胞核中,与HIF-1α结合,激活HIF-1α下游靶基因的转录表达,促进细胞的增殖活性[14-15]。本研究结果显示,7株内膜癌细胞株中,RL95-2细胞中PKM2 mRNA及蛋白表达最高。在RL95-2细胞中,干扰PKM2表达后,显著抑制了细胞增殖。文献报道,PKM2可参与调控HIF-1α表达及STAT3、NF-κB等经典信号通路[16]。Western blot法结果显示,在RL95-2细胞中,干扰PKM2后,HIF-1α、p65及p-IKB-α表达显著下调。
综上所述,子宫内膜癌中,PKM2高表达可能通过上调HIF-1α表达,激活NF-κB信号通路促进内膜癌细胞的增殖。PKM2有望作为子宫内膜癌诊断及治疗的有效靶标。

