基于高通量测序的天麻连作根际土壤真菌群落多样性分析
蔡丽琼,陈瑞,杨德强,赵长林*
(1.西南林业大学生物多样性保护学院,云南 昆明 650224;2.云南国诚农业发展有限公司,云南 昭通 657000)
天麻(Gastrodia elataBl.)又名赤箭、定风草、独摇芝等,兰科多年生草本植物,为优质道地药材[1-3]。20世纪50年代,天麻人工栽培技术被攻破,在全国范围内广泛推广并促进了天麻种植业的发展,但天麻连续多代种植后,会出现病害加重、产量降低和天麻品质变劣等问题[4]。连作障碍普遍存在于农业生产中,相较于其他作物,药用植物因其特殊化学物质及次生代谢产物,在生产过程中更易发生连作障碍[5-6]。
微生物是土壤中除植物和动物外的另一种能量载体[7-8],在土壤功能和植物健康等方面发挥重要调节作用[9-10],其群落结构在很大程度上决定着土壤的生物活性[11]。研究[12-14]揭示,随着种植年限的增加,多种药用植物根际土壤中的微生物群落结构均发生显著变化,如西洋参、三七、丹参等。刘伟等[14]研究揭示,丹参重茬种植后,其根际土壤中真菌群落结构发生显著变化,连作致使土壤中耐冷酵母属真菌丰度显著降低,异常威克汉姆酵母属真菌丰度显著上升,且连作两年土壤中炭疽菌属真菌等致病菌成为优势菌属,进而导致丹参发病率提升;高嵩等[15]基于龙胆草根际土壤细菌多样性研究表明:随连作年限增加,龙胆草根际土壤细菌多样性逐年降低,而病原微生物丰度增加,进而导致根际微生态失衡,造成龙胆草连作障碍;周界等[16]基于高通量测序技术分析穿心莲连作根际土壤细菌群落多样性发现连作种植降低了土壤细菌的丰富度和多样性,使土壤微生态平衡遭到破坏,同时有益菌相对丰度降低,病原菌相对丰度增加,进而造成细菌群落结构改变和失衡。
开展天麻及其根际土壤微生物研究,不仅有助于分析天麻与根际土壤微生物之间的相互作用机制,而且也有助于解决天麻病害防治及连作障碍等实际生产应用问题,提高天麻产量和品质。目前关于云南省昭通地区天麻与根际土壤微生物相互作用的研究报道较少,天麻在生长过程中与根际微生物相互作用的机制也不明确,因此,本研究通过高通量测序技术研究不同种植茬数天麻根际土壤真菌群落,分析其组成、丰度和多样性,旨在找到连作土壤中优势真菌类群,进而从微生物生态学角度研究天麻连作障碍的成因,为天麻连作障碍防治提供理论依据。
1 材料与方法
1.1 土壤样地条件
本研究对象分布于云南省昭通市彝良县乔山镇海坝村 (海拔 1650 m,27°39′33″N,104°16′14″E),年均气温11℃,年均降水量860 mm,属亚热带季风气候。
1.2 土壤样品采集
试验共设3个处理,所有处理均在同一块地上进行,土壤类型相同,每组试验相邻种植,间距30 cm,每个处理平行取样3份,共9个土样。空白组为未种植天麻的土壤(cha001:CLZ019、CLZ020、CLZ021)、新茬天麻土壤(cha002:CLZ0015、CLZ016、CLZ017)、重茬天麻土壤(cha003:CLZ079、CLZ080、CLZ081)。新茬天麻于2019年12月种下,2020年9月份收集天麻根际土壤样本;重茬天麻于2020年在新茬天麻土壤样地连续种下天麻,2021年9月收集重茬天麻根际土壤样本。根际土壤采用五点取样法,用铁铲除去覆盖天麻表面的土壤、植物根系、碎石及其他杂物,挖至天麻的块根部位,用灭菌的刷子和不锈钢铲收集附着于根系0~5 mm范围内的土壤,装入已灭菌的离心管(50 mL),注明样品编号、名称、地点、日期及采集者,置于-80℃冰箱保存,用于提取土壤真菌DNA。
1.3 试验方法
1.3.1 土壤总DNA的提取与电泳检测
分别取3个处理的土壤样品,使用E.Z.N.A.© soil DNA kit(Omega Bio-tek,Norcross,GA,U.S.)土壤DNA试剂盒,按照说明书进行微生物群落总DNA的提取,使用1%的琼脂糖凝胶电泳检测DNA的提取质量,DNA浓度和纯度用NanoDrop 2000紫外可见分光光度计测定。
1.3.2 土壤真菌ITS序列的PCR扩增及高通量测序
将提取的总DNA作为模板,采用真菌通用引物ITS1-ITS2(ITS1F:5′-CTTGGTCATTTAGAGGAAGTAA-3′,ITS2R:5′-GCTGCGTTCTTCATCGATGC-3′)扩增。扩增程序为95 ℃预变性3 min,95℃变性30 s,55℃退火30 s,72℃延伸45 s,共35个循环,72℃终止延伸10 min结束。每个样品重复3次,混合同一样品的PCR产物,后使用2%琼脂糖凝胶回收PCR产物,利用AxyPrep DNA Gel Extractin Kit凝胶回收试剂盒进行回收产物纯化,2%琼脂糖凝胶进行电泳检测,采用QuantiFluorTM-ST对回收产物进行检测、定量。Miseq文库构建和测序均在北京诺禾致源科技股份有限公司进行,测序平台为Illumina Novaseq 6000。
1.3.3 生物信息学分析
对Illumina Miseq测序所得数据进行处理,得到优质序列进行下列分析。使用QIIME2软件对所得优质序列进行聚类,以97%的相似性将序列聚类为OTUs,挑选丰度最大的序列作为代表进行分类注释及分类学分析,使用R语言进行稀释曲线构建[17]。利用QIIME软件进行多样性分析,计算各物种多样性指数,用来衡量不同种植年限天麻根际土壤真菌多样性。利用QIIME软件生成不同分类水平上的物种丰度表,再利用R语言工具绘制成样品各分类学水平下的群落结构图。使用QIIME软件进行Beta多样性分析,比较不同样品在物种多样性方面的相似程度。
2 结果与分析
2.1 稀释曲线
基于稀释曲线可直接反映测序数据的合理性,间接反映样品中物种的丰富程度。当曲线趋于平缓时,说明测序数据量满足试验要求[18]。本研究测序数据的稀释曲线(图1)表明:OTU数目随着测序数量的增加而增加,曲线呈先上升后趋于平缓的趋势,当达到足够的数量之后,真菌曲线均进入饱和状态,即测序量足以覆盖土壤样品的真菌类群。本研究测序数据量合理,测序深度能够覆盖样品根际土壤中的全部真菌微生物。
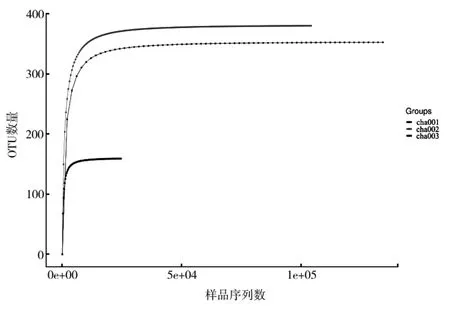
图1 天麻根际土壤样品真菌的稀释曲线Fig.1 Dilution curve of fungi in rhizosphere soil sample of Gastrodia elata
2.2 真菌群落丰富度多样性统计分析
本研究通过Illumina测序平台深入分析9个土壤样品,获得1 957 704条eads,每个样品至少产生30 891条Clean Reads,平均产生186 984条Clean Reads。在97%序列相似性基础上可划分为1342个OTUs,3组样品所含真菌OTU数量分别为723、675、210个,种植不同茬数天麻的根际土壤OTU数量排序为cha001(未种植)>cha002(新茬)>cha003(重茬)。Alpha多样性分析结果(表1)表明,不同种植茬数天麻根际土壤真菌群落丰富度指数 (Ace指数、Chao1指数)和多样性指数(Shannon指数、Simpson指数)存在如下规律:cha002>cha001>cha003,即3个处理样品变化趋势均呈现先升高后下降趋势。样品cha002的Ace指数和Chao1指数最高,揭示该样品中根际土壤微生物丰富度较高;样品cha002的Shannon均匀度指数最大,表明该样品中微生物群落分布的均匀度较高;3组样品覆盖度均为1.0,进一步阐释测序结果能够代表荞山镇天麻根际土壤微生物的真实情况。结果表明:新茬天麻土壤中的真菌多样性比未种植天麻的根际土壤丰富,而重茬天麻土壤中的真菌多样性显著低于未种植和新茬天麻土壤的,其暗示随着种植茬数增加,丰富度及多样性指数呈明显下降趋势,揭示了连续种植天麻明显降低了土壤真菌多样性,连作使土壤真菌群落的种类趋于单一化,且种类数量降低。
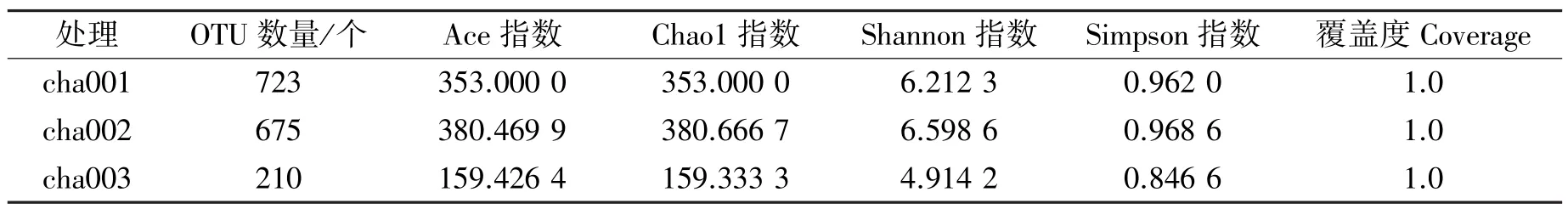
表1 天麻根际土壤样品真菌Alpha多样性Table 1 Fungi Alpha diversity of rhizosphere soil samples of Gastrodia elata
2.3 土壤真菌群落结构分析
2.3.1 在门水平上的土壤真菌群落丰富度分析
基于天麻不同种植茬数根际土壤的真菌群落在门水平进行分析,图2表明,其主要为Ascomycota、Basidiomycota、unclassified_Fungi、Mortierellomycota、Glomeromycota、Chytridiomycota、Rozellomycota、Mucoromycota、Kickxellomycota 9 个门。其中,Ascomycota、Basidiomycota、unclassified_Fungi和Mortierellomycota为突出优势菌门,Ascomycota为未种植天麻(cha001)和新茬天麻 (cha002)根际土壤真菌群落的第一优势菌门,相对丰度分别为56.20%和63.58%,随种植茬数增加相对丰度呈先升高后降低趋势;Basidiomycota为重茬天麻根际土壤真菌群落的第一优势菌门,相对丰度达42.83%,其丰度随种植茬数增加呈上升趋势;unclassified_Fungi在未种植天麻土壤中所占比例较高,达21.98%,丰度随连作茬数增加而降低;Mortierellomycota的丰度随连作茬数增加呈先升高后降低趋势。
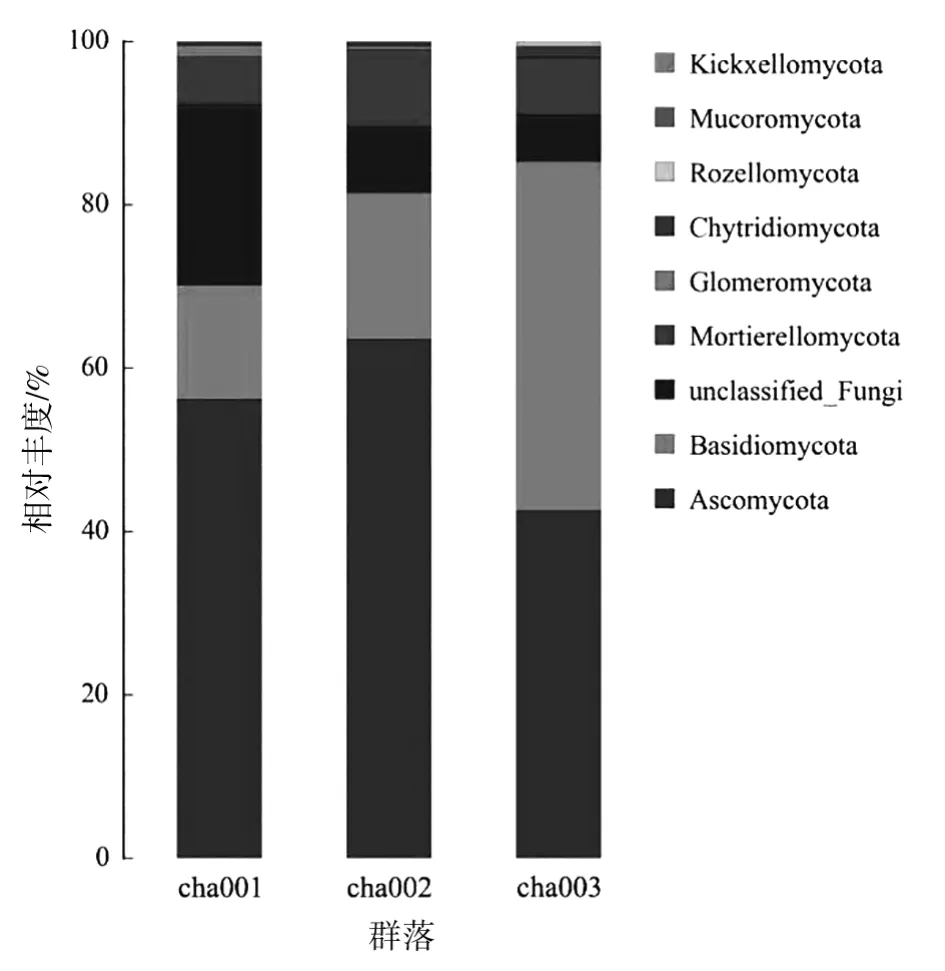
图2 不同根际土壤样品真菌在门水平上的相对丰度Fig.2 Relative abundance of fungi in different rhizosphere soil samples at phylum level
2.3.2 在纲水平上的土壤真菌群落丰度分析
通过对不同种植茬数天麻根际土壤纲水平的分析(图3),揭示其真菌群落分为27个类群,由高到低依次为 Agaricomycetes、Archaeorhizomycetes、unclassified_Ascomycota、unclassified_Fungi。其中,unclassified_Ascomycota为未种植天麻土壤真菌群落的第一优势菌纲,相对丰度达34%,该菌群丰度随天麻连作茬数的增加显著降低,其次为unclassified_Fungi,相对丰度达21.98%,相对丰度随种植茬数增加呈降低趋势;Archaeorhizomycetes为新茬天麻根际土壤真菌群落的第一优势菌纲,相对丰度达25.45%,连作提高了Archaeorhizomycetes的丰度,并随种植茬数的增加呈降低趋势;而Agaricomycetes为重茬天麻根际土壤真菌群落的第一优势菌纲,相对丰度达38.77%,该菌纲相对丰度随种植茬数的增加呈显著上升趋势。
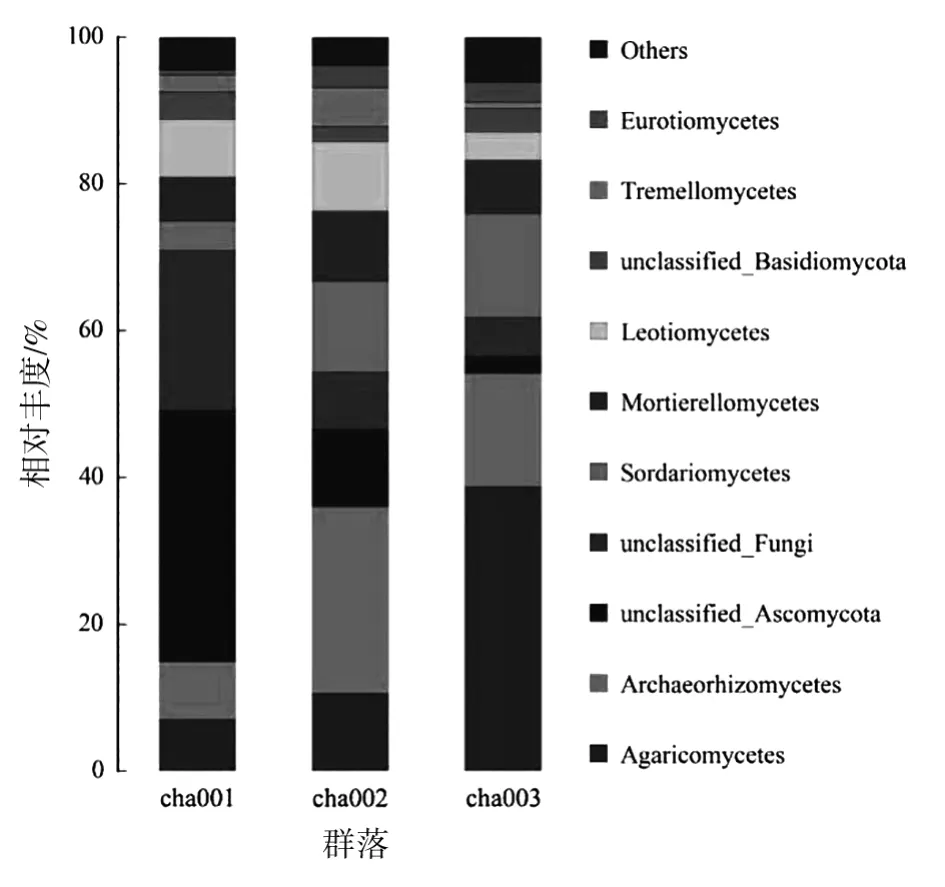
图3 不同根际土壤样品真菌在纲水平上的相对丰度Fig.3 Relative abundance of fungi in different rhizosphere soil samples at class level
2.3.3 在目水平上的土壤真菌群落丰度分析
基于不同种植茬数天麻根际土壤真菌群落在目水平上(图4)研究揭示:其分为59个类群,优势菌目由高到低依次为 Archaeorhizomycetales、unclassified_Ascomycota、unclassifed_Fungi、Mortierellales。其中unclassified_Ascomycota和unclassifed_Fungi在未种植天麻土壤中占比最高,相对丰度分别达34%、21.98%,并随种植茬数增加呈降低趋势;Archaeorhizomycetales在新茬天麻和重茬天麻土壤中相对丰度最高,达25.45%、15.49%,可以看出,连作显著提高了Archaeorhizomycetales的相对丰度,随种植茬数增加其丰度逐渐降低;连作天麻土壤中的Mortierellales丰度高于未种植天麻土壤中的相对丰度,且随种植茬数增加丰度逐渐降低。重茬天麻土壤中Helotiales和Polyporales相对丰度显著升高,该目在未种植和新茬天麻土壤中相对丰度极低,Polyporales在新茬天麻土壤中相对丰度为0,由此可见,天麻连作在目水平上改变了土壤中真菌群落结构。
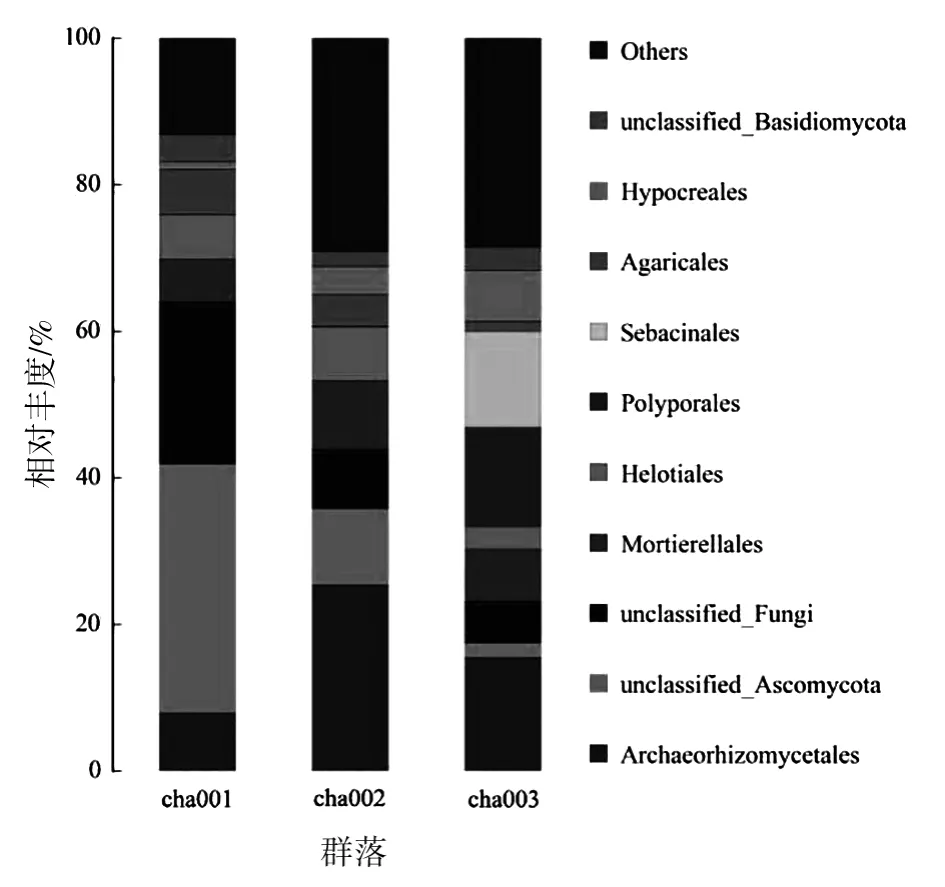
图4 不同根际土壤样品真菌在目水平上的相对丰度Fig.4 Relative abundance of fungi in different rhizosphere soil samples at order level
2.3.4 在属水平上的土壤真菌群落丰度分析
对不同种植茬数天麻根际土壤真菌群落属水平上 (图5)分析表明:共分为165个类群,优势菌属由高到低依次为Archaeorhizomyces、unclassified_Ascomycota、unclassified_Fungi、unidentified 和Mortierella。其中unclassified_Ascomycota和unclassified_Fungi为未种植天麻土壤中相对丰度最高的两个类群,相对丰度为34%、21.98%,且丰度随种植茬数的增加呈显著降低趋势;Archaeorhizomyces为新茬和重茬天麻根际土壤真菌群落的第一优势菌属,相对丰度达25.45%、15.49%,连作土壤中该类群丰度高于未种植天麻的土壤,随种植茬数增加呈降低趋势;连作还提高了土壤中Mortierella的丰度,且在重茬天麻根际土壤中出现新类群Sebacina和Paxillus。
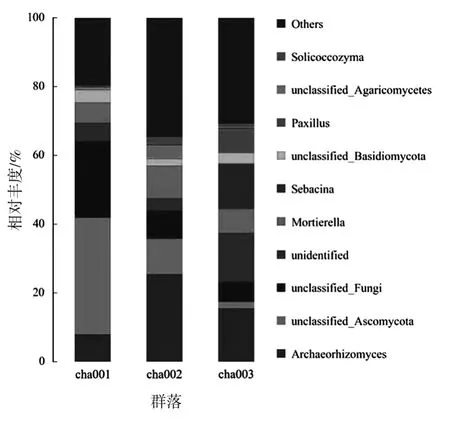
图5 不同根际土壤样品真菌在属水平上的相对丰度Fig.5 Relative abundance of fungi in different rhizosphere soil samples at genus level
2.4 不同年限土壤真菌菌群的分类学组成分析
采用R软件对不同种植茬数天麻根际真菌在门水平上的群落组成数据根据分类单元的丰度加以聚类,并通过热图呈现其分析结果(图6),通过聚类可以将高丰度和低丰度的分类单元区分,并以颜色梯度反映样品之间的群落组成相似度[12]。结果表明:横向真菌群落根据进化关系聚类为两大支,其中cha003组单独聚为一类,再与cha001和cha002组聚为另一类,这表明cha001和cha002组在群落结构分布上相近,与cha003组的真菌菌群结构分布有明显差异。纵向OTU间聚为两大支,根据变化趋势的类型基本上可以分为4类,类群(Ⅰ)在cha001组中所占比例较低,在cha003组中所占比例最高;类群(Ⅱ)在cha003组中所占比例较低,在cha001组中所占比例较cha002组高;类群(Ⅲ)在cha001组中所占比例较高,在cha002组和cha003组中所占比例均显著降低;类群(Ⅳ)在cha002组中所占比例较高,在cha003组中所占比例显著降低。
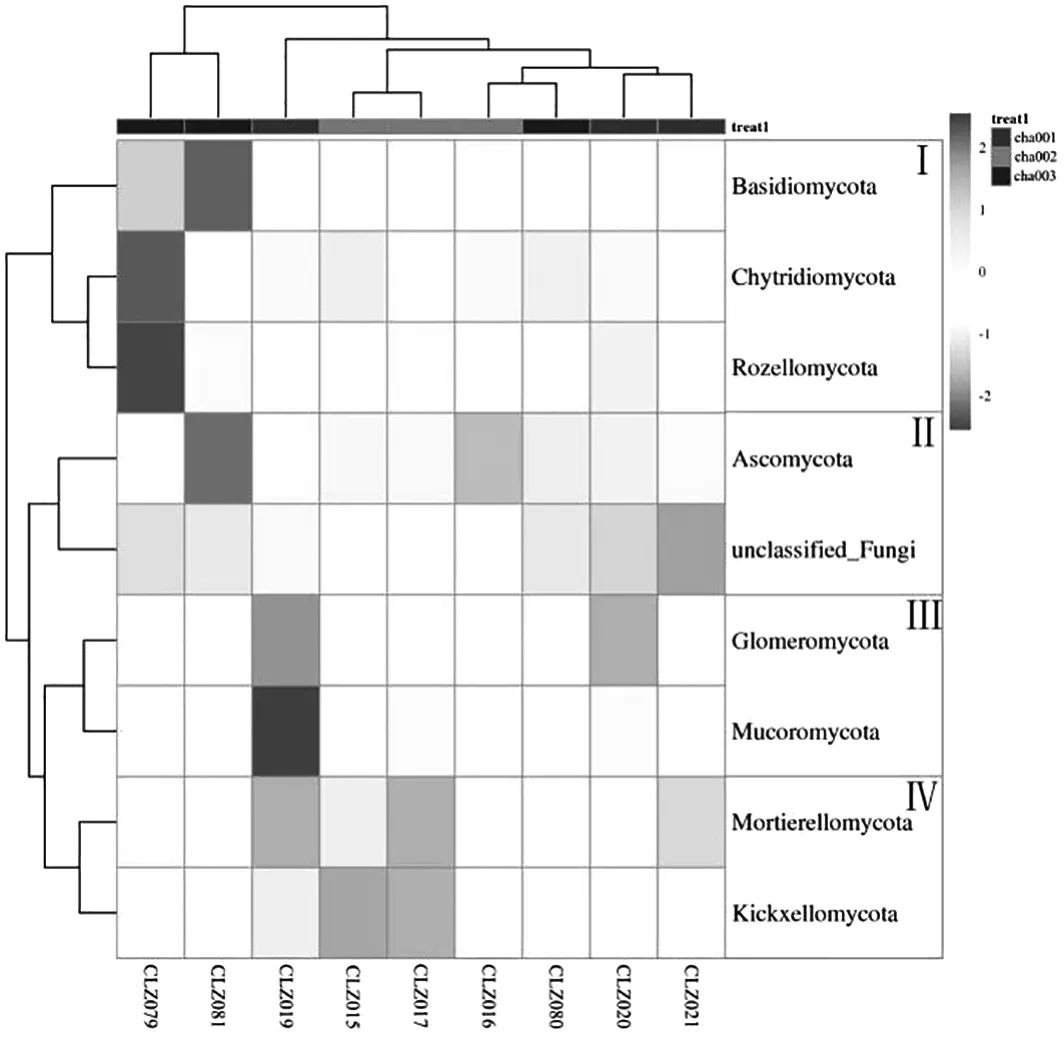
图6 不同根际土壤样品真菌在门水平上的聚类热图Fig.6 Cluster heatmap of fungi in different rhizosphere soil samples at phylum level
2.5 Beta多样性分析
采用β-多样性分析深入探究不同样本之间群落结构的相似性,主坐标分析[19](Principal coordinates analysis,PCoA)结果表明(图7):PC1的贡献率为46.72%,PC2的贡献率为17.55%,两者共解释了方差变量的64.27%。cha001、cha002和cha003相互之间的距离较远,说明不同种植茬数天麻根际真菌群落结构均具明显差异;cha002和cha003组表现出明显的组内聚集,表明这两组土壤样品具有极相似的真菌群落结构。UPGMA分析结果显示,样品越靠近,枝长越短,说明两个样品的物种组成越相似,如图8所示,不同种植茬数天麻根际真菌群落差异与PCoA分析结果一致。
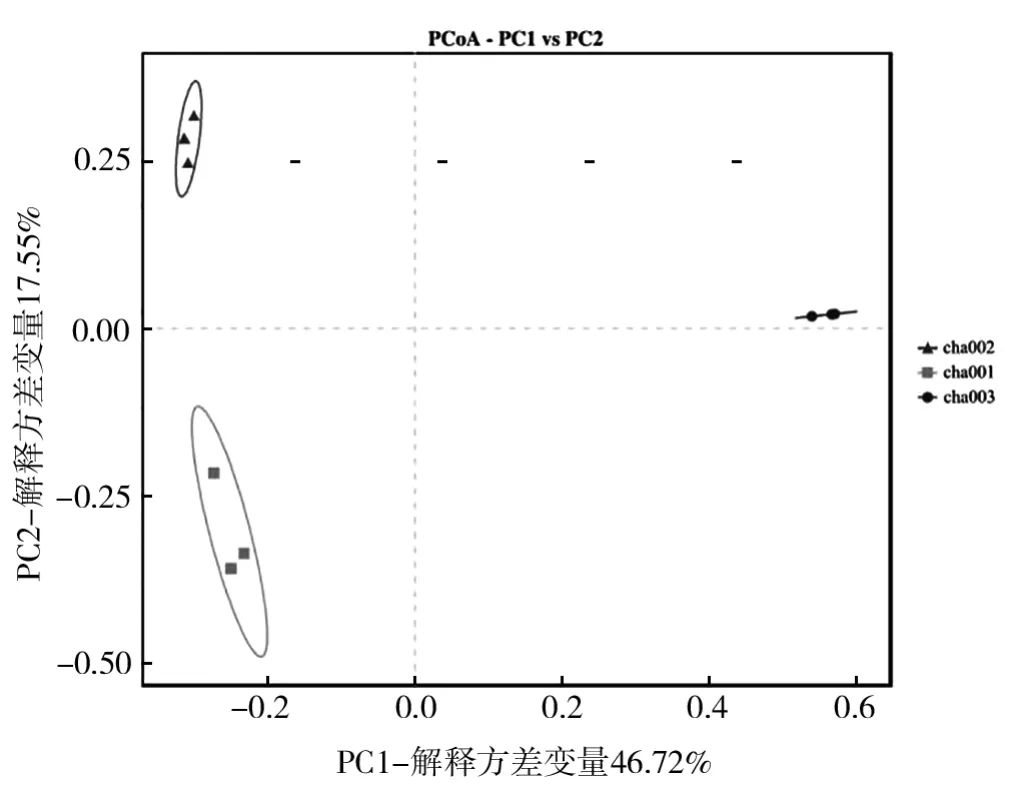
图7 不同根际土壤样品真菌群落的PCoA分析Fig.7 PCoA analysis of fungal communities in different rhizosphere soil samples
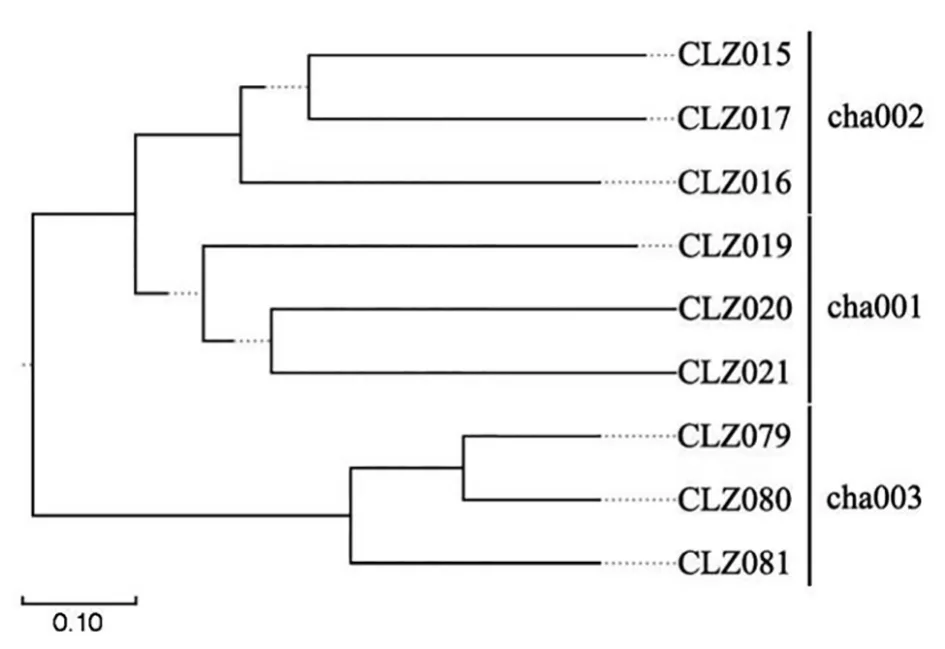
图8 不同根际土壤样品真菌群落的UPGMA分析Fig.8 UPGMA analysis of fungal communities in different rhizosphere soil samples
3 讨论与结论
土壤养分和微生物群落对作物的生长发育有着重要的影响[20]。在农业生态系统中,微生物多样性受多种因素影响,如气候条件、地理地势、植物物种、植物轮作、间作与连作等,其中,连作对微生物有显著影响[21]。土壤中有益微生物减少和病原微生物富集可引发作物各种土传病害,导致土壤微生物群落组成多样性失衡,这是造成连作障碍的根本原因[22]。本研究采用高通量测序技术开展了未种植天麻与连作天麻根际土壤真菌多样性及群落组成深入分析,结果表明:未种植天麻土壤中的OTU数量多于连作天麻根际土壤,新茬天麻根际土壤样本的Chao1指数、Ace指数和Shannon指数数值高于未种植天麻土壤样本,但无显著差异,重茬天麻根际土壤样本的Chao1指数、Ace指数、Shannon指数和Simpson指数数值显著降低,其揭示新茬天麻在一定程度上提高了土壤真菌群落的多样性,但重茬种植会导致土壤中真菌多样性降低。整体门水平剖析表明,天麻连作并未改变根际土壤真菌在门水平的种类组成,改变趋向于门下水平组成,其导致不同真菌类群比例在不同种植茬数中呈现出明显差异。门水平明晰连作天麻与未种植天麻根际土壤真菌界内Ascomycota为优势菌,这与前人相关研究结果一致[23-26],Ascomycota内部分腐生菌对土壤中不易降解的有机物有分解作用,可驱动养分循环[27-28],且自然界中多数Ascomycota具有很强的无性繁殖能力,可以产生大量分生孢子,其快速增长,在数量上占据明显优势[29],也是Ascomycota在众多植物根际中所占比例最大的原因。本研究中Ascomycota类群真菌在纲、目、属水平上unclassified真菌占比较高,且随连作茬数增加,丰度显著降低,但该类群真菌是否对天麻生长发育有直接影响,以及与天麻连作障碍的成因是否有关联还需进行深入研究。门水平上聚类热图结果表明,Basidiomycota、Chytridiomycota及Rozellomycota的丰度均在重茬天麻土壤中显著增加,而Ascomycota、Glomeromycota、Mucoromycota、Mortierellomycota及Kickxellomycota的丰度在重茬天麻土壤中均显著降低。本研究分析发现,unclassified_fungi在土壤真菌类群中占比较高,且随天麻连作茬数的增加,其丰度显著降低,其暗示天麻根际与非根际土壤中存在大量未知真菌类群或NCBI未报道类群,且其土壤生态学功能和与天麻生长发育之间互动关系有待进一步研究。
本研究基于属水平分析揭示各处理的真菌优势菌属存在较大差异,cha001处理优势菌属为unclassified_Ascomycota,cha002 和 cha003 的优势菌属为Archaeorhizomyces。unclassified_Ascomycota与unclassified_Fungi随连作茬数增加丰度显著降低。Archaeorhizomyces是常见的陆生好气真菌[30],该属一些种能利用葡萄糖或纤维素作为其唯一碳源,其暗示可能参与分解,且不需要通过共生从植物获得碳源,但其生态作用尚不清楚,前人研究[31]揭示该属真菌既不是病原菌,也不是外生菌根共生体。Mortierella真菌在不同种植茬数天麻土壤中占据一定比例,这与赵文静等[32-33]研究土壤真菌的多样性及茎瘤芥根肿病不同发病时期根际土壤真菌群落变化特征结果一致。Mortierella真菌是土壤中较为常见的真菌,且对土壤生态和作物健康有益,并能促进植物根系吸收矿质元素、抑制病原菌等[34-35]。基于门、纲、目、属水平上分析,连作天麻根际土壤中Mortierella丰度均呈现升高趋势,但随连作种植茬数增加其丰度逐渐降低,因此,其暗示Mortierella在天麻连作过程中扮演一种益生菌的角色,重茬土壤中其丰度显著降低,可能导致土壤中部分病原菌数量的增加,也是导致天麻连作障碍形成的因素之一。重茬天麻根际土壤中Sebacina和Paxillus真菌类群呈现由无到有的趋势,其在未种植天麻和新茬天麻根际土壤中未曾检查到,其揭示天麻连作直接对属水平土壤真菌组成结构造成影响。
本研究利用高通量测序技术分析未种植天麻与连作天麻根际土壤中微生物多样性和群落组成结构差异性,结果揭示连作种植改变了土壤真菌群落结构组成,导致土壤中部分真菌数量下降,致使土壤微生态平衡遭到破坏,进而不利于天麻的健康生长,最终导致连续单一种植天麻出现严重连作障碍。

