不同程度糖尿病性视网膜病变患者的生化指标及光学相干断层 扫描血管成像的差异
艾诗蓓,郑枞,曹明哲,杜芳芳,刘鑫鑫,徐楠,彭鸿钧,陆丽娇
(中山大学附属第七医院眼科,广东 深圳 518000)
2021年全球20~79岁人群的糖尿病患病率约为10.5%(5.366亿人),而我国约有1.4亿糖尿病患者[1]。作为糖尿病最为常见的并发症之一,糖尿病患者中糖尿病性视网膜病变(diabetic retinopathy,DR)的患病率为22.27%,而视力威胁性糖尿病性视网膜病变(vision-threatening diabetic retinopathy,VTDR)为6.17%[2]。英国一项为期11年的队列研究[3]表明:若进行稳定的人群筛查,VTDR的阳性率将随着时间推移持续下降到较低水平(2%)。因此,准确稳定的筛查工具对于DR的早期诊断和监测至关重要。既往研究[4]往往将荧光素血管造影(fluorescein angiography,FA)作为微血管瘤、无灌注区、新生血管等DR特征的金标准,但是作为一种侵入性检查,FA同时也可能伴随着恶心、呕吐、瘙痒、过敏等不良反应,并存在缺乏深部分辨率、染料渗漏后细节丢失等问题。所以非侵入性成像技术成为了需要频繁随访检查或不能耐受荧光素注射不良反应患者的理想选择[5]。光学相干断层扫描血管成像(optical coherence tomography angiography,OCTA)作为一种能够无创、迅速地对视网膜微血管循环进行3D成像的技术,既可以发现DR的微动脉瘤、新生血管及毛细血管无灌注区等微血管改变,也可对视网膜血管线性密度(vascular density,VD)及血管灌注密度(perfusion density,PD)等进行可重复地客观定量分析,已被逐渐应用于筛查DR[6-8]。本研究对比不同程度DR患者各生化指标及OCTA参数的差异,旨在发现OCTA不同血管扫描模式及各参数在DR早期筛查中的敏感性是否存在差异,并评估DR分级对糖尿病并发症的预测价值。
1 对象与方法
1.1 对象
选取2021年在中山大学附属第七医院眼科就诊的63例糖尿病患者为研究对象,收集患者的一般资料、眼科常规检查及OCTA数据。本研究获得中山大学附属第七医院科研伦理委员会的批准。
纳入标准:1)年龄>18岁;2)符合糖尿病诊断标准:糖尿病症状加①随机血糖≥11.1 mmol/L或②空腹血糖≥7.0 mmol/L或③75 g葡萄糖负荷后2 h血糖≥11.1 mmol/L,无糖尿病症状者需另日重复测量血糖以明确诊断;3)散瞳后眼底检查未见除DR外异常者。
排除标准:1)有视网膜激光光凝、玻璃体腔注药等内眼操作或手术史;2)存在散瞳药物过敏、青光眼、浅前房等散瞳禁忌,或患者拒绝行散瞳检查;3)屈光间质混浊影响成像质量,无法获取眼底照相或OCTA数据;4)患有视网膜动静脉阻塞、年龄相关性黄斑变性、缺血性视神经病变、视网膜血管炎、脉络膜新生血管等可能改变视网膜血流动力学的眼部疾病。
1.2 方法
1.2.1 一般资料获取
1)性别、年龄、血糖控制情况及各项生化指标,如空腹血糖(fasting plasma glucose,FPG)、糖化血红蛋白(glycated hemoglobin A1c,HbA1c)、谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)、碱性磷酸酶(alkaline phosphatase,ALP)、血清尿素氮(blood urea nitrogen,BUN)、肌酐(creatinine,CRE)、尿素氮肌酐比值(the ratio of blood urea nitrogen and creatinine,BUN/CRE)等;2)全身疾病情况;3)糖尿病分型、病程及是否患有其他糖尿病并发症;4)眼部病史,眼科及全身手术史。
1.2.2 眼科常规检查
1)采用国际标准视力表检查最佳矫正视力(best corrected visual acuity,BCVA),统计时均换算为最小分辨角对数视力(logarithmic minimum angle of resolution,logMAR);2)利用蔡司眼底照相机Visucam524行双眼眼底照相,每眼分别以黄斑中央凹及视盘为中心各拍摄两张45°眼底照片,合并图片(图1),并依据2014年我国糖尿病性视网膜病变临床诊疗指南的分期标准,将糖尿病患者分为无DR(T0)、轻度非增殖期(T1)、中重度非增殖期(T2)及增殖期(T3)4组[9]。

图1 合并以黄斑中央凹及视盘为中心各拍摄的两张45°眼底照片Figure 1 Two 45° fundus photographs taken centered on the macular fovea and the optic disc were combined
1.2.3 OCTA 检查
使用蔡司第4 代频域光学相干断层扫描(Cirrus HD-OCT 5000),采用数据扫描模式Macular Cube 521×128测量中心视网膜厚度(central retina lthickness,CRT);采用血管扫描模式Angiography3×3及Angiography6×6分别获得黄斑区OCTA图:其中Angiography3×3为中心凹无血管区(foveal avascular zone,FAZ)周围半径1.5 mm的圆,中心为FAZ周围半径0.5 mm的圆,内层为完整区域去掉中心区域(图2);Angiography6×6为FAZ周围半径3 mm的圆,中心为FAZ周围半径0.5 mm的圆,内层为1.5 mm半径的圆去掉中心区域,外层为完整区域去掉中心及内层区域(图3)。通过内置分析软件自动测量该范围内浅层视网膜各区域的血管线性密度及血管灌注密度。以上所有测量均需保证信号强度≥8。

图2 Angiography3×3浅层视网膜OCT血管成像图Figure 2 Superficial retinal in Angiography3×3
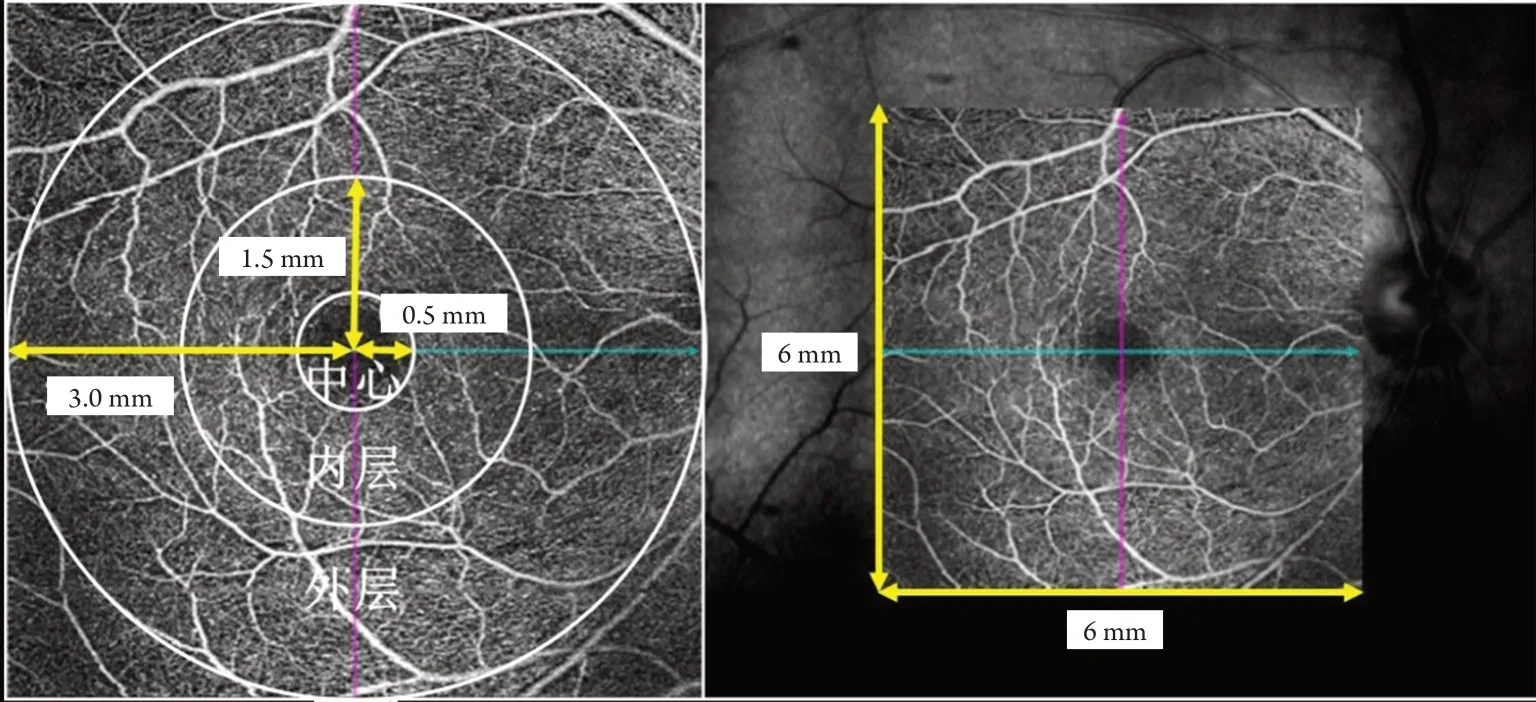
图3 Angiography6×6浅层视网膜OCT血管成像图Figure 3 Superficial retinal in Angiography6×6
1.3 统计学处理
采用SPSS 22.0统计学软件分析数据。计量资料采用均数±标准差()描述。组间一般资料、BC VA及OCTA数据(均取右眼结果纳入统计)比较采用单因素方差分析。所有数据均行方差同质性检验,若假定方差齐性,事后多重比较采用LSD法;若未假定方差齐性,事后多重比较采用Dunnett T3法。P<0.05为差异有统计学意义。
2 结果
2.1 受试者资料
纳入的63例患者中,男40例(63.49%),女23例(36.51%),年龄35~78(50.78±9.95)岁。其中,T0组21眼,T1组21眼,T2组14眼,T3组7眼(图4)。

图4 DR各期典型OCTA图像Figure 4 Typical OCTA images of each stage of DR
2.2 不同程度DR 患者组间单因素方差分析比较
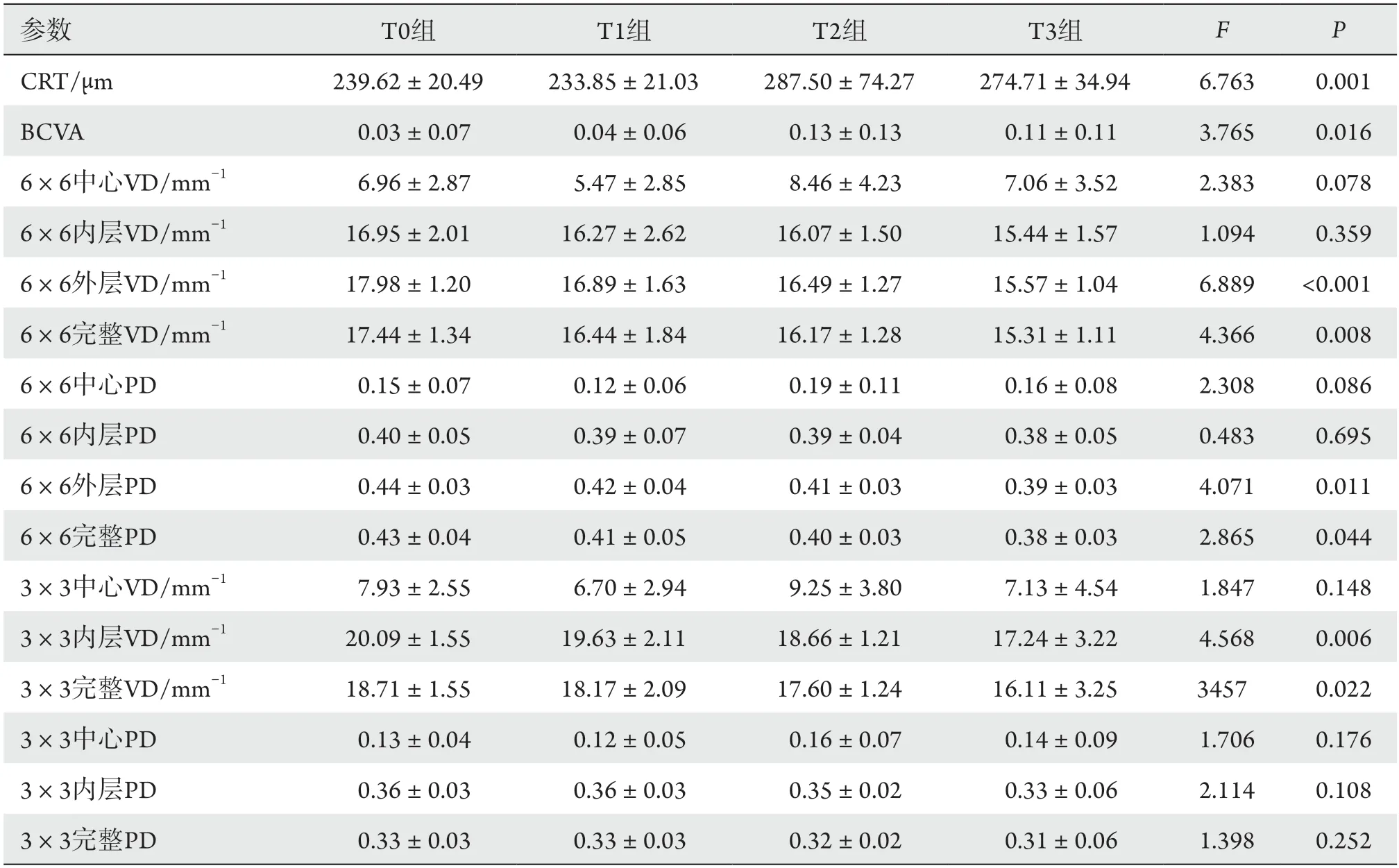
4组病程、BUN、CRE、CRT、BCVA、6×6外层VD、6×6完整VD、6×6外层PD、6×6完整PD、3×3内层VD、3×3完整VD面积的差异均有统计学意义(均P<0.05),余差异均无统计学意义(P>0.05,表1)。
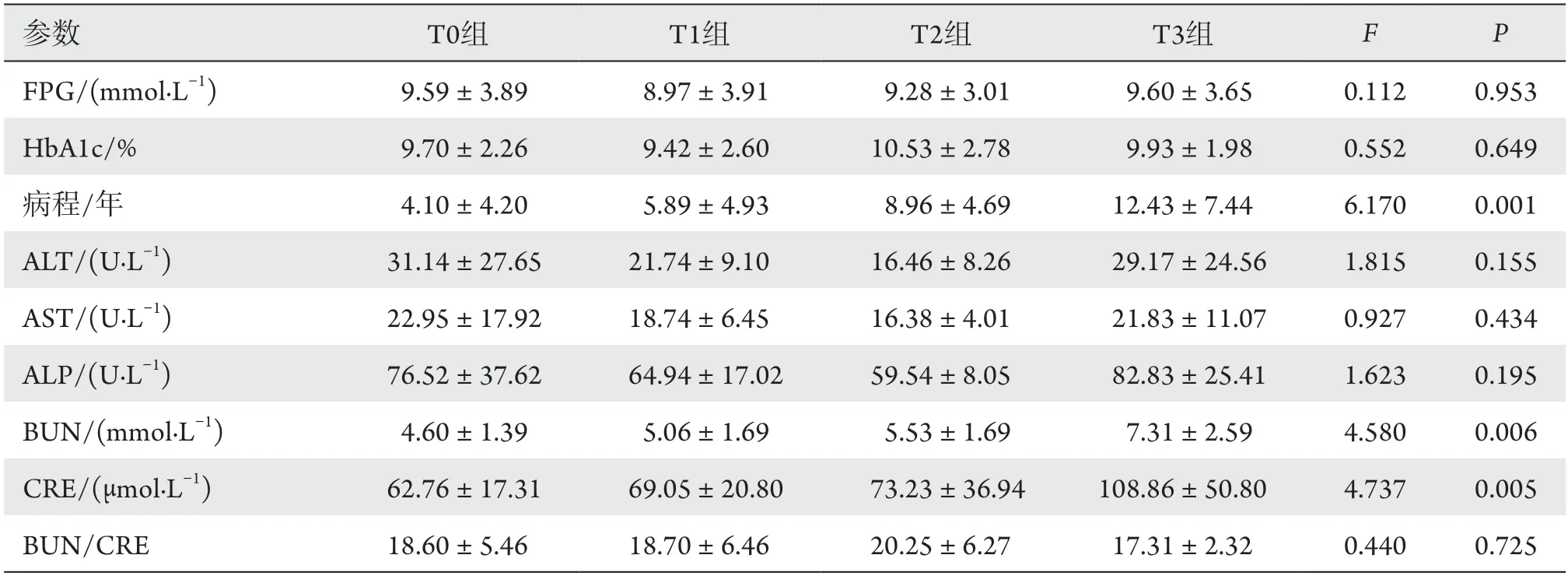
表1 不同程度DR患者组间比较Table 1 Comparison among the 4 groups with different degrees of DR
续表1
随着DR严重程度的增加,患者的糖尿病病程延长,BUN及CRE逐渐升高,CRT逐渐增厚,BCVA逐渐下降,6 mm ×6 mm外层及完整血流线性密度及血流灌注密度均减少,3 mm ×3 mm内层及完整血流线性密度减少。
2.3 不同程度DR 患者单因素方差分析事后多重比较
将4组患者差异有意义的病程、BUN、CRE、CRT、BCVA、6×6外层VD、6×6完整VD、6×6外层PD、6×6完整PD、3×3内层VD、3×3完整VD经方差同质性检验后进行事后多重比较。除CRE(P=0.005)、CRT(P=0.004)及BCVA(P=0.005)方差不齐,事后多重比较采用Dunnett T3法,余均采用LSD法(P<0.05,表2)。
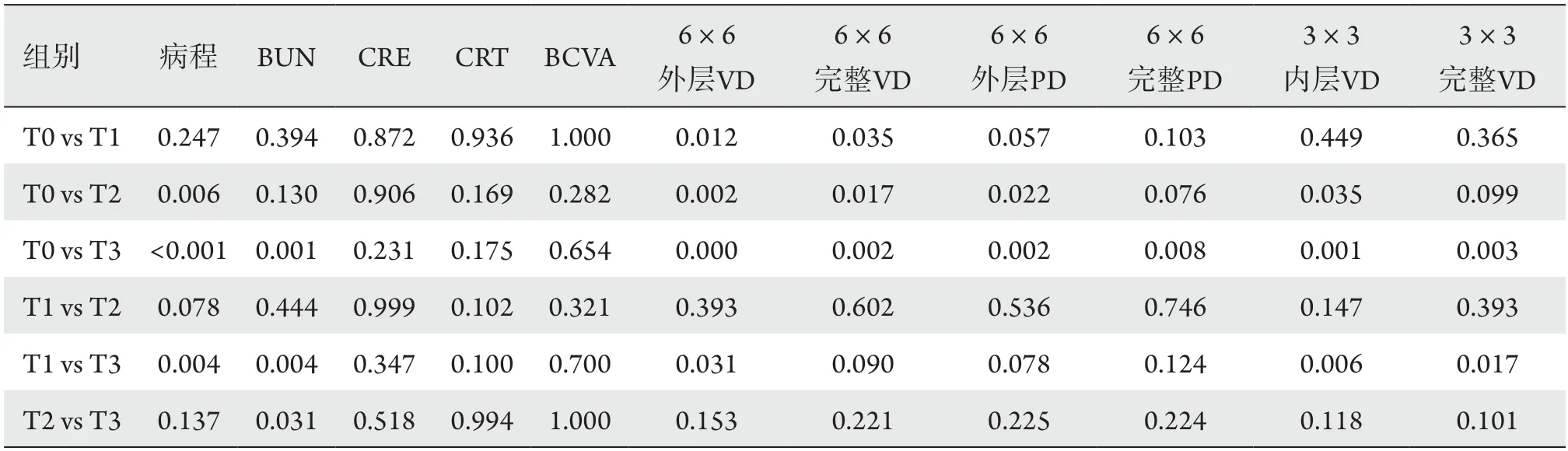
表2 不同程度DR患者单因素方差分析事后多重比较Table 2 One-way ANOVA post-hoc multiple comparisons in patients with different degrees of DR
T2组、T3组与T0组相比,T3组与T1组相比,糖尿病病程延长;T3组与其他各组相比,BUN升高;T1组、T2组、T3组与T0组相比,T3组与T1组相比,6 mm ×6 mm外层血流线性密度减少;T1组、T2组及T3组与T0组相比,6 mm ×6 mm完整血流线性密度减少;T2组、T3组与T0组相比,6 mm ×6 mm外层血流灌注密度减少;T3组与T0组相比,6 mm ×6 mm完整血流灌注密度减少;T2组、T3组与T0组相比,T3组与T1组相比,3 mm ×3 mm内层血流线性密度明显减少;T3组与T0组及T1组相比,3 mm ×3 mm完整血流线性密度减少。
3 讨论
本研究中不同程度DR患者的FPG、HbA1c、ALT、AST、ALP、BUN/CRE等生化指标的组间比较无显著差异。但随着DR严重程度增加,患者的BUN及CR E逐渐升高,且增殖期患者的糖尿病病程及BUN与其他各期相比明显增加。Shi等[10]的一项基于问卷和生化指标的横断面研究也表明更长的病程和较高的BUN可能是影响2型糖尿病患者糖尿病肾病或DR发生的独立危险因素。与健康人群相比,慢性肾脏病早期视网膜旁中心凹的浅层及深层血流密度均下降[11]。Gupta等[12]的荟萃分析发现DR是糖尿病肾病进展的重要预测指标,糖尿病肾病进展的风险随着DR严重程度的增加而增加。因此,DR筛查可能有助于对糖尿病患者的肾脏病变进行预测及风险分层。
本研究中,随着DR进一步发展,视网膜血流线性密度及血流灌注密度逐渐下降,这与既往多项研究[13-17]结果相似。本研究发现6 mm ×6 mm及3 mm ×3 mm的血流线性密度在早期轻度NPDR时就已明显减少。而血流灌注密度仅在6 mm ×6 mm存在明显差异,且仅在中重度NPDR及PDR时期发生明显改变。这是因为OCTA的血流线性密度是将血管骨骼化,把每根血管线条化描绘,以计算区域内线性长度与区域面积的比值。因此血管线性密度不受血管管径变化的影响,能更敏感地发现血管数量的变化。而血管灌注密度则是计算血管管径在区域内覆盖面积与区域面积的比值。Laotaweerungsawat等[18]的一项前瞻性横断面研究也表明随着DR进展,VD与PD均逐渐降低,但是在区分DR分期方面,VD更胜一筹。Alam等[19]将血管曲率、血管管径、血管周长指数、VD、FAZ面积及FAZ轮廓不规则性6个OCTA定量指标用于DR的客观分类及分期,结果表明VD是敏感性最高的指标。因此,血流线性密度对于早期DR筛查可能更为敏感。
本研究发现6 mm ×6 mm的血流线性密度及血流灌注密度均明显减少,而3 mm ×3 mm仅血流线性密度明显减少,血流灌注密度无明显差异。同时,我们注意到6 mm ×6 mm外层血流线性密度及血流灌注密度明显减少,而内层及中心区域的血流线性密度及血流灌注密度无明显差异;3 mm ×3 mm内层血流线性密度明显减少,而中心血流线性密度无明显差异。这与Yang等[20]的一项横断面研究结果相似,他们将健康人群及临床前期DR患者Angiography3×3及Angiography6×6的OCTA血流密度进行对比,发现研究组所有区域(中心区域除外),浅表视网膜血管层的视网膜血流密度均显著低于对照组。Karst等[21]利用OCTA记录了7个标准化的3 mm ×3 mm区域的血流灌注:一个以中央凹为中心,3个在中央凹颞侧,3个在视盘鼻侧。最终发现与靠近中央凹的毛细血管相比,旁中央凹外的毛细血管对于DR毛细血管灌注变化更敏感。因此,对于早期DR视网膜血流变化,选择更大范围的Angiography6×6模式可能更为敏感。
当然本研究也有局限性。由于既往玻璃体腔注射抗新生血管药物对于黄斑血流影响的多项研究[22-25]结果相互矛盾,我们无法确定此类内眼手术或操作对视网膜血流的影响,因此本研究只能将此类患者予以排除。所以虽然各组患者在视网膜血流密度存在显著差异,但不能否认中重度增殖期及增殖期样本量较小。今后的研究将进一步将中重度增殖期及增殖期患者按照玻璃体腔注药术前后及视网膜激光光凝前后进行对比,以确定此类手术或操作对视网膜血流的影响。
综上,随着DR的进展,患者的尿素氮及肌酐逐渐升高,OCTA的血流线性密度及血流灌注密度逐渐减少。与血流灌注密度相比,血流线性密度对于早期DR筛查可能更为敏感。而利用Angiography6×6模式可能比Angiography3×3模式更早地发现DR的视网膜血流变化。
开放获取声明
本文适用于知识共享许可协议(Creative Commons),允许第三方用户按照署名(BY)-非商业性使用(NC)-禁止演绎(ND)(CC BY-NC-ND)的方式共享,即允许第三方对本刊发表的文章进行复制、发行、展览、表演、放映、广播或通过信息网络向公众传播,但在这些过程中必须保留作者署名、仅限于非商业性目的、不得进行演绎创作。详情请访问:https://creativecommons.org/licenses/by-nc-nd/4.0/。

