基于多光谱技术和计算机模拟研究牡荆素抑制α-淀粉酶的分子机制
张国文,吴健妹,倪孟婷
(南昌大学食品科学与技术国家重点实验室,江西 南昌 330047)
α-淀粉酶(α-amylase,别称α-1,4-D-葡聚糖水解酶)能将食用后的淀粉降解成低聚糖和寡糖[1]后,在小肠经α-葡萄糖苷酶水解为葡萄糖,葡萄糖通过体内系统吸收和转运至血液,引起血糖含量升高[2],故而α-淀粉酶也是控制餐后可吸收糖产生的关键酶之一。因此,有效抑制α-淀粉酶的活性,降低淀粉水解为低聚糖的速率,进而影响后续可吸收单糖的生成速率,达到控制餐后血糖水平过高的目的,已成为临床防治糖尿病的主要手段之一[3]。目前,临床使用的α-淀粉酶抑制剂是有与底物有相似环状结构的阿卡波糖[4],它竞争性地阻碍了底物接触α-淀粉酶的结合位点,从而发挥抑制酶活的效果,但阿卡波糖在使用中的安全性仍存在争议。因此,从天然膳食中寻找安全无毒、药效高的α-淀粉酶抑制剂对防治糖尿病有重要的临床意义。
牡荆素(Vitexin)是一种天然膳食黄酮,在山楂、绿豆、金莲花和无花果树[5,6]等多种食物和传统草药中含量丰富,具有抗氧化、抗糖尿病等生物活性,且无明显的急性、亚慢性毒性和遗传毒性[7]。Nurdiana等[6]发现喂食无花果叶和牡荆素给链脲佐菌素诱导的糖尿病大鼠后,糖尿病症状减轻。Yang等[8]报道从毛竹叶中提取的牡荆素可以延缓淀粉的消化。然而,关于牡荆素抑制α-淀粉酶的分子机制知之甚少。因此,本文利用酶促动力学方法测定牡荆素对α-淀粉酶的抑制作用类型和抑制常数,并联合应用多种光谱学手段和计算机模拟技术研究牡荆素与α-淀粉酶相互作用的结合特性、空间结合构象及其诱导酶分子结构的变化对酶催化底物的影响,进而阐明牡荆素抑制α-淀粉酶的分子机制,以期为牡荆素作为降糖食品功能因子研发提供实验依据。
1 实验部分
1.1 仪器与试剂
电子天平(BSA224S型,Sartorius公司,德国);紫外-可见(UV-vis)分光光度计(UV-2450型,岛津公司,日本);荧光分光光度计(F-7000型,日立公司,日本);圆二色(CD)谱仪(MOS-450型,Bio-Logic公司,法国);酸度计(pHS-3C型,雷磁公司,上海);恒温水浴锅(HH-S2S型,江苏扬中)。
牡荆素(纯度≥94.9%,中国药品检定研究所),溶于二甲基亚砜(DMSO)中;α-淀粉酶(57.1 units mg-1,来自猪胰腺,Sigma公司,美国),溶于PBS(0.1 mol·L-1,pH 6.8)中;可溶性淀粉购于西陇化工股份有限公司,取1.0 g可溶性淀粉,加10 mL超纯水搅匀调成糊状后,倒入沸水缓缓稀释至100 mL,随加随搅拌,继续煮沸2 min后,放冷,上层清液即为1%的淀粉储备液;阿卡波糖(纯度≥98%,Aladdin公司,中国);其他实验试剂均为分析纯,所用水均为超纯水。
1.2 实验方法
1.2.1 牡荆素对α-淀粉酶活性的抑制能力测定
参照WU等[9]报道的实验方法:310 K水浴中,先在PBS溶液(0.1 mol·L-1,pH 6.8)中让不等量的牡荆素溶液与α-淀粉酶(6.48×10-6mol·L-1)溶液20 μL孵化10 min使反应完全,再添加底物(1%可溶性淀粉)进行酶催化反应(10 min左右)。反应完全后加入1 m LDNS试剂(还原糖指示剂)并煮沸10 min显色,流水冷却,测定530 nm处牡荆素抑制α-淀粉酶各体系的吸光度值。阿卡波糖用作阳性对照。通过公式(1)计算α-淀粉酶的残余酶活:
α-淀粉酶的残余酶活=(A1-A2)/(A0-A2)×100%
(1)
A0,A1:未加入和加入牡荆素/阿卡波糖下反应体系的吸光度;A2:除未加淀粉溶液外其他试剂相同的体系的吸光度。
1.2.2 牡荆素对α-淀粉酶的抑制动力学测定
抑制可逆性:底物可溶性淀粉的浓度(0.3 mg mL-1)固定不变,在200 s内测定3组不同浓度牡荆素存在下α-淀粉酶的催化反应速率,绘制以酶催化反应速率(v=ΔOD/min)对α-淀粉酶浓度[α-amylase]的变化曲线,依据曲线的特征来判定牡荆素抑制作用的可逆性。
抑制作用的类型:在确定了抑制可逆性后,保持α-淀粉酶的摩尔浓度(1.3×10-7mol·L-1)一致,在200 s内测定三组添加了不同浓度牡荆素时的酶催化反应速率,1/v为Y轴,1/[starch]为X轴,利用米氏方程计算得到抑制常数,以及用Lineweaver-Burk双倒数作图,以此判断牡荆素抑制α-淀粉酶的作用类型。
1.2.3 牡荆素与可溶性淀粉相互作用分析
参照文献方法[10],将不等量的牡荆素/阿卡波糖溶液(0,0.75,1.5,3.0,6.0×10-4mol·L-1)与固定量的可溶性淀粉溶液在310 K下孵化5 min,使其反应彻底,加入的KI-I2指示剂(5×10-3mol·L-1)100 μL结束反应,用UV-vis分光光度计检测牡荆素-淀粉混合液在500~900 nm区间内的光谱。相互作用后可溶性淀粉的光谱通过差谱法获得:ΔA=A1-A2,(A1,A2分别为添加和未加可溶性淀粉的混合体系的吸光值)。
1.2.4 荧光光谱法
控制实验温度(298、301、310 K),测定滴加不同剂量牡荆素后α-淀粉酶的荧光光谱。往α-淀粉酶溶液(2.63×10-6mol·L-1)中,逐次累计滴加5.0×10-3mol·L-1的牡荆素储备液(3 μL·次-1,共10次),保持混匀后反应3 min,设置λEX=280 nm,狭缝宽度均是2.5 nm,测定290~500 nm牡荆素与α-淀粉酶体系的荧光发射光谱。
同步荧光测定:在实验温度298 K下,分别测定λem-λex=15 nm(酪氨酸,Tyr)和60 nm(色氨酸,Trp)的同步荧光光谱,其他荧光滴定条件同上。
为扣除牡荆素的紫外吸收引起的内滤光干扰,用方程(2)处理荧光数据[11]:
(2)
式中FC和FM分别是校正后和测定的荧光数据。A1和A2分别表示牡荆素在λex和λem处的吸光度值。
1.2.5 α-淀粉酶表面疏水性的测定
参照Zeng等[12]的测定方法:室温下将α-淀粉酶(5.26×10-6mol·L-1)和指示剂苯胺基萘-8-磺酸(ANS)(1.0×10-3mol·L-1)混合孵育2 h后,逐次滴加5.0×10-3mol·L-1牡荆素溶液(3 μL/次,共10次)。在λex=380 nm,狭缝宽度均为5 nm下,扫描420~620 nm各反应液的荧光光谱,分析α-淀粉酶的表面疏水性的变化。
1.2.6 CD光谱法
配制不同浓度比的牡荆素和α-淀粉酶混合溶液,在190~250 nm范围内扫描反应液的CD光谱(用PBS缓冲溶液进行基线校准),牡荆素结合前后α-淀粉酶的各二级结构的含量使用在线Dichroweb程序进行分析计算。
1.2.7 分子对接及分子动力学模拟
利用Discovery Studio 2016软件进行牡荆素和α-淀粉酶的对接模拟。分别从蛋白质数据库和PubChem中下载α-淀粉酶晶体结构(PDB ID:1SMD)和牡荆素的3D结构。对接前,先对α-淀粉酶的晶体结构进行除水、添氢和加极性等处理,定义α-淀粉酶为受体,牡荆素为配体。根据牡荆素和α-淀粉酶对接100次后的最低CDOCKER结合能结果,两者结合的最佳对接构象。
在GROMACS 4.5.6软件中对α-淀粉酶和α-淀粉酶-牡荆素复合物进行分子动力学模拟,以得到小分子物质和酶相互作用过程中的各项指标变化。分别给α-淀粉酶和牡荆素分子加上不同的力场。在中和牡荆素和α-淀粉酶分子的表面电荷、最小化能量并平衡NVT和NPT后,运行分子动力学模拟30 ns。
2 结果与讨论
2.1 牡荆素对α-淀粉酶的抑制作用分析
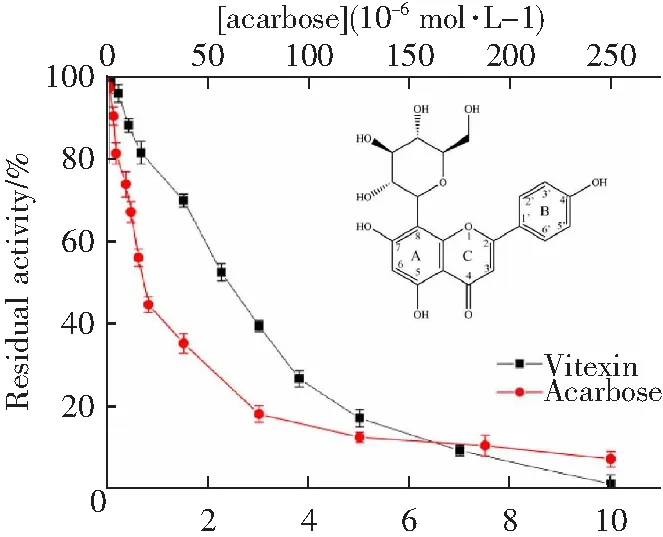
图1A中,牡荆素和阿卡波糖以剂量依赖的方式抑制α-淀粉酶的活性,当剂量分别为1.0×10-2和2.5×10-4mol·L-1时,酶的活力能被抑制完全,但牡荆素(IC50=2.25×10-3mol·L-1)的抑制能力要弱于阿卡波糖(IC50=1.69×10-5mol·L-1)。
图1B是以酶促反应速率(v)对α-淀粉酶的浓度所作的图,不同浓度牡荆素存在下的拟合直线都经过了原点,且斜率与牡荆素浓度呈负相关,表明牡荆素对α-淀粉酶是可逆性抑制[13]。
确定了牡荆素对α-淀粉酶是可逆性抑制后,绘制双倒数曲线来评价牡荆素对α-淀粉酶的抑制类型。图2中的系列拟合直线在Y-轴相交,表明牡荆素是典型的竞争型α-淀粉酶抑制[11]。牡荆素作为竞争型抑制剂的抑制常数由下列公式计算:
(3)
(4)

[vitexin]/(10-3 mol·L-1)

c(α-amylase)=1.3×10-7 mol·L-1;c(vitexin)=0,0.5,2.0×10-3 mol·L-1 for curves a→c图2 牡荆素抑制α-淀粉酶的Lineweaver-Burk曲线Fig.2 Lineweaver-Burk curve of vitexin inhibiting α-amylase
2.2 牡荆素与淀粉的结合作用
经阿卡波糖和牡荆素作用前后的淀粉,与碘液发生显色反应的程度,在590 nm处出现淀粉-I2有色复合物的特征吸收峰(图3),随着药物分子添加量增加,阿卡波糖对淀粉与碘的显色反应影响较小,牡荆素会减弱显色反应程度,表明了牡荆素结合淀粉后,导致部分淀粉丧失了遇碘显色的特性。

λ/nm
2.3 牡荆素与α-淀粉酶的结合性质
2.3.1 α-淀粉酶的荧光猝灭
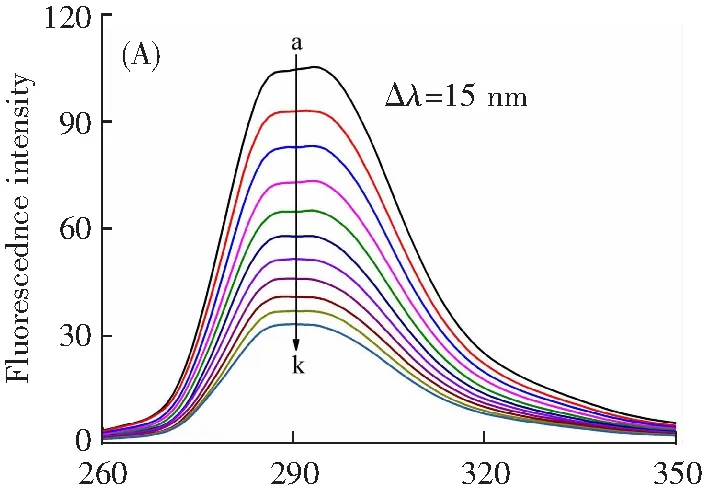
α-淀粉酶在345 nm处有较强荧光,随着牡荆素的加入,其荧光强度不断下降(图4A),表明牡荆素与α-淀粉酶发生了相互作用,影响了酶的荧光基团而改变了酶的荧光特性。
Stern-Volmer方程被用于描述牡荆素对α-淀粉酶的猝灭方式:
(5)
式中F0、F分别为未添加或添加牡荆素时α-淀粉酶的荧光强度,Ksv表示荧光猝灭常数,[Q]是牡荆素的浓度,τ0表示单独荧光团存在下的平均寿命(约10-8s)。
3个温度下F0/F对[Q]有良好的拟合线性(图4A插图),表明牡荆素通过单一方式猝灭α-淀粉酶的荧光[14]。由表1可见,Ksv值与温度呈负相关,即温度越高猝灭程度变弱,且各温度下的双分子猝灭速率常数Kq值的数量级达到1012L·mol-1·s-1,均大于小分子与生物大分子作用时的最大动态猝灭速率常数(2.0×1010L·mol-1·s-1)[14],以上结果表明牡荆素以静态猝灭机制引起了α-淀粉酶的荧光猝灭。
2.3.2 结合常数和结合位点数
确定了静态猝灭方式后,通过公式(6)可以计算牡荆素与α-淀粉酶相互作用时的结合常数Ka和结合位点数n[15]:
(6)
[Qt]和[Pt]分别是牡荆素和α-淀粉酶的浓度。作图得到的结合常数Ka和n的值列于表1中。3个温度下的Ka值分别为3.28×103、3.49×103和3.80×103L·mol-1,n值均接近于1,说明牡荆素与α-淀粉酶只有一个结合位点,结合强度中等,这与上述抑制动力学分析的结果相互佐证。
2.3.3 热力学分析
由牡荆素与α-淀粉酶结合反应的吉布斯自由能(△G°)、熵变(△S°)和焓变(△H°),可以确定两者之间结合的主要作用力,由van’t Hoff方程计算[16]:
(7)
△H°=△H°-T△S°
(8)
R是气体常数(8.314 J·mol-1·K-1)。表1中列出了计算得到的△H°、△S°和△G°值。负的△G°值,表明牡荆素结合α-淀粉酶是自发进行的;正的△H°和△S°值,表明两者相互作用主要由疏水力驱动[16]。

表1 3个温度下牡荆素与α-淀粉酶作用的猝灭常数(Ksv)、结合常数(Ka)、结合位点数(n)及热力学参数Table 1 Quenching constant (Ksv),binding constant(Ka),number of binding sites(n) and thermodynamic parameters of the interaction between vitexin and α-amylase at three temperatures
2.4 牡荆素对α-淀粉酶结构的影响
2.4.1 α-淀粉酶表面疏水性变化
ANS作为特异性荧光探针去指示蛋白质的疏水性表面基团。如图4B所示,ANS与α-淀粉酶的疏水区域结合后荧光强度显著增强,不断增加牡荆素浓度,α-淀粉酶-ANS复合物的荧光强度值不断降低,说明牡荆素作用于α-淀粉酶的疏水空腔,使其表面暴露的疏水基团减少,导致ANS与α-淀粉酶疏水表面的结合受阻,而降低了酶的表面疏水性。

λ/nm λ/nm(A):c(α-amylase)=2.63×10-6 mol·L-1;(B):c(α-amylase)=5.26×10-6 mol·L-1.c(vitexin)=0,0.5,1.0,1.5,2.0,2.5,3.0,3.5,4.0,4.5,5.0×10-5 mol·L-1 for curves a→k,respectively.Curve l is only the spectrum of vitexin(A) or ANS(B).图4 (A)牡荆素存在下α-淀粉酶的荧光光谱及Stern-Volmer图;(B)不同剂量牡荆素对ANS-α-淀粉酶复合物荧光的影响Fig.4 (A) The fluorescence spectrum and Stern-Volmer plot of α-amylase in the presence of vitexin;(B) The effect of different doses of vitexin on the fluorescence of ANS-α-amylase complex
2.4.2 α-淀粉酶的同步荧光光谱分析
同步荧光光谱反映α-淀粉酶中酪氨酸(Tyr)和色氨酸(Trp)残基疏水性和微环境极性的变化。很明显Tyr残基和Trp残基的荧光强度随着牡荆素浓度增加而猝灭(图5A和B),Tyr残基的荧光峰位无明显偏移,而Trp残基的峰位红移了2 nm,表明牡荆素的存在增加了α-淀粉酶的Trp残基微环境的极性,但对Tyr残基基本无影响[17]。计算的同步荧光的猝灭百分比(RSFQ=1-F/F0)(图5C)表明,牡荆素对Trp残基的猝灭百分比(74.55%)高于Tyr残基(68.56%),表明牡荆素猝灭α-淀粉酶荧光过程中,Trp残基的贡献大于Tyr残基。
λ/nm
2.4.3 非辐射能量转移和结合距离
相同条件下通过α-淀粉酶与HSA(已知荧光量子产率为0.13[18])的荧光强度之比,来计算α-淀粉酶的荧光量子产率:
(9)
X表示α-淀粉酶;φ代表物质的荧光量子产率;F为在λex=280 nm的荧光强度;A表示在280 nm处的吸光度值。经计算φx=0.044。根据Förster能量转移理论,计算牡荆素与α-淀粉酶结合过程的能量转移效率E和两分子间的结合距离r:
(10)
(11)
(12)
R0为当E是50%时的临界距离,κ2是各项随机分布的取向因子(κ2=2/3),N为折射指数(N=1.336),φ=φx=0.044;J是α-淀粉酶的荧光光谱和牡荆素的紫外可见光谱之间的重叠部分的积分面积,F(λ)和ε(λ)分别是在波长λ处的α-淀粉酶的荧光强度和牡荆素的摩尔吸光系数。
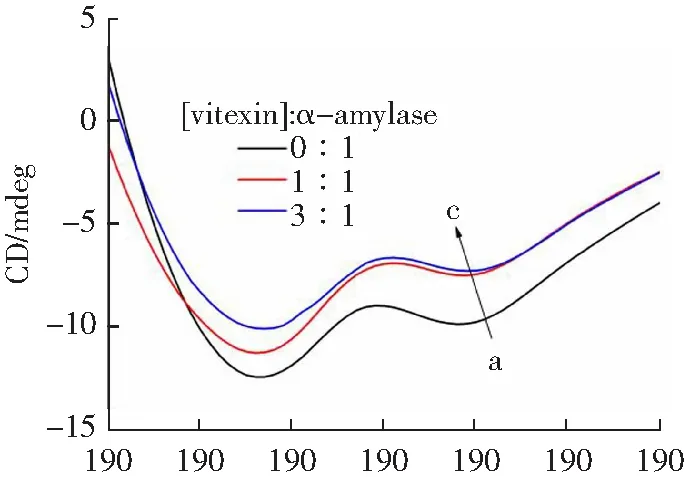
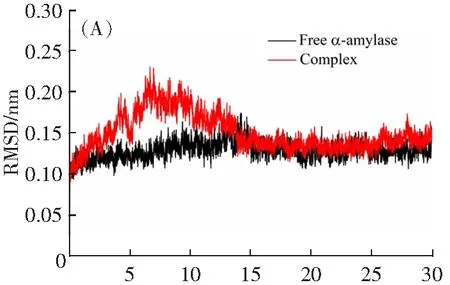
根据相同浓度下牡荆素和α-淀粉酶的紫外可见吸收光谱与荧光光谱曲线(图6),利用MGLTOOLS-1.5.6软件计算得到两曲线重叠面积为2.01×10-14cm3L mol-1。由公式(9)-(12)计算出R0=2.33 nm,r=3.28 nm。r<8 nm且0.5R0 λ/nm图6 牡荆素的紫外-可见吸收光谱与α-淀粉酶的荧光光谱的重叠曲线Fig.6 Overlapping curve of the UV-Vis absorption spectrum of vitexin and the fluorescence spectrum of α-amylase 2.4.4 圆二色谱分析 α-淀粉酶分子二级结构的不对称使其表现出圆二色性,在CD光谱远紫外区出现较强信号。如图7所示,α-淀粉酶的CD光谱中出现了α-螺旋的两个特征峰(209和230 nm处负峰)[20]。随着[牡荆素]:[α-淀粉酶]浓度比增加,两个负峰强度减弱,说明牡荆素的加入一定程度上降低了酶的α-螺旋含量。在线分析CD光谱数据,得到α-淀粉酶各二级结构的含量列于表2中。当[牡荆素]:[α-淀粉酶]由0:1变化到1:1和3:1时,α-螺旋的含量分别降低了6.19%和9.26%,β-折叠增加了0.97%和1.46%,β-转角增多了2.30%和5.22%。这可能是由于牡荆素破坏了α-淀粉酶蛋白骨架中螺旋结构间的氢键网络,从而导致了酶α-螺旋含量减少,使酶结构变得松散[17]。 λ/nmc(α-amylase)=2.5×10-5 mol·L-1,the molar ratios of vitexin to α-amylase were 0:1,1:1,3:1,for curves a→c,respectively.图7 牡荆素对α-淀粉酶的CD光谱的影响Fig.7 The effect of vitexin on the CD spectrum of α-amylase 表2 牡荆素对α-淀粉酶的二级结构的影响Table 2 The effect of vitexin on the secondary structure of α-amylase 2.5.1 分子对接 牡荆素与α-淀粉酶的主要结合构象可通过分子对接直观反映。如图8A所示,牡荆素结合到含两个Ca2+的酶活性中心,与结合区域的Glu233、Asp197、His299、Asp300、His305、Ile235及Gly306氨基酸残基通过疏水作用力和氢键作用(图8B),其中牡荆素的A环和C环分别与His305形成一个C-H键和酰胺-π堆积,B环与Ile235有π-烷基键,糖苷环上的-OH与Glu233、Asp197、His299间形成了4个C-H键和3个氢键(键长分别为:2.16,2.17,2.73 Å),一个氢键存在于牡荆素A环上的C7-OH与Asp300之间,键长为2.77 Å,牡荆素与Glu233间的氢键键长最短,作用力最强。与酶相互作用后,牡荆素自身的构象也发生了扭曲(图8C),这可能是牡荆素受到酶的诱导契合,通过改变自身构象以便于进入α-淀粉酶的活性空腔[21]。对接结果表明,牡荆素结合在α-淀粉酶的活性空腔中,与底物竞争结合位点,阻碍了底物被酶催化,进而降低α-淀粉酶的活性。 图8 (A)牡荆素与α-淀粉酶的最佳结合构象;(B)牡荆素与α-淀粉酶结合的2D图;(C)牡荆素对接前后的构象变化Fig.8 (A) Optimal binding conformation of vitexin and α-amylase;(B) 2D image of vitexin binding to α-amylase;(C) conformational change of vitexin before and after docking 2.5.2 分子动力学模拟 分子动力学模拟直观展示了α-淀粉酶及牡荆素-α-淀粉酶复合物结构的动态变化。α-淀粉酶-牡荆素复合物的稳定性可用均方根偏差(RMSD)来评估,RMSD值变化越大,蛋白质骨架的振幅越大,越不稳定[22]。如图9A,在复合物体系中,最初15 ns内RMSD值有较大的波动,说明牡荆素与α-淀粉酶在此期间发生相互作用形成稳定复合物。整体上牡荆素-α-淀粉酶复合物体系的RMSD值比α-淀粉酶的稍大,表明形成复合物后降低了α-淀粉酶的稳定性。均方根波动(RMSF)体现了α-淀粉酶各氨基酸残基在结合过程中的灵活性,RMSF值大小与各残基的灵活性成正相关[23]。与牡荆素形成复合物后,RMSF值减小(尤其在肽段350-355降低明显)(图9B),说明牡荆素与位点氨基酸结合后限制了部分氨基酸残基的骨架原子运动。回旋半径(Rg)反映蛋白质结构的紧凑性[24],如图9C所示,α-淀粉酶-牡荆素复合物的Rg值先升高后下降,在Rg最大值附近,复合物的Rg值稍大于α-淀粉酶,表明牡荆素的存在诱导α-淀粉酶结构伸展,与CD分析结果吻合。溶剂可及表面积(SASA)代表体系接触溶剂的表面积,能够能体蛋白质表面疏水性变化[24]。从图9D可以看出,在0~13 ns,复合物的SASA值明显大于单独α-淀粉酶,并呈现先升高后降低的趋势,表明与牡荆素结合形成复合物后α-淀粉酶的表面疏水性降低,与前面ANS荧光实验结果一致。并且通过对比Tyr和Trp残基在模拟前后的SASA值,进一步验证Tyr和Trp残基微环境疏水性的变化及其对荧光猝灭的贡献(图9E和F)。形成复合物后,其Tyr和Trp残基的SASA值分别降低和增加,表明牡荆素的存在增加了α-淀粉酶Tyr残基的疏水性和Trp残基的极性,且主要受影响的是Trp残基,从而更多贡献α-淀粉酶荧光猝灭,该结果同步荧光实验结果一致。 t/ns 研究表明牡荆素是一种竞争性α-淀粉酶抑制剂,其IC50值为2.25×10-3mol·L-1。除了能抑制淀粉酶活性之外,牡荆素还能与淀粉结合形成复合物而降低淀粉的消化。牡荆素通过的疏水作用力与α-淀粉酶在一个位点结合,这种结合诱导α-淀粉酶的α-螺旋结构含量及表面疏水性降低,使得酶的结构变得松散。牡荆素结合于α-淀粉酶含两个Ca2+的酶活性中心,与其中的部分氨基酸残基相互作用,且Trp残基比Tyr残基对两者结合的贡献更大。推测牡荆素抑制α-淀粉酶的分子机制是:牡荆素结合在酶的活性空腔,占据了活性位点,改变了α-淀粉酶的分子构象,阻碍了底物的进入,进而降低了α-淀粉酶的活性。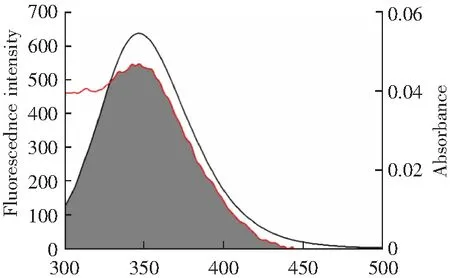

2.5 牡荆素与α-淀粉酶的结合模式

3 结论

