术后残留低分化甲状腺癌的预后相关因素分析
董 方,薛金才,王 军,高力英,王 娟
甲状腺癌占全身恶性肿瘤的1.2%~2.3%[1],目前已成为中国女性恶性肿瘤第3 位,是头颈部最常见的恶性肿瘤以及最常见的内分泌恶性肿瘤[2]。低分化甲状腺癌(poorly differentiated thyroid carcinoma,PDTC)一词是由SAKAMOTO 等[3]和CARCANGIU 等[4]于20 世纪80 年代首次报道和定义的,其另一个常用名为“岛状癌”。PDTC 是滤泡细胞起源的侵袭性恶性肿瘤,其特点为部分丧失甲状腺分化,形态学和生物学行为介于分化型甲状腺癌(well differentiated thyroid cancer,WDTC)与未分化型甲状腺癌(anaplastic thyroid cancer,ATC)之间[5]。世界各地报道的PDTC 流行病学的差异较大,其中日本报道的PDTC 发病率小于1%[6],北美地区为2%~3%,意大利北部地区为15%[7]。导致世界各地PDTC 发病率差异的原因可能包括PDTC 诊断标准的差异或是病因的差异[8]。本研究回顾性分析甘肃省肿瘤医院收治的43 例术后残留PDTC 患者的临床资料,评估预后相关因素,以期建立科学的个体化诊疗体系,为PDTC 患者制定最佳治疗方案。
1 资料与方法
1.1 研究对象纳入标准
研究对象为1998 年1 月—2016 年1 月在甘肃省肿瘤医院接受诊治的术后残留PDTC 患者,均接受过规范性甲状腺癌手术以及术后放疗,病理诊断明确。PDTC 病理诊断标准:(1)实性/小梁状/岛状结构;(2)缺乏乳头状癌的核特征;(3)具有下列特点之一:卷曲的核、肿瘤坏死、每一个高倍镜视野下可见≥3 个核分裂象[9]。临床分期标准:参照美国癌症联合委员会甲状腺癌分期(第8 版)。
1.2 方 法
1.2.1 研究方法
收集并记录术后残留PDTC 患者的人口统计学及临床特征,包括性别、年龄、初诊时的中性粒细胞/ 淋巴细胞比值(neutrophils to lymphocytes ratio,NLR)(<4vs≥4)、肿瘤局部侵犯(食管、气管、大血管)、淋巴结转移情况(N1avsN1b)、外照射放疗剂量(<66 Gyvs≥66 Gy)等,分析与5 年总生存率相关的预后因素。
1.2.2 随访
随访采用电话、手机短信、门诊随访、住院观察或病历资料复习等方法进行。随访日期截至2021 年1 月或患者的死亡日期。
1.2.3 统计学方法
应用SPSS 17.0 软件进行统计学分析。Kaplan-Meier 法计算5 年总生存率,并绘制生存曲线。先采用COX回归模型进行预后的单因素分析,生存率的比较采用log-rank 法;再将单因素分析中有统计学意义的变量引入COX比例风险模型进行多因素分析。P<0.05 为差异有统计学意义。
2 结果
2.1 临床资料
初始入组50 例术后残留PDTC 患者,其中7 例失访,最终入组43 例。43 例术后残留PDTC 患者中,男性19 例、女性24 例;中位年龄为63.88 岁(范围:56~76 岁);分期均为T4a~4bN1a~1bM0期,其中T4a26 例、T4b17 例、N1a15 例、N1b28 例;Ⅲ期26 例,Ⅳa期17 例。
2.2 生存结果
随访5 年,43 例术后残留PDTC 患者的平均生存期为(2.82±0.25)年(95% 置信区间:2.34~3.30)。3 年总生存率为39.53%,5 年总生存率为25.58%,生存曲线见图1。
2.3 预后的单因素分析结果
单因素分析结果(表1)显示,肿瘤局部侵犯、NLR 和术后外照射放疗剂量与5 年总生存率显著相关(P<0.05),而性别、年龄和淋巴结转移情况与5 年总生存率无显著相关性(P>0.05)。
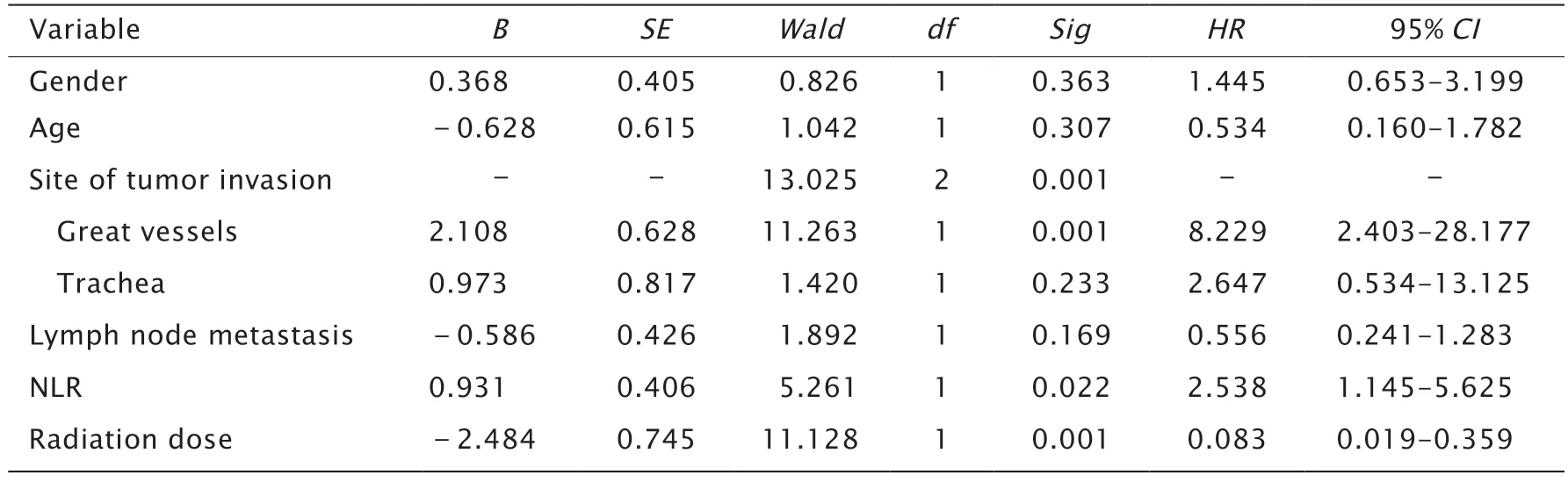
表1 43 例术后残留PDTC 患者预后的单因素分析Table 1 Univariate analysis of prognosis in 43 patients with postoperative residual poorly differentiated thyroid carcinoma (PDTC)
2.4 预后的多因素分析结果
将单因素分析中有统计学意义的变量纳入COX比例风险模型进行多因素分析,结果显示肿瘤侵犯大血管、NLR 和术后外照射放疗剂量是5年总生存率的独立预后因素(P<0.05,表2)。
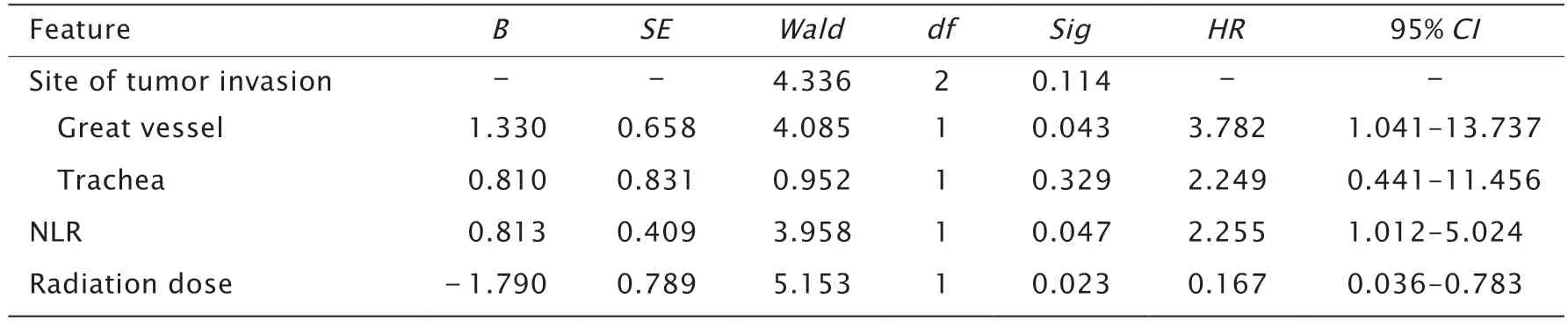
表2 43 例术后残留PDTC 患者预后的多因素分析Table 2 Multivariate analysis of prognosis in 43 patients with postoperative residual poorly differentiated thyroid carcinoma (PDTC)
2.5 独立的预后因素与5 年总生存率之间的关系
2.5.1 肿瘤局部侵犯与5 年总生存率之间的关系
肿瘤侵犯食管与肿瘤侵犯气管的术后残留PDTC 患者的5 年总生存率较为接近,而侵犯大血管患者的5 年生存率明显下降(图2)。
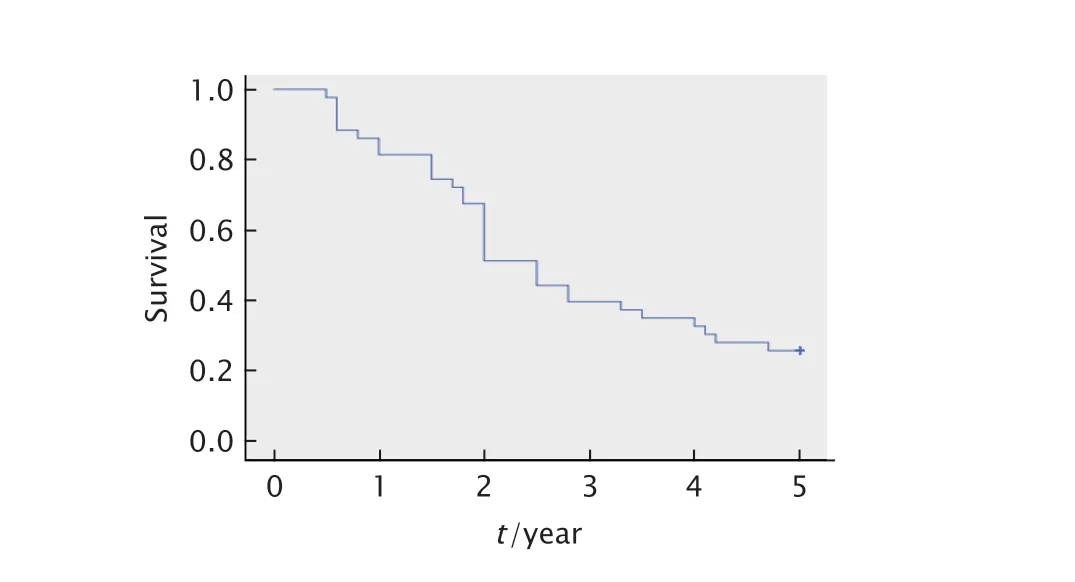
Fig.1 Survival curve of 43 patients with postoperative residual poorly differentiated thyroid carcinoma(PDTC).图1 43 例术后残留PDTC 患者的生存曲线
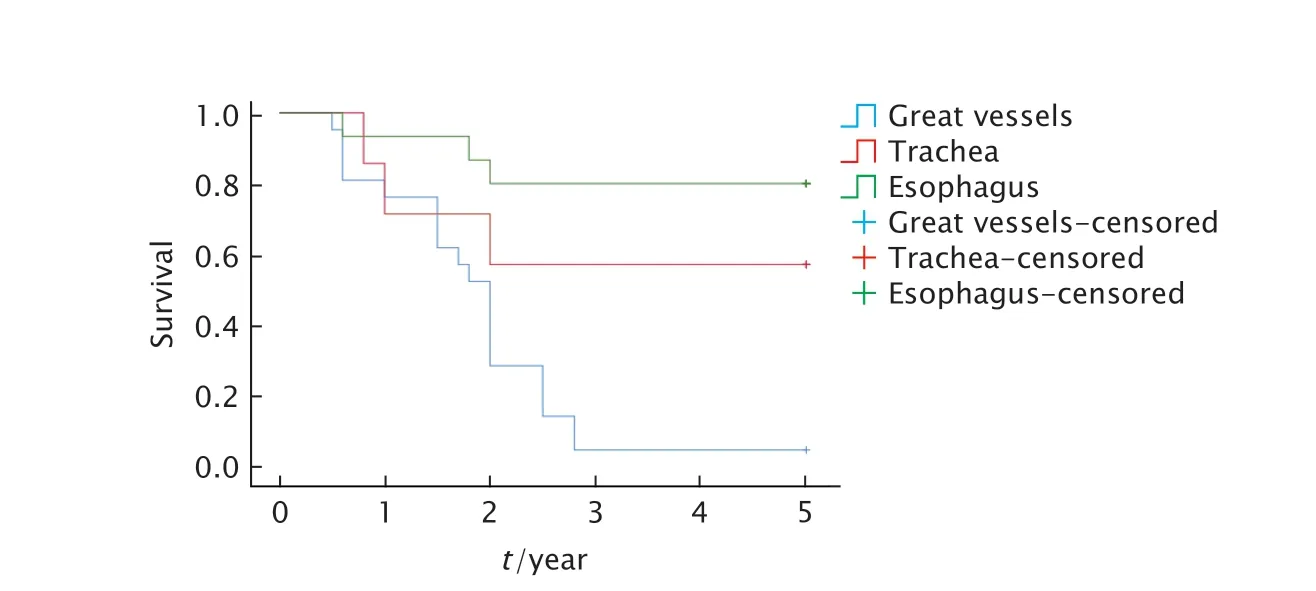
Fig.2 Relationship between local tumor invasion and 5-year overall survival in patients with postoperative residual poorly differentiated thyroid carcinoma (PDTC)图2 术后残留PDTC 患者的肿瘤局部侵犯与5 年总生存率之间的关系
2.5.2 初诊时NLR 与5 年总生存率之间的关系
初诊时NLR 与5 年总生存率呈负相关,初诊时NLR <4 的患者5 年生存率高于初诊时NLR ≥4 的患者(图3)。
2.5.3 术后外照射放疗剂量与5 年总生存率之间的关系
与术后外照射放疗剂量≥66 Gy 相比,术后外照射放疗剂量<66 Gy的患者5年生存率极低(图4)。

Fig.3 Relationship between neutrophils to lymphocytes ratio (NLR) at initial diagnosis and 5-year overall survival in patients with postoperative residual poorly differentiated thyroid carcinoma (PDTC)图3 术后残留PDTC 患者初诊时NLR 与5 年总生存率之间的关系

Fig.4 Relationship between postoperative external radiation dose (RT) and 5-year overall survival in patients with postoperative residual poorly differentiated thyroid carcinoma (PDTC)图4 术后残留PDTC 患者术后外照射放疗剂量与5 年总生存率之间的关系
3 讨论
近年来,甲状腺癌的发病率逐年升高。许多研究已证实存在PDTC,但是直至2006 年才由来自欧洲、日本和美国等的12 位甲状腺病理学家组成的工作组于意大利都灵提出统一的PDTC 诊断标准[9],并且最终确认下来。该诊断标准主要基于组织细胞学特征,同时考虑了肿瘤的生长方式和肿瘤细胞学特点[9]。在病因学方面,PDTC的发病原因至今未明,部分病例的肿瘤似乎来源于原已存在的乳头状癌或滤泡状癌,但其余病例的肿瘤却来源不明[10]。
本研究回顾性分析了43 例术后残留PDTC患者,其3 年总生存率为39.53%,5 年总生存率为25.58%。肿瘤侵犯大血管、NLR 和术后外照射放疗剂量是术后残留PDTC 患者5 年总生存率的独立影响因素。
国外学者对PDTC 开展了许多研究。DE LA FOUCHARDIÈRE 等[11]对104 例PDTC 患 者进行分析,发现PDTC 的异质性很强,具有病期晚、易发生远处转移以及放射性碘治疗抵抗等特点,40%的患者存在甲状腺外侵犯(extrathyroidal extension,ETE);仅37%的患者在最初治疗结束时达到疾病缓解,50%的患者对放射性碘治疗的反应较差,3 年总生存率为72.8%,3 年无复发生存率为45.3%;初始治疗后缓解是无复发生存率的独立影响因素;多因素分析显示,ETE是影响总生存的唯一重要的因素。这项研究报道的3 年总生存率高于本研究报道的3 年总生存率(72.8%vs39.53%),推测原因可能与本研究纳入的均为术后残留PDTC 患者有关。本研究还发现,大血管区域肿瘤残留患者的预后显著不如食管或气管区域肿瘤残留的患者,这可能与肿瘤侵犯大血管后难以彻底切除有关。
ARORA 等[12]对708 例PDTC 患者开展了一项流行病学调查,结果显示中位年龄为61.5岁,男女病例数比为1.9 ∶1;外照射放疗与预防肿瘤局部复发密切相关,但未能改善总生存。本研究中,43 例术后残留PDTC 患者的中位年龄为63.88 岁,与ARORA 等[12]的结果接近;但是本研究中的男女病例数之比为1 ∶1.26,与ARORA 等[12]的结果不一致,推测可能与人种差异以及样本量不同有关;本研究还提示,足量的外照射放疗剂量与预后呈正相关,能够改善5 年总生存率。
IBRAHIMPASIC 等[13]分析了91 例原发性PDTC 患者,中位随访时间为50 个月,3 年总生存率和疾病特异生存率分别为62%和66%,其中23 例患者死于远处转移;单因素分析结果显示,年龄小于45 岁、肿瘤直径大于4 cm、ETE、pT分期较高、切缘阳性和远处转移均为预后的不良因素;多因素分析结果显示,pT4a和M1是疾病特异生存率较低的独立影响因素。YU 等[14]调查了菲律宾10 年内的761 例甲状腺恶性肿瘤患者,其中仅18 例符合PDTC 的都灵诊断标准;中位年龄为62 岁,女性占72%;大部分患者为Ⅳ期,其中8 例合并ETE,5 例合并淋巴结转移和远处转移;3 年总生存率为83%,有3 例(16.7%)患者在确诊12 个月内死亡。本研究的随访时间为5年,并且由于存在肿瘤术后残留,因此与国外研究的结果相比,总生存率偏低。
国内学者关于PDTC 的临床报道较少。杨雅洁等[15]分析了3 例PDTC 患者的发病情况;邵灿灿等[16]对1 例PDTC 肺转移死亡患者进行了个案分析及文献复习;陈志达等[17]对1 例甲状腺低分化癌合并乳头状癌患者进行了个案报道。国内有关PDTC 的报道内容主要集中于病理诊断特点以及诊疗进展方面[18-23]。
在PDTC 放疗方面,薛芬等[24]认为对于局部晚期和复发性PDTC,以调强放疗为基础的综合治疗能够控制局部区域病灶,延长生存时间,不良反应可控,是一种有效且安全的治疗手段。本回顾性研究的结果提示,外照射放疗在PDTC患者的治疗中具有重要地位,早期足量的外照射放疗可以改善患者的生存。
NLR 是反映中性粒细胞与淋巴细胞之间动态平衡的一项炎症指标,可以综合反映人体的免疫状态。有研究报道,宫颈癌患者治疗前的NLR是重要的预后指标,高NLR 预示预后不良[25]。国内外多位学者的研究均显示,NLR 可以作为预后判定指标以评估非小细胞肺癌患者的预后,治疗前高NLR 预示预后差[26-29]。目前,国内外的临床研究均尚未涉及NLR 与PDTC 患者预后的相关性,这可能与PDTC 总的发病率较低有关。本研究首次报道NLR 在PDTC 患者中的预后预测作用,有可能为临床上选择合适的治疗方式以及制定个体化的治疗方案提供帮助,指导临床实践。然而,鉴于PDTC 的发病率较低以及病例数有限,因此可能存在一定的统计偏倚,有待今后扩大样本量以进一步研究总结。
随着分子诊断技术的进步以及超深测序技术的进一步发展,人们对PDTC 的临床病理和分子特征又有了新的认识。IBRAHIMPASIC 等[30]发现,PDTC 患者预后的高危因素为年龄>45 岁、T4a期、ETE、高有丝分裂率、肿瘤坏死和远处转移。BRAFV600E或RAS突变(分别占27%和24%)是PDTC 相互排斥的主要驱动因素。TERT启动子突变是PDTC 中最常见的突变(40%)。EIF1AX(11%)和TP53(16%)突变也在PDTC 中出现。在低生存率的PDTC 患者中,MED12 和RBM10突变的发生率较高(分别为15% 和12%)。在PDTC 患者中还发现22q 染色体缺失,并且与RAS突变密切相关。这些分子特征有助于缩小研究范围,帮助研发新的靶向药物,以期改善PDTC 患者的预后。然而,XU 等[31]认为,某些分子标志物如TERT启动子突变、EIF1AX突变以及突变负荷等被认为是较有前途的预后预测因素,其独立预测PDTC 患者预后的价值尚未获得证实。
由于PDTC 发病率较低,因此本研究中PDTC 患者诊疗时间的跨度较大。对于早期患者来说,由于当时的基因检测尚未普及,因此无法进行基因测序。相信在不久的将来,会发现更多的PDTC 预后相关因素,从而指导临床医师制定更加优化的治疗策略。

