国家种质广州甘薯圃病毒种类鉴定及分析
陈新亮 房伯平 王章英 姚祝芳 杨义伶 黄立飞

摘要
為明确引起国家种质广州甘薯资源圃中病毒病的病毒种类及优势种,为甘薯种质安全保存提供支持,2017年从甘薯资源圃中未脱毒更新的盆栽苗和大田苗中采集155份具有不同病毒病症状的甘薯资源样品,利用PCR和RTPCR检测技术对这些样品进行了17种病毒的分子检测。155份样品均有病毒检出,包括甘薯羽状斑驳病毒Sweet potato feathery mottle virus(SPFMV)、甘薯褪绿矮化病毒Sweet potato chlorotic stunt virus(SPCSV)、黄瓜花叶病毒Cucumber mosaic virus(CMV)、甘薯褪绿斑病毒Sweet potato chlorotic fleck virus(SPCFV)、甘薯类花椰菜花叶病毒Sweet potato caulimolike virus(SPCV)、甘薯潜隐病毒Sweet potato latent virus(SPLV)、甘薯脉花叶病毒Sweet potato vein mosaic virus (SPVMV)、甘薯病毒2 Sweet potato virus 2(SPV2)和甘薯曲叶病毒Sweet potato leaf curl virus(SPLCV)等9种病毒。检出率最高的是SPCFV,为98.1%,最低的是SPCV,为0.6%;RNA病毒检出率为99.4%,DNA病毒检出率为94.2%。154份样品为病毒复合侵染,占总样品数的99.4%;其中4~6种病毒复合侵染率最高,为70.7%,有4份样品最多检测出8种病毒(2.6%)。 在所有复合侵染类型中,同时含有SPFMV和SPCSV两种病毒的复合侵染率占54.2%。研究结果表明,甘薯种质资源经过多年茎蔓和种薯繁育,病毒感染率高,病毒种类多,以复合侵染为主,在生长环境相同的条件下,不同资源品种对病毒的耐受情况存在明显差异。
关键词
甘薯;种质资源;病毒病;复合侵染
中图分类号:
S435.311
文献标识码:A
DOI:10.16688/j.zwbh.2020557
Identification and analysis of viruses in the national germplasm nursery for sweet potato(Guangzhou)
CHEN Xinliang,FANG Boping,WANG Zhangying,YAO Zhufang,YANG Yiling,HUANG Lifei*
(Crop Research Institute, Guangdong Academy of Agricultural Sciences, Guangdong
Key Laboratory of Crops Genetics Improvement, Guangzhou510640, China)
Abstract
In order to investigate the virus and dominant virus species causing sweet potato virus disease in the national sweet potato germplasm Guangzhou resource nursery, provide support for the safe preservation of resources, a total of 155 samples with viral symptoms were collected from potted seedlings and field seedlings in nursery in 2017. Molecular detection of viruses in the samples were carried out by PCR or RTPCR using primers for seventeen viruses. The results showed that nine virus species were detected, including Sweet potato feathery mottle virus (SPFMV), Sweet potato chlorotic stunt virus (SPCSV), Cucumber mosaic virus (CMV), Sweet potato chlorotic fleck virus (SPCFV), Sweet potato caulimolike virus (SPCV), Sweet potato latent virus (SPLV), Sweet potato vein mosaic virus (SPVMV), Sweet potato virus 2 (SPV2) and Sweet potato leaf curl virus (SPLCV). Among which, SPCFV had the highest detection rate of 98.1%, and SPCV had the lowest detection rate of 0.6%. The detection rate of RNA viruses was 99.4%, and that of DNA viruses was 94.2%. One hundred and fiftyfour samples (99.4%) were found to be infected by two or above viruses. Specifically, coinfection by 4 6 kinds of viruses were major type, accounting for 70.7%. A total of eight viruses were detected in four samples (2.6%). Combined infection contained SPFMV and SPCSV was the most common, accounting for 54.2%. In short, some germplasm resources of sweet potato have been infected by different viruses with high infection rates and mixed infection was dominant. The tolerance of different resources to the virus is obviously different under the same growth environment.
Key words
sweet potato;germplasm resources;virus disease;coinfection
甘薯Ipomoea batatas (L.) Lam.是世界上重要的粮食作物以及食品加工和工业原料[1]。甘薯种质资源是进行甘薯生产和育种工作的基础,也是生物学研究的重要材料。我国于1952年-1958年和1979年-1982 年分别进行了全国性甘薯种质资源的普查收集工作。在此基础上,分别于1990年和1996年建立了“国家种质广州甘薯圃”和“国家种质徐州甘薯试管苗库”,负责全国甘薯品种资源的收集保存、整理与分发利用等工作[2]。至今广州甘薯圃保存各类种质资源2 500多份,其中国家编目的甘薯种质资源1 380份。近年来生产上甘薯病毒病害的发生日趋严重,新收集到的种质资源也不时发现感染了病毒,资源圃中部分资源表现出明显的病毒病症状,而危害甘薯种质资源的病毒种类和主要病毒类型并不明确,对甘薯种质资源的安全保存构成了严重威胁。
目前,全世界已报道的危害甘薯的DNA和RNA病毒有38种,分别属于9个科,包括雀麦花叶病毒科Bromoviridae(1种)、布尼亚病毒科Bunyaviridae(1种)、花椰菜花叶病毒科Caulimoviridae(3种)、长线形病毒科Closteroviridae(1种)、伴生豇豆花叶病毒科Secoviridae(1种)、线性病毒科Flexiviridae(1种)、双生病毒科Geminiviridae(15种)、黄症病毒科Luteoviridae(1种)和马铃薯Y病毒科Potyviridae(9种)[3 4]。中国报道的侵染甘薯常见病毒种类包括甘薯褪绿矮化病毒Sweet potato chlorotic stunt virus(SPCSV)、甘薯羽状斑驳病毒Sweet potato feathery mottle virus(SPFMV)、甘薯曲叶病毒Sweet potato leaf curl virus(SPLCV)、甘薯G病毒Sweet potato virus G(SPVG)、甘薯潜隐病毒Sweet potato latent virus(SPLV)、 甘薯类花椰菜花叶病毒Sweet potato caulimolike virus(SPCV)、 甘薯褪绿斑病毒Sweet potato chlorotic spot virus(SPCFV)、甘薯脉花叶病毒Sweet potato vein mosaic virus(SPVMV)和黄瓜花叶病毒Cucumber mosaic virus(CMV)等[1,5]。甘薯作為无性繁殖作物,主要靠茎枝栽插种植,一旦感染病毒,病毒就会在甘薯体内不断增殖、积累、代代相传,然后经过粉虱、蚜虫等昆虫或汁液传播,复合侵染率较高。甘薯病毒的检测方法主要有生物学、血清学和分子生物学检测技术等,生物学方法是根据样品或指示植物表型特征初步判定样品是否感染病毒。血清学检测技术主要为酶联免疫吸附,能准确判断病毒的种类[6 7]。分子生物学检测技术包括PCR、RTPCR、qPCR、核酸序列测定、RCARFLP以及siRNA 深度测序等,其中PCR或RTPCR技术是检测植物病毒的常用方法,具有特异性强、灵敏性高的特点[8 9]。
本研究在对资源品种病毒病症状调查的基础上,利用PCR及多重RTPCR检测技术对甘薯种质资源中出现典型病毒症状的样品进行分子检测,明确发病甘薯资源品种携带病毒的具体种类和发生频率,为甘薯种质资源的安全保存及生产上病毒病防控提供理论依据,为后期研究抗(耐)病毒品种奠定基础。
1材料与方法
1.1材料
供试样品:2017年9月自广州甘薯资源圃的盆栽和大田苗采集呈现斑点、花叶、黄化、畸形和矮化等疑似病毒病症状的甘薯样品155份,其中温室大棚盆栽类样品100份,大田种植类样品55份。
试剂和仪器:Plant RNA Kit、HP Plant DNA Kit,美国Omega BioTek公司;EasyScript OneStep gDNA Removal and cDNA Synthesis SuperMix试剂盒,全式金生物技术有限公司;2×Taq Master Mix (With Dye),美国APExBIO Technology LLC公司;引物由生工生物工程(上海)股份有限公司合成。Biometra TAdvanced PCR仪,德国TAdvanced basiseinheit(耶拿)公司;DYY6C型电泳仪,北京六一生物科技有限公司;Tanon 4100型凝胶成像系统,上海天能科技有限公司。
1.2方法
1.2.1病毒病害的症状观察
于2017年9月对国家种质广州甘薯资源圃保存的资源品种进行病毒病症状观察,选取具有病毒病症状的植株叶片。其中温室疑似病毒样品为2016年10月-11月从大田取苗种植在温室中的盆栽苗,大田疑似病毒样品为2016年资源收获薯块繁育苗并于2017年7月种植于大田。所采集样品及时置于冰盒中,尽快经液氮速冻后置于 80℃冰箱中保存,用于分子生物学鉴定。
1.2.2病毒样品的分子鉴定
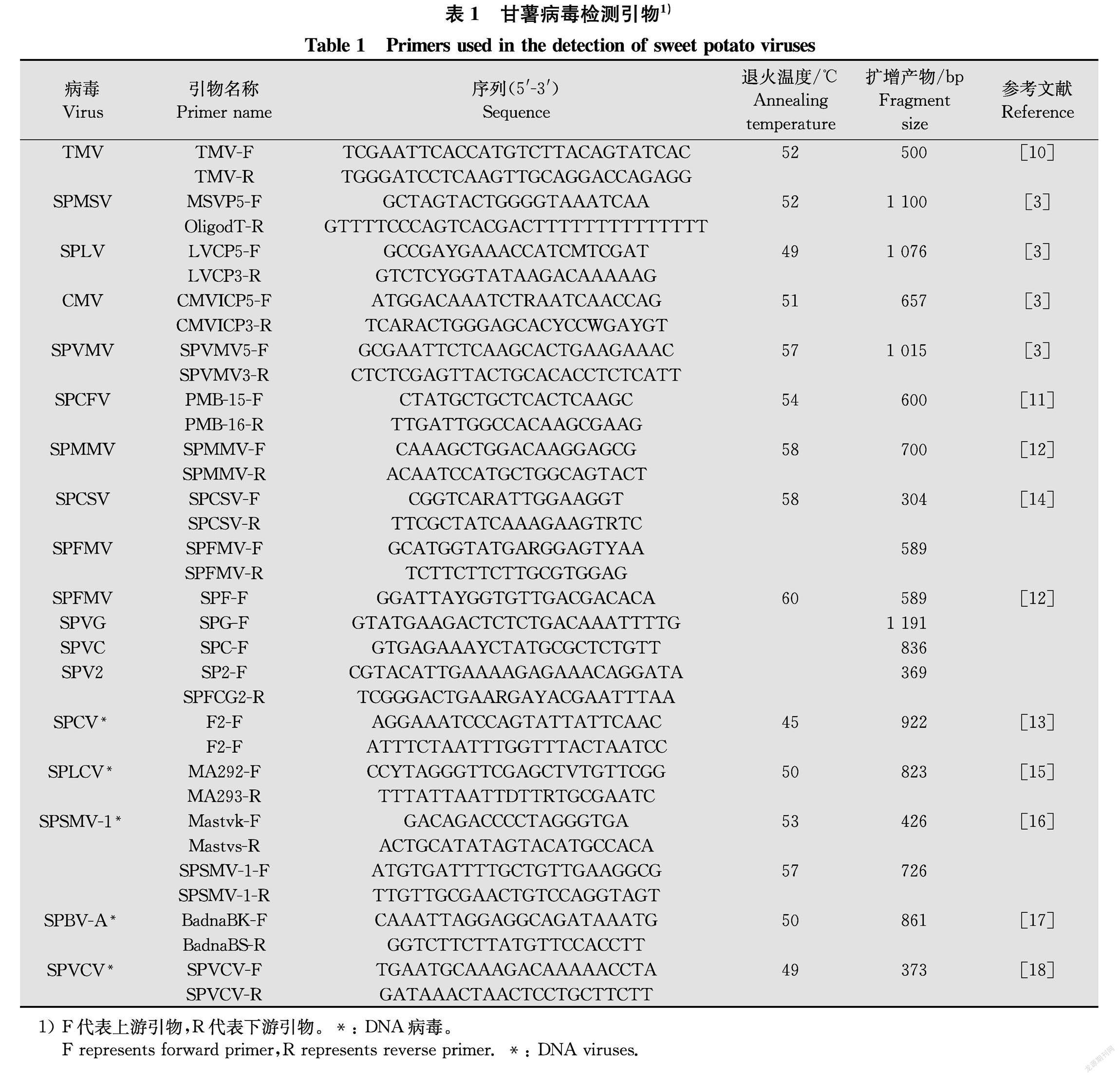
分别取约100 mg混匀后的样品提取总RNA和DNA。RNA病毒检测:先通过反转录试剂盒合成cDNA。反转录体系为20 μL。取RNA模板约1 μg,65℃变性5 min,取出冰浴2 min,再加入Anchored Oligo(dT)18 Primer (0.5 μg/μL) 1 μL, Easy Script RT/RI Enzyme Mix 1 μL, 2×ES Reaction Mix 10 μL,RNaseFree H2O补足至20 μL,42℃恒温15 min,85℃恒温5 s。通过RNA病毒特异引物(引物序列见表1)进行RTPCR扩增,RTPCR反应体系(25 μL): 合成的cDNA 2 μL,2×Taq Master Mix (With Dye) 12.5 μL,上、下游引物(10 μmol/L) 各1 μL,ddH2O 8.5 μL。扩增条件:94℃ 2 min; 94 ℃ 30 s,退火45 s (温度见表1, 多重PCR检测参照相关方法),68℃ 1 min,30次循环;68℃ 10 min。DNA病毒检测:采用DNA病毒特异引物(引物序列见表1)进行PCR扩增检测,反应体系(25 μL):样品总DNA(约100 ng/μL) 2 μL,2×Taq Master Mix (With Dye) 12.5 μL,上、下游引物(10 μmol/L)各1 μL,8.5 μL ddH2O。扩增条件:94℃ 2 min;94℃ 30 s,退火45 s(退火温度见表1),68℃ 1 min,30次循环;68℃ 10 min。所有检测均包含以水为模板的阴性对照。取5 μL扩增产物经1%琼脂糖凝胶电泳检测,凝胶成像仪观察拍照。
1.3数据分析
采用Excel 2016和DPS 7.05统计软件进行数据统计与处理。
2结果与分析
2.1病株的症状类型
根据甘薯病毒病害的发病部位和症状特征可以分为以下6种主要类型。1)叶片斑点型:叶片周围出现紫褐色,形成紫斑、紫环斑、黄色斑或者枯斑。多数品种沿叶脉形成典型的紫色羽状斑(图1a)。2)曲叶型: 一般多是叶片边缘上卷,严重者可形成杯状(图1b)。3)花叶型:叶脉出现不规则黄绿相间的花叶斑纹,严重时叶片大部分呈黄绿色,中间杂有绿色斑块(图1c)。4)叶片黄化型:包括叶片黄化及网状黄脉,发病植株展开的心叶出现网纹状黄化现象(图1d)。5)叶片皱缩型:叶面凹凸不平且粗糙,叶缘不整齐,皱缩缺刻较多,呈蕨叶状或扭曲状(图1e)。6)矮化丛枝型:全株畸形矮化,缩节丛生,叶片明显细小(图1f)。症状调查结果表明,不同甘薯品种的感病植株表现出不同的症状特点,同一品种的不同感病植株感病症状基本相似但也存在差异。
2.2病毒的种类和检出率
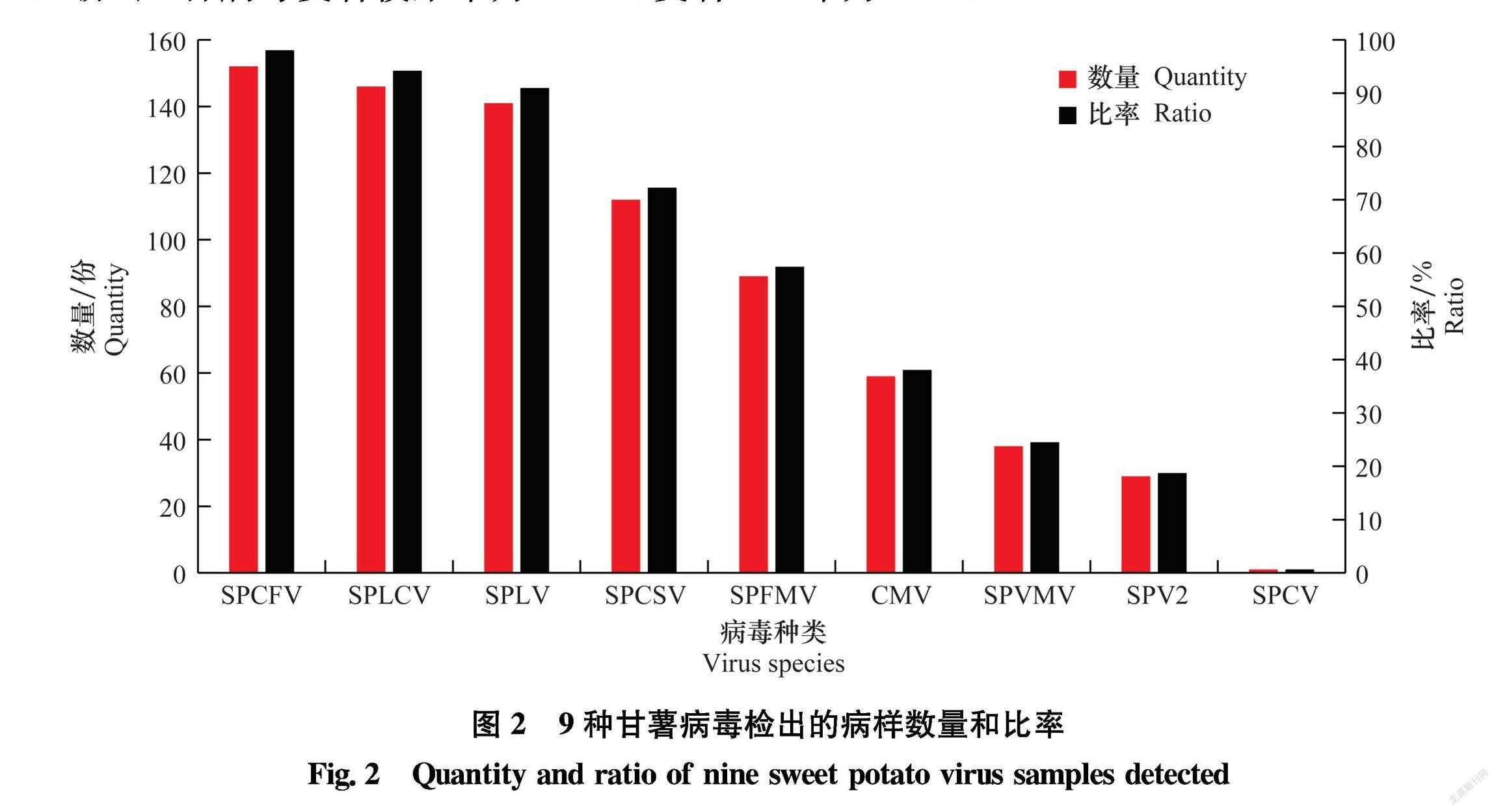
155份样品共检测到9种病毒,包括雀麦花叶病毒科1种(CMV),双生病毒科1种(SPLCV),花椰菜花叶病毒科1种(SPCV),线性病毒科1种(SPCFV),长线形病毒科1种(SPCSV),马铃薯Y病毒科4种(SPFMV、SPLV、SPV2、SPVMV),未检测到SPVG、SPVC、SPMMV、SPMSV、TMV、SPBVA、SPSMV1和SPVCV。其中SPCFV检出率最高,为98.1%,SPLCV检出率为94.2%, SPLV检出率为91.0%,SPCSV检出率为72.3%,SPFMV检出率为57.4%,CMV检出率为38.1%,SPVMV检出率为24.5%,SPV2检出率为18.7%, SPCV检出率为0.6%(图2)。SPCFV、SPLV、SPCSV、SPFMV、CMV和SPV2等RNA病毒检出率为99.4%,SPLCV和SPCV等DNA病毒检出率为94.2%,SPCFV、SPLCV和SPLV等3种病毒检出率均在90%以上,为甘薯资源病毒病的优势种类。
2.3病毒的复合侵染
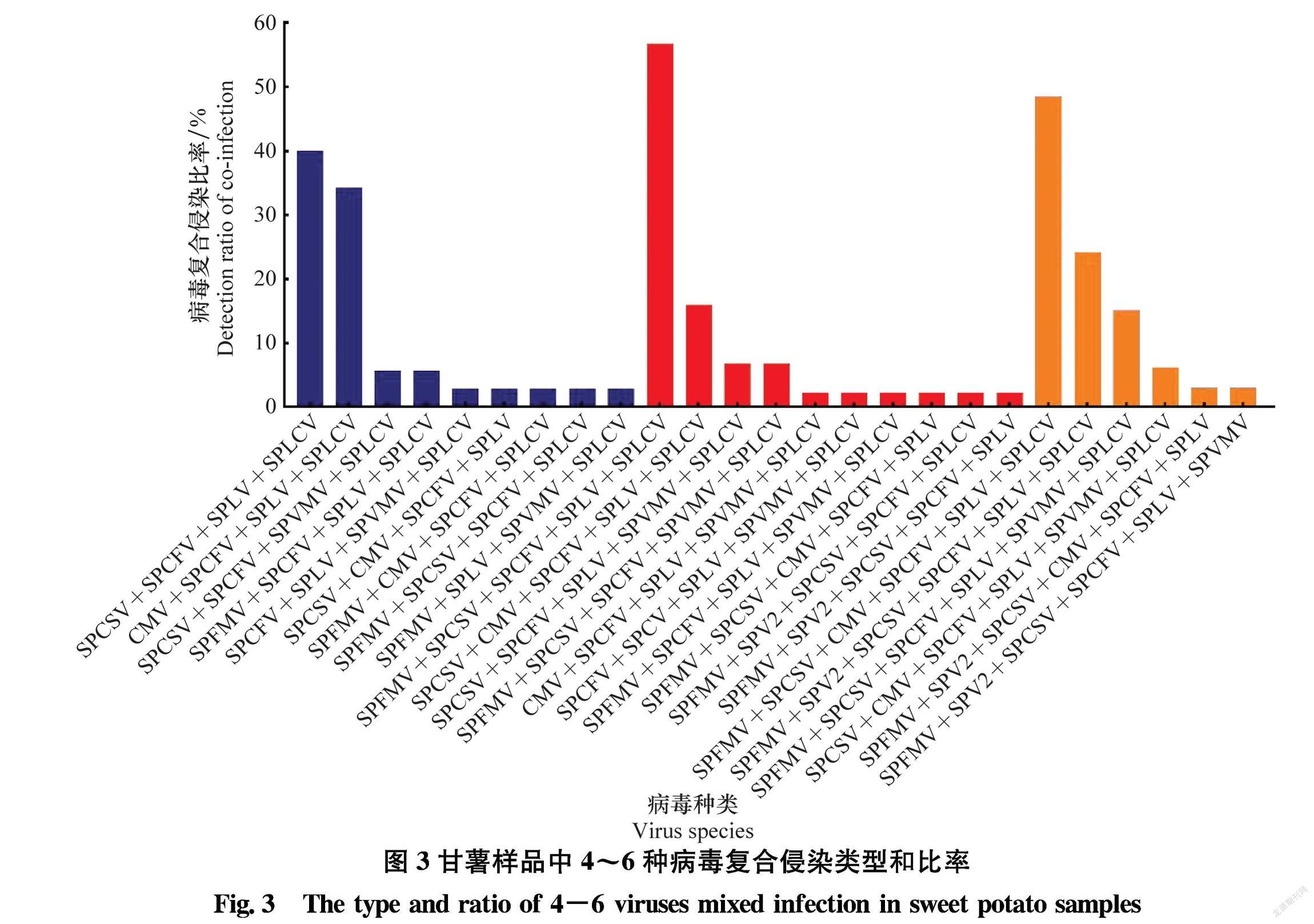
155份样品中,有154份样品为2种及以上病毒复合侵染,复合侵染率为99.4%,其中2种病毒复合侵染率为2.6%,复合类型有3种,SPCFV和SPLCV复合侵染比率最高(2份);3种病毒复合侵染率为12.3%,复合类型有4种,SPCFV、SPLV和SPLCV復合侵染率最高(14份);4种病毒复合侵染率为22.7%,复合类型有9种,SPCSV、SPCFV、SPLV和SPLCV复合侵染率最高(14份),其次为CMV、SPCFV、SPLV 和SPLCV复合侵染(12份);5种病毒复合侵染率最高,占26.6%,复合类型有10种,SPFMV、SPCSV、SPCFV、SPLV和SPLCV复合侵染率最高(25份);6种病毒复合侵染率为21.4%,复合类型有6种,SPFMV、SPCSV、CMV、SPCFV、SPLV和SPLCV复合侵染率最高(16份)(图3)。7种病毒复合侵染率为11.7%,复合类型有3种,分别是SPFMV、SPV2、SPCSV、SPCFV、SPLV、SPVMV和SPLCV(7份),SPFMV、SPV2、SPCSV、CMV、SPCFV、SPLV和SPLCV(6份),SPFMV、SPCSV、CMV、SPCFV、SPLV、SPVMV和SPLCV(5份);8种病毒复合侵染率为2.6%,复合类型为 SPCFV、SPLCV、SPLV、SPCSV、SPFMV、SPVMV、SPV2和CMV,有4份样品检测出;4~6种病毒复合侵染率最高为70.7%;多种病毒的复合侵染中包括对甘薯生产危害最严重的甘薯羽状斑驳病毒(SPFMV)和甘薯褪绿矮化病毒(SPCSV) 的比率为54.2%。
3结论与讨论
症状观察是判断样品是否感染病毒最直观的方法,例如甘薯羽状斑驳病毒(SPFMV)感染后老叶片上多出现脉明、叶脉上出现紫色羽状纹,褪绿斑点等症状。然而病毒往往复合侵染甘薯,而某些甘薯品
种本身又具有耐病性,因此仅通过症状诊断确定病毒种类是不够确切的[5]。本研究在取样前对受病毒危害严重的种质资源品种进行了表型症状特征调查,受病毒危害的甘薯主要表现为叶片上出现褪绿斑、形成黄斑、紫斑、紫环斑,叶片卷曲,叶片边缘呈紫色,植株矮化等明显的病毒病特征。分子检测结果显示甘薯褪绿斑病毒(SPCFV)和甘薯曲叶病毒(SPLCV)检出率最高,均在90%以上,与表型症状调查结果相吻合。SPCFV单独侵染甘薯时症状轻微,但该病毒与甘薯褪绿矮化病毒 (SPCSV) 共同侵染时可导致甘薯产生严重的症状[19]。SPCFV在云南、广西、山东和福建等地的检出率较低或未检测到[20 22],可能还未大范围传播。广东地区甘薯曲叶病毒由汤亚飞等于2013年首次报道,该病毒危害症状明显,主要引起叶片卷曲,严重时卷曲呈杯状,由烟粉虱Bemisia tabaci以持久方式传播[23]。甘薯潜隐病毒(SPLV)的检出率也高达91%,该病毒侵染甘薯一般不产生明显的叶部症状,有的仅产生轻度斑驳,可随薯块和薯苗进行传播[24]。另外,甘薯褪绿矮化病毒(SPCSV)在本研究中检出率为72.3%。SPCSV的相关报道比较多,是危害甘薯的重要病毒,通常与其他病毒协同侵染,危害症状明显。本次检测中还发现了黄瓜花叶病毒(CMV),检出率为38.1%,该病毒株系繁多,寄主广泛,是豆类、草本观赏植物、蔬菜及果树上发生最广、危害最大的病毒,该病毒通过机械摩擦和蚜虫非持久方式传播,引起植株严重矮化、褪绿和黄化[25 26],重庆、广西和福建等地均有该病毒危害甘薯的相关报道。
甘薯为无性繁殖作物,容易感染病毒并造成病毒的积累,病毒传播方式主要有种薯和薯块带毒、蚜虫持久性和非持久性传播、粉虱非持久性传播及机械摩擦传播,多种传播方式导致甘薯可以被多种病毒复合侵染。本研究中,除1份样品仅被甘薯曲叶病毒(SPLCV)危害外,其余154份资源样品均被2种及以上的病毒复合侵染,且4~6种病毒复合侵染率达70.7%。云南、山东等地的甘薯生产田中病毒检测结果显示,复合侵染中多以2~3种病毒为主,这说明甘薯资源经过连续多年茎枝栽插种植后,相比大田种植的甘薯累积了更多种类的病毒。此外,复合侵染中有4份样品检测到8种病毒,分别为SPCFV、SPLCV、SPLV、SPCSV、SPFMV、SPVMV、CMV和SPV2,这在以前的报道中很少见。黄利利等在广西南宁的病毒样品检测中也曾检测到8种病毒复合侵染,所不同的是本次检测未发现甘薯G病毒(SPVG),而广西样品中检测到SPVG,未检测到SPV2[20]。这两种病毒均属于马铃薯Y病毒科,在国内外不同地区均有报道,能够依靠机械、蚜虫和粉虱传播。
目前,为了保障国家甘薯种质资源的安全,已经通过茎尖分生组织培养的方法对国家种质广州甘薯圃保存的大部分资源品种进行了脱毒更新和试管苗保存。后期,将加强对入圃品种的病毒检测,并按品种对病毒的抗(耐)情况进行分类管理。本研究明确了甘薯种质资源中病毒的种类和发生频率,完善了甘薯多病毒检测技术,为病毒病防控、资源保存和脱毒种苗生产提供了技术支撑。
参考文献
[1]马居奎, 张成玲, 杨冬静, 等. 我国甘薯病毒病研究进展[J]. 河北农业科学, 2020, 24(1): 51 56.
[2]房伯平, 张雄坚, 陈景益, 等. 我国甘薯种质资源研究的历史与现状[J]. 广东农业科学, 2004 (S1): 3 5.
[3]乔奇, 张振臣, 张德胜, 等.中国甘薯病毒种类的血清学和分子检测[J].植物病理学报, 2012, 42(1): 10 16.
[4]CLARK C A, DAVIS J A, ABAD J, et al. Sweetpotato viruses: 15 years of progress on understanding and managing complex diseases [J]. Plant Disease, 2012, 96(2): 168 185.
[5]张新新, 王旭芳, 林坚淳, 等. 甘薯毁灭性病毒病害(SPVD)的研究进展[J]. 中国农学通报, 2019, 35(1): 118 126.
[6]马丽, 张春庆, 周玉亮. 甘薯病毒病检测技术研究进展[J]. 中国农学通报, 2005, 21(2): 88 91.
[7]宋吉轩, 陈超, 李云,等. 甘薯病毒病脱毒及检测[J]. 河北农业科学, 2009, 13(9): 29 30.
[8]张盼, 兰新芝, 乔奇, 等. 甘薯病毒病害(SPVD)的多重RTPCR检测方法及其应用[J]. 植物保护, 2013,39(2): 86 90.
[9]卢会翔, 吕长文, 吴正丹, 等. 甘薯羽状斑驳病毒(SPFMV)和甘薯褪绿矮化病毒(SPCSV)荧光定量RTPCR检测方法的建立[J]. 中国农业科学, 2016, 49(1): 90 102.
[10] HINRICHS J, BERGER S, SHAW J G. Induction of antibodies to plant viral proteins by DNAbased immunization [J]. Journal of Virological Methods, 1997, 66 (2): 195 202.
[11] JONES R A C, DWYER G I. Detection of Sweet potato chlorotic fleck virus and Sweet potato feathery mottle virus—strain O in Australia [J]. Australasian Plant Pathology, 2007, 36(6): 591 594.
[12] 包改丽, 左瑞娟, 饶维力, 等. 云南甘薯病毒的检测及主要病毒的多样性分析[J]. 微生物学通报, 2013, 40(2): 236 248.
[13] SOUZA J D, CUELLAR W J. Sequence analysis of the replicase gene of ‘sweet potato caulimolike virus’ suggests that this virus is a distinct member of the genus Cavemovirus [J].Archives of Virology, 2011, 156(3): 535 537.
[14] 许泳清, 李华伟, 邱思鑫, 等. 甘薯羽状斑驳病毒和褪绿矮化病毒双重RTPCR检测方法的建立[J]. 福建农业学报, 2014, 29(11): 1114 1117.
[15] LOZANO G, TRENADO H P, VALVERDE R A,et al. Novel begomovirus species of recombinant nature in sweet potato (Ipomoea batatas) and Ipomoea indica: taxonomic and phylogenetic implications [J]. Journal of General Virology, 2009, 90(10): 2550 2562.
[16] MBANZIBWA D, TAIRO F, CATHERINE G, et al. First report of Sweet potato symptomless virus 1 and Sweet potato virus A in sweetpotatoes in Tanzania [J]. Plant Disease, 2011, 95(2): 224 224.
[17] QIN Yanhong, LI Xuecheng, ZHANG Zhenchen, et al. First report of Sweet potato badnavirus A in China [J]. Plant Disease, 2016, 100(4): 865 865.
[18] CUELLAR W J, SOUZA J D,BARRANTES I, et al. Distinct cavemoviruses interact synergistically with Sweet potato chlorotic stunt virus (genus Crinivirus) in cultivated sweet potato [J]. Journal of General Virology, 2011, 92(5):1233 1243.
[19] 喬奇, 秦艳红, 张德胜, 等. 甘薯褪绿斑病毒外壳蛋白的分子变异及其特异抗血清制备[J]. 植物病理学报, 2014, 44(6): 634 640.
[20] 黄利利, BINHDAN P, 何芳练, 等. 广西甘薯病毒病的病原病毒种类检测[J]. 基因组学与应用生物学, 2016, 35(5): 1213 1218.
[21] 姜珊珊, 谢礼, 吴斌, 等. 山东甘薯主要病毒的鉴定及多样性分析[J]. 植物保护学报, 2017, 44(1): 93 102.
[22] 李华伟, 刘中华, 张鸿, 等. 福建甘薯病毒病病原鉴定及主要病毒多样性[J]. 微生物学通报, 2019, 46(12):3267 3277.
[23] 汤亚飞, 何自福, 韩利芳, 等. 侵染广东甘薯的甘薯曲叶病毒分子检测与鉴定[J]. 植物保护, 2013, 39(4): 25 28.
[24] 黄玉娜, 张振臣. 甘薯潜隐病毒外壳蛋白基因的克隆、表达及其抗血清的制备[J]. 植物病理学报, 2007, 37(3): 255 259.
[25] PALUKAITIS P, GARCAARENAL F. Cucumoviruses [J]. Advances in Virus Research, 2003, 62: 241 323.
[26] 邱艳红, 王超楠, 朱水芳. 黄瓜花叶病毒致病性研究进展[J]. 生物技术通报, 2017, 33(9): 10 16.
收稿日期:2020 10 22修订日期:2021 01 07
基金项目:
国家农作物种质资源保护与利用项目(NWB014);国家现代农业(甘薯)产业技术体系建设专项(CARS10B5,CARS10C17);广东省现代农业产业技术体系甘薯马铃薯创新团队(2019KJ111)
* 通信作者
Email:huanglifei@gdaas.cn

