鸢尾素通过上调线粒体解偶联蛋白2表达保护脓毒症相关急性肾损伤
郭 诚 叶方雄 杨雪雁 李 威 万雨涵 杨定平
肾脏是脓毒症中最脆弱的器官之一,由脓毒症引起的急性肾损伤预后较差[1-2]。然而,脓毒症相关急性肾损伤(SA-AKI)的病理生理机制尚不清楚,目前尚无有效的治疗策略。最近研究表明,线粒体功能障碍在SA-AKI发病中起重要作用[3-6]。
线粒体是氧化磷酸化产生高能三磷酸腺苷(ATP)的主要场所,也是活性氧(ROS)产生的部位。此外,线粒体还参与调节膜电位、调控细胞凋亡、调节细胞代谢和增殖、调节钙信号、参与细胞信号转导等生物学过程。肾线粒体功能障碍发生在脓毒症早期,与ROS产生有直接关系[7]。
解偶联蛋白(UCP)是线粒体内膜蛋白,其主要功能是将线粒体的ATP合成与电子传递解偶联,与消散质子梯度有关[8-10]。哺乳动物中有5种UCP,即UCP1~5,其中UCP2广泛表达于各种细胞类型,包括肾小管细胞[11]。UCP2在控制线粒体产生ROS方面起着关键作用[12-13],对氧化应激诱导的细胞损伤具有保护作用。此外,UCP2还参与控制其他生理和病理过程,包括神经退化、葡萄糖代谢、脂肪酸氧化能力对饥饿的适应、炎症反应和自噬。最近研究表明[14-15],通过上调UCP2的表达可减少ROS生成,减轻肾小管上皮细胞的凋亡[16],对SA-AKI有保护作用。
鸢尾素是由纤维连接蛋白Ⅲ型含结构域蛋白5(FNCD5)释放的一种免疫调节性脂肪肌肉因子,参与线粒体的生物合成和氧化代谢。大量研究证实FNCD5过表达或补充鸢尾素可以保护线粒体功能,减轻氧化损伤和细胞凋亡[14-15,17-19]。然而,鸢尾素对SA-AKI的保护作用仍不清楚。本研究采用脂多糖(LPS)腹腔注射诱导的小鼠SA-AKI模型来验证这一假说。
材料与方法
对象和分组6~8周龄雄性C57BL/6小鼠,安置在12 h的光/暗周期中。所有动物实验均在武汉大学人民医院动物实验中心完成,并经武汉大学人民医院动物实验伦理委员会批准(批准文号:IACUC Issue No.20211103)。
为探讨鸢尾素在SA-AKI中的作用,将小鼠随机分为对照组、LPS组和实验组(LPS+鸢尾素组)。实验组在腹腔注射LPS 10 mg/kg,前14 d连续腹腔注射重组鸢尾素100 μg/kg(Novoprotein,中国深圳)。对照组给予等体积生理盐水。此外,鸢尾素的用量是根据先前的一项研究确定的[18]。腹腔注射LPS或等体积生理盐水24 h后,以0.05 mg/g戊巴比妥钠腹腔注射处死小鼠,并采集血液和肾脏标本。
肾近端小管上皮细胞(HK-2)的培养与处理HK-2购自武汉华联生物科技有限公司。在含5%胎牛血清(FBS)和1%青霉素链霉素的Dulbecco‘s Modified Eagle’s培养基(DMEM)/F12(美国Gibco)中,37°C,5% CO2温箱中培养。当细胞生长至80%融合时,用LPS孵育8 h,建立脓毒症模型。
为探讨鸢尾素的作用机制,在LPS孵育前分别用重组鸢尾素5 μmol/L和10 μmol/L处理细胞12 h和18 h。另外,部分细胞在加入鸢尾素之前先用腺苷酸活化蛋白激酶(AMPK)的抑制剂:化合物C(5 μmol/L,Sigma-Aldrich)预处理8 h。
肾功能评价血液样本凝结后,离心获得血清,分别测定尿素氮(BUN)和肌酐(SCr)浓度,评价肾功能。
肾小管损伤评价肾组织用10%福尔马林固定,石蜡包埋,制备厚度为3 μm,苏木精-伊红(HE)染色。肾小管损伤情况由两名有经验的肾脏病理研究人员盲法评估。评分标准:0分,肾小管损伤<10%;1分,肾小管损伤10%~25%;2分,肾小管损伤25%~50%;3分,肾小管损伤50%~75%;4分,肾小管损伤>75%。随机选择至少10个部分,计算平均分。
WesternBlotting(WB)检测蛋白质水平肾组织用RIPA裂解缓冲液收集蛋白质。用BCA试剂盒测定蛋白质浓度。用SDS-PAGE凝胶分离蛋白质并转移到PVDF膜上,用5%脱脂牛奶封闭后,用以下一抗在4 ℃孵育过夜:UCP2、bcl-2原癌基因的编码蛋白(Bcl-2)、激活半胱氨酸天冬氨酸蛋白水解酶3(c-caspase-3)、Bcl-2样蛋白4(Bax)、白细胞介素(IL)1β、IL-6、肿瘤坏死因子α(TNF-α)、肾损伤分子1(KIM-1)、腺苷酸活化蛋白激酶(AMPK)、磷酸化腺苷酸活化蛋白激酶(p-AMPK)和甘油醛-3-磷酸脱氢酶(GAPDH)。用辣根过氧化物酶(HRP)标记的二抗(1:3 000稀释度)在37 ℃孵育1 h,每步洗涤3次,每次10 min。最后,使用化学发光ECL试剂盒(Bio-Rad,USA)检查这些膜并由Image Lab 5.2.1扫描。蛋白表达归一化为GAPDH表达。
ELISA检测炎症因子水平利用武汉赛培生物科技公司提供的小鼠IL-1β(SP12667)、IL-6(SP13755)和TNF-α(SP13726)ELISA试剂盒定量测定血清中IL-1β、IL-6、TNF-α水平。根据试剂盒说明,将血清标本和生物素偶联剂加入到抗体预涂布孔中。然后加入辣根过氧化物酶(HRP)偶联剂和TMB底物。用荧光微板阅读器在450 nm处用分光光度法测量黄色的强度。
TUNEL检测肾组织中细胞凋亡石蜡切片按TUNEL凋亡检测试剂盒(南京KeyGen Biotech,江苏)制作,细胞核用DAPI(Boster,武汉)染色。用立式荧光显微镜观察每切片10个随机区域,计数阳性细胞数,进行凋亡细胞的相对定量。
实时定量PCR(RT-qPCR)分析用TRIzol试剂从HK-2细胞中提取总RNA,随后使用转录器第一链cDNA合成试剂盒(罗氏,巴塞尔,瑞士)将该mRNA反转录为cDNA。用LightCycler 480SYBR Green 1 Master Mix(罗氏,巴塞尔,瑞士)进行RT-qPCR分析基因表达。引物由高原生物医学技术研究所(中国北京)合成,引物序列为:FNDC5(F:5’-AGCTCAGAAGTAGAATGCGAGAG-3’;R:5’-GGTGATAGGAAGATGGTGGTGGT-3’)AMPK(F:5’-GGGCACCTGTGGTGCTACCTG-3’;R:5’-ATGAGCTTTGCCTCCGTCCGC-3’)UCP2(F:5’-CACCTTCGGCAAAGTGAAGA-3’;R:5’-TCTTCAACCCTCCCGTGTTT-3’)GAPDH(F:5’-AGACAGCCGCTTCTTGT-3’;R:5’-CTTGCCGTGGGTAGAGTCAT-3’)。
荧光显微镜检测细胞内ROS水平用2‘,7’-二氯荧光素二乙酸酯(DCFH-DA)和二氢乙锭(DHE)测定HK-2细胞内ROS水平。DHE(Beyotime,中国,上海)用于超氧阴离子染色,DCFH-DA(Beyotime,上海,中国)用于评估过氧化氢(H2O2)含量。在相同条件下采集图像,并使用Image-Pro Plus 6.0软件(Media Controbernetics,MD,USA)对各组的平均荧光强度进行量化以进行结果比较。
统计学方法数据采用《GraphPad Prism 8》软件进行统计分析。两组间的比较采用t检验。多组间比较分析采用单因素方差分析,然后进行后LSD检验。采用Spearman’s分析评价两因素间的相关性。本研究所有测量数据均用均值±标准差表示,P<0.05认为差异具有统计学意义。
结 果
鸢尾素显著改善SA-AKI的肾损伤C57BL/6小鼠肾经LPS处理后BUN和SCr显著升高。在给鸢尾素后,小鼠的肾功能明显减轻,表现为BUN和SCr水平显著下降。WB检测SA-AKI中KIM-1的表达,与对照组相比,LPS组KIM-1水平升高,然而,在补充鸢尾素后,SA-AKI小鼠中KIM-1的表达显著降低。用HE染色观察各组SA-AKI小鼠肾脏损伤情况,与对照组相比,LPS组肾小管损伤评分水平升高,在补充鸢尾素后,能显著改善肾损伤,降低损伤评分(图1)。
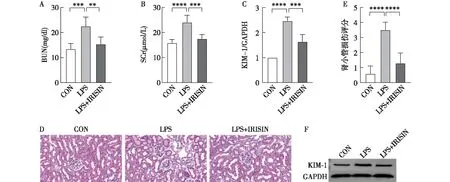
图1 各组小鼠肾功能、肾组织肾小管损伤评分和肾组织蛋白提取物KIM-1浓度CON:对照组;LPS:脂多糖处理组;LPS+IRISIN:脂多糖和鸢尾素处理组;BUN:血尿素氮;SCr:血清肌酐;KIM-1:肾损伤分子1;GAPDH:甘油醛-3-磷酸脱氢酶;A:各组小鼠BUN浓度;B:各组小鼠SCr浓度;C:肾组织蛋白提取物KIM-1水平;D:肾脏病理图片(HE,×400);E:肾小管损伤评分的定量分析;F:肾组织蛋白提取物KIM-1水平及内参GAPDH的Western Blotting检测;**P<0.01,***P<0.001,****P<0.000 1
鸢尾素显著改善SA-AKI的炎症反应小鼠血清和肾组织中的炎症因子(TNF-α、IL-1β和IL-6)的水平在LPS组较对照组明显升高。同时,经过鸢尾素处理后的实验组炎症因子(TNF-α、IL-1β和IL-6)较LPS组明显下降(图2)。

图2 肾组织蛋白提取物和血清炎症因子的浓度CON:对照组;LPS:脂多糖处理组;LPS+IRISIN:脂多糖和鸢尾素处理组;IL-6:白细胞介素6;IL-1β:白细胞介素-1β;TNF-α:肿瘤坏死因子α;GAPDH:甘油醛-3-磷酸脱氢酶;A:肾组织炎症因子(IL-6、IL-1β、TNF-α)及内参GAPDH的Western Blotting检测;B~D:肾组织炎症因子(IL-6、IL-1β、TNF-α)的Western Blotting检测结果分析;E~G:血清炎症因子(IL-6、IL-1β、TNF-α)的ELISA结果分析;*P<0.05,**P<0.01,****P<0.000 1

图3 肾组织蛋白提取物中凋亡因子浓度和肾组织细胞凋亡水平CON:对照组;LPS:脂多糖处理组;LPS+IRISIN:脂多糖和鸢尾素处理组;Bcl2:Bcl-2原癌基因编码蛋白;c-caspase3:半胱氨酸天冬氨酸蛋白酶3;Bax:Bax蛋白;A:凋亡因子(Bcl2、c-caspase3、Bax)及内参GAPDH的Western Blotting检测;B~D:凋亡因子(Bcl2、c-caspase3、Bax)及内参GAPDH的Western Blotting检测结果分析;E:肾组织中TUNEL检测的代表性图像;F:肾脏中TUNEL染色阳性细胞的比;**P<0.01,***P<0.001,****P<0.000 1

图4 肾组织蛋白提取物中UCP2、AMPK和P-AMPK的浓度CON:对照组;LPS:脂多糖处理组;LPS+IRISIN:脂多糖和鸢尾素处理组;UCP2:解偶联蛋白2;AMPK:AMP依赖的蛋白激酶;P-AMPK:磷酸化AMPK;A、B:细胞中UCP2及内参GAPDH的Western Blotting检测结果分析;C、D:各组胞中AMPK、P-AMPK的Western Blotting检测和结果分析;*P<0.05,**P<0.01,****P<0.000 1;NS:无显著差异
鸢尾素显著改善SA-AKI的细胞凋亡肾小管细胞凋亡是SA-AKI的一个重要病理特征,通过分析caspase 3的激活和TUNEL法来检测各组细胞凋亡情况。WB检测显示,与对照组相比,LPS组c-caspase-3、Bax激活明显,Bcl-2受到明显抑制,然而,在鸢尾素预处理后,SA-AKI小鼠中c-caspase-3、Bax的激活显著降低,Bcl-2 水平恢复(图3A~D)。此外,TUNEL检测显示同样的结果(图3E、F),在LPS损伤前,经鸢尾素预处理后的小鼠,凋亡细胞比例明显降低。
鸢尾素上调SA-AKI中UCP2和AMPK通过WB检测分析各组小鼠肾组织蛋白提取物中UCP2和AMPK蛋白的表达。与对照组相比,LPS组UCP2和AMPK蛋白表达明显增加,经鸢尾素预处理后,UCP2和AMPK蛋白表达进一步增加(图4)。
鸢尾素显著改善SA-AKI的氧化应激在体外,用LPS孵育HK-2细胞,建立脓毒症模型。DHE/DCFH-DA荧光染色(图5A)所示,与对照组相比,LPS组ROS和H2O2水平明显升高。然而,与LPS组相比,经过鸢尾素预处理的实验组显著降低了细胞中ROS和H2O2水平(图5B)。

图5 HK-2细胞内ROS水平(DHE/DCFH-DA荧光染色)CON:对照组;LPS:脂多糖处理组;HK-2:肾近端小管上皮细胞;LPS+IRISIN:脂多糖和鸢尾素处理组;A:HK-2细胞DHE/DCFH-DA荧光染色的图片,比例尺=40 μm;B:HK-2细胞ROS荧光检测结果分析;****P<0.000 1
鸢尾素调控的UCP2表达可能与AMPK的激活有关利用RT-qPCR技术测定各组HK-2细胞中FNCD5 mRNA 、AMPK mRNA、 UCP2 mRNA的水平。对照组与LPS组两者之间无显著差异,说明LPS刺激不会导致内源性FNCD5含量增加。经过鸢尾素处理后,FNCD5 mRNA水平升高,而且不受化合物C影响,说明鸢尾素不受AMPK抑制剂的影响(图6A)。与对照组相比,鸢尾素处理的HK-2细胞具有明显的AMPK激活和UCP2表达。但是,用AMPK抑制剂化合物C预处理可明显抑制鸢尾素对AMPK和UCP2水平的影响(图6B、C)。
为进一步证实上述结论,采用不同时间点和不同剂量鸢尾素预处理HK-2细胞。加大鸢尾素剂量和延长处理时间均可导致AMPK和UCP2水平升高,表明鸢尾素和AMPK及UCP2之间存在线性关系(图6D、E)。

图6 HK-2细胞中FNCD5、UCP2和AMPK mRNA浓度CON:对照组;LPS:脂多糖处理组;LPS+IRISIN:脂多糖和鸢尾素处理组;LPS+IRISIN+CC:脂多糖、鸢尾素和化合物C处理组;FNCD5:纤维连接蛋白Ⅲ型含结构域蛋白5;UCP2:解偶联蛋白2;AMPK:AMP依赖的蛋白激酶;A~C:细胞中FNCD5 mRNA 、AMPK mRNA和UCP2mRNA的含量 (RT-qPCR);D、E:鸢尾素处理后HK2细胞AMPK mRNA和UCP2 mRNA (RT-qPCR)的变化;*P<0.05,**P<0.01,****P<0.000 1;NS:无显著差异
讨 论
在脓毒症期间,肾小管上皮细胞表现出氧化应激、ROS的产生和线粒体损伤的增加,线粒体功能障碍在SA-AKI发展中起关键作用,因此,改善和保护线粒体功能成为SA-AKI治疗研究的重点。UCP2是一种位于线粒体内膜上的阴离子转运蛋白,在控制线粒体产生活性氧方面起着关键作用[12-13]。
在本研究中,我们选择了经典的LPS诱导的AKI模型,并通过腹腔注射鸢尾素来研究鸢尾素在SA-AKI进展中的作用。通过对肾功能、肾小管损伤、各种促炎细胞因子、氧化应激和细胞凋亡水平的对比检测,证实LPS成功造模后小鼠的肾功能明显恶化,肾小管损伤加重,促炎细胞因子增多,氧化应激和细胞凋亡显著增加。同时也证实了鸢尾素能明显改善SA-AKI模型肾功能和小管上皮的损伤,抑制TNF-α、IL-6、IL-1β和KIM-1的表达,降低氧化应激和凋亡水平。此外,根据实验结果推测鸢尾素对SA-AKI的保护作用可能至少部分与激活AMPK/UCP2信号通路有关。
综上所述,鸢尾素通过上调线粒体UCP2的表达在SA-AKI过程中起保护作用。因此,鸢尾素是一种针对LPS诱导的AKI的潜在治疗剂。此外,本研究主要研究鸢尾素对SA-AKI中UCP2的影响,其他机制和数据还有待于进一步的实验和研究。

