黄芪对脂多糖诱导的小鼠急性肺损伤作用机制的研究
沈晔 李茜 郑悦亮 韩楠楠 陈环 王圣果

[摘要] 目的 通过气管内滴注脂多糖建立小鼠急性肺损伤模型,探讨黄芪对急性肺损伤的保护作用及其療效评估。方法 将小鼠随机分为正常对照组(气管内滴注无菌PBS 60 μl)、模型组(LPS组,气管内滴注0.5 mg/kg,LPS 100 μl,作用24 h)、黄芪治疗组(0.75 g/L RA+LPS组),观察小鼠肺组织病理学改变、支气管肺泡灌洗液(BALF)中细胞计数变化、测定蛋白含量及超氧化物歧化酶(SOD)活性。分离肺组织以评估湿/干重比,Western blot 法检测促炎细胞因子的mRNA表达和组织学变化。 结果 与模型组相比,黄芪治疗组BALF中总细胞数及蛋白质含量比值明显降低(P<0.01);黄芪治疗组小鼠右肺中叶W/D比值明显降低(P<0.01);小鼠血清SOD活性含量明显高于模型组(P<0.01)。在肺泡灌洗液检测中发现,与模型组相比,黄芪治疗组TNF-α、IL-1β、IL-6含量明显降低,差异有统计学意义(P<0.01)。病理组织学提示黄芪治疗组可显著减轻肺组织损伤。 结论 黄芪能够显著减轻LPS诱导的肺部炎症,对小鼠急性肺损伤有很强的保护作用。
[关键词] 急性肺损伤;黄芪:脂多糖;炎症细胞迁移
[中图分类号] R285.5 [文献标识码] A [文章编号] 1673-9701(2022)01-0038-04
Study on the mechanism of radix astragali on lipopolysaccharide-induced acute lung injury in mice
SHEN Ye1 LI Qian1 ZHENG Yueliang1 HAN Nannan1 CHEN Huan1 WANG Shengguo2
1.Department of Emergency Medicine, Zhejiang Provincial People′s Hospital, Hangzhou 310014, China; 2.Department of Emergency, the First People′s Hospital of Jiashan County in Zhejiang Province, Jiashan 314100, China
[Abstract] Objective To establish a mouse model of acute lung injury by intratracheal instillation of lipopolysaccharide, and to explore the protective effect of radix astragali on acute lung injury and the evaluation of curative effect. Methods The mice were randomly divided into the normal control group (intratracheal instillation of 60 μl of sterile PBS), the model group (LPS group, intratracheal instillation of 0.5 mg/kg, 100 μl of LPS for 24 h) and the radix astragali treatment group (0.75 g/L RA+LPS group). The histopathological changes of lung tissue, the changes of cell count in bronchoalveolar lavage fluid (BALF) were observed. The protein content and the activity of superoxide dismutase (SOD) were measured. Lung tissues were isolated to assess the wet/dry weight ratio.The mRNA expression and histological changes of proinflammatory cytokines were detected by Western blot. Results Compared with LPS model group, the total cell count and protein content ratio in BALF of radix astragali treatment group were significantly decreased(P<0.01). The W/D ratio in the right middle lobe of mice in radix astragali treatment group was significantly decreased(P<0.01). The SOD activity content in serum of mice in radix astragali treatment group was significantly higher than that of LPS group(P<0.01). The bronchoalveolar lavage fluid examination found that the contents of TNF-α, IL-1β, and IL-6 were significantly lower in the radix astragali treatment group compared with the model group(P<0.01), and the differences were statistically significant (P<0.01). Histopathology suggested that the astragalus treatment group significantly reduced lung tissue injury. Conclusion Radix astragali can significantly reduce LPS-induced pulmonary inflammation and has a strong protective effect on acute lung injury in mice.
[Key words] Acute lung injury; Radix astragali; Lipopolysaccharide; Inflammatory cell migration
急性肺损伤(acute lung injury,ALI)是由各种肺内外因素致血管通透性持续增加、弥漫性肺脏炎症损伤,进而引起急性呼吸衰竭的临床综合征[1]。革兰阴性细菌感染作为ALI发生的重要原因之一,其主要的的致病成分脂多糖(LPS)可诱导显著的氧化应激和炎症反应,此二者被认为在ALI发病机制中居重要地位[2]。因此,靶向控制氧化应激和炎症应答的治疗手段有可能为临床防治ALI提供新的思路。黄芪(radix astragali,RA)是我国传统中草药,最早记载于《神农本草经》,属用药上品,具有益气、祛邪、扶正,归脾、肺经,补气升阳、益卫固表之功效[3]。RA具有抗炎、抗氧化、抗病毒、抑菌,心脏神经保护作用等[3]。本实验拟通过观察RA对LPS致小鼠肺损伤后肺组织病理性变化、肺泡灌洗液中细胞计数变化、炎症因子表达的变化,探索其对急性肺损伤的保护作用,为临床治疗提供实验依据,现报道如下。
1 资料与方法
1.1 一般材料
1.1.1 试剂 LPS(Sigma Chemical公司);Trizol分离试剂(Invitrogen公司);IL-1β、IL-6、IL-10、TNF-α的ELISA试剂盒(上海斯信生物科技股份有限公司);实时荧光定量PCR试剂(杭州博日科技有限公司);MPO、SOD检测试剂盒(南京建成生物工程研究所)。黄芪购买于本院中医药库。
1.1.2 动物实验 健康雄性SOD小鼠60只,体重150~200 g。本动物实验在浙江省中医药大学动物实验中心进行。动物许可证号:SYXK(浙)2018-0012。所有的操作和实验流程均遵守《实验动物管理条例》。动物在实验前自由进食和进水。将RA以10 mmol/L溶解于DMSO中作为储备浓度。在使用前立即将过硫酸铵(APS)原液稀释于无菌生理盐水中(最终DMSO浓度为0.1%)。根据文献本研究选择质量浓度0.75 g/L作为RA的最终剂量。
1.2 方法
1.2.1 ALI小鼠模型建立和实验方案 将小鼠随机分成:正常对照组(NS组)、模型组(LPS组)、黄芪治疗组(RA组)和地塞米松阳性对照组(DEX组,5 mg/kg)四组,每组12只。黄芪治疗组小鼠分别予按千克体重15 mL黄芪提取物悬浊液(体重浓度0.75 g/L)进行灌胃,1次/d。模型组、正常对照组给予等量生理盐水灌胃。地塞米松阳性对照组在造模前1 h给予地塞米松5 mg/kg灌胃,连续灌胃30 d。第31天,除正常对照组外,其余各组小鼠均经腹腔注射1%戊巴比妥钠溶液[80 mg/(kg·bw)]麻醉,采用经口气管插管后气道内滴入LPS(0.5 mg/kg,100 μL)建立小鼠ALI模型[4]。
1.2.2 组织病理学分析 HE染色小鼠肺组织及病理评分,并测定小鼠肺组织湿/干重比:造模24 h后将小鼠麻醉后股动脉放血处死,暴露气管,结扎左肺,用 4%多聚甲醛固定左肺组织样本24 h,采用乙醇脱水,石蜡包埋,切片(5 μm)。切片进行HE染色后并进行肺组织学检查;取右肺称重(湿重),置60℃烘箱48 h后称干重,肺湿重/干重比值代表了肺水含量,根据(湿重-干重)/湿重公式计算肺水含量。
1.2.3 支气管肺泡灌洗液分析 提取肺泡灌洗液,检测小鼠BALF中总蛋白及LDH的水平,并检测小鼠BALF中细胞总数、中性粒细胞数:各组小鼠气管插管后行肺泡灌洗,提取3次肺泡灌洗液共1.2 ml,在4℃下以5000 rpm离心10 min来对BALF进行固化。回收的肺泡灌洗液離心后,吸取上清液检测细胞因子、SOD活性。去掉BALF的上清液后,细胞沉淀用PBS溶液计数总细胞数与中性粒细胞数。
1.2.4 肺组织MPO活性检测 BALF上清和肺组织中匀浆在4℃,10 000 rpm离心15 min,取其上清液,分别取各组小鼠的肺组织,在冰上使用匀浆器充分匀浆组织后10 000 r/min离心10 min,收集离心后上清,即为肺组织匀浆液。依照试剂盒说明书的操作步骤测定组织匀浆液在480 nm处的吸光度值,根据吸光度值计算肺组织的MPO活性。操作均严格按照试剂盒说明书进行。
1.2.5 细胞因子mRNA表达的测定 用研磨器将收集右肺中叶组织研碎,取0.1 ml肺组织加入1 ml左右Trizol匀浆。匀浆液置于4℃,12 000 rpm离心,取上清液。按照Trizol法上清液依次加入氯仿、异丙醇,冷75%乙醇(DEPC水配置)混合均匀,弃上清。每管中加入20 ml DEPC处理的水,使总RNA溶解,经核酸紫外分析仪检测,根据A260/A280b比值,确定样品中RNA纯度及含量。提取各组小鼠右肺的总RNA,并反转录cDNA。采用real-time PCR仪扩增检测Ct值。PCR产物检测采用1.5%琼脂糖凝胶电泳,以β-actin为阳性对照,采用2-△△ct法计算肺组织TNF-α,IL-6和IL-1β mRNA与内参基因的比值。本文中引物序列为:TNF-α的上下游引物分别为:5’-AAATGGGCTCCCTCTA-TCAGTTC-3’,5’-TCTGCTTGGTGGTTTGCTACGAC-3’,IL-6的上下游引物分别为5-TCCTACCCAACTTCCAATGCTC-3’,5’-TTGGATGGTCTTGGTCCTTAGCC-3’,IL-1Β的上下游引物分别为:5’-GCTTCAGGCA-GGCAGTAT-3’,5’-ACAAACCGCTTTTC-CATCT-3’。
1.3 统计学方法
采用SPSS 19.0统计软件进行分析,计量资料采用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验,P<0.05为差异有统计学意义。
2 结果
2.1 黄芪减轻LPS诱导的小鼠肺组织损伤
正常对照组小鼠肺组织、肺泡间隔正常,肺泡腔内无渗出物;LPS组小鼠表现为肺泡间隔明显增厚、间质水肿、肺泡腔内炎症细胞浸润、肺泡结构破坏为特征的肺组织弥漫性病变。与地塞米松(Dex)相似,黄芪各组小鼠肺泡间隔增厚,但较LPS损伤减轻,且高剂量黄芪组较低剂量组损伤轻。见封三图7。
2.2 黄芪显著抑制小鼠ALI模型中LPS诱导的炎症反应
黄芪可减少ALI小鼠肺组织的炎症细胞浸润,与正常对照组相比,LPS诱导的ALI小鼠BALF中总细胞数、中性粒细胞数及巨噬细胞数显著增加,而淋巴细胞计数降低(P<0.05)。见表1、图1。经重复测量方差分析,不同治疗组间总细胞计数(F=69.9537,P<0.001),中性粒细胞计数(F=684.74,P<0.001);淋巴细胞在不同治疗组的水平显示(F=1324.26,P<0.001),巨噬细胞计数(F=735.965,P<0.001),各组间效应比较,差异均有统计学意义(P<0.05)。与LPS组比较,RA组及DEX组BALF中总细胞数及中性粒细胞数则明显减少,提示黄芪及DEX明显抑制了LPS刺激下的炎症细胞渗出。
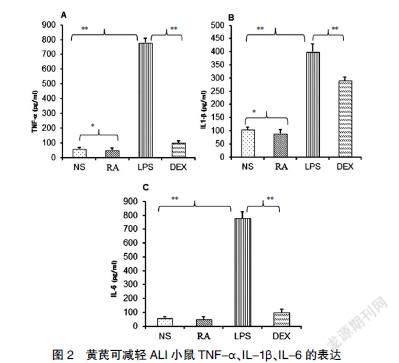
2.3 黄芪可减轻ALI小鼠TNF-α、IL-1β、IL-6的表达
与正常对照组相比,LPS诱导后的小鼠血清中TNF-α、IL-1β、IL-6浓度显著升高(P<0.01),而黄芪和DEX干预后均可抑制肺组织中促炎细胞因子TNF-α、IL-1β、IL-6表达(P<0.01)。结果提示,黄芪可通过抑制炎症介质产生,减少炎症细胞聚集,从而减轻肺损伤。见图2。
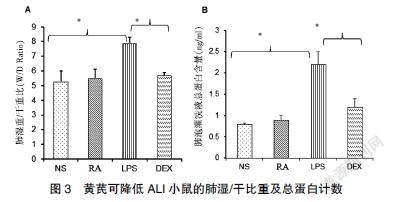
2.4 黄芪可有效降低ALI小鼠血管通透性
LPS诱导的ALI小鼠肺湿/干重比和总蛋白含量明显增高。见图3A。而RA组及DEX组均可显著抑制LPS引起的BALF总蛋白浓度升高(P<0.01)。见图3B。因此黄芪可明显降低LPS诱导小鼠ALI模型中的肺湿/干重比及蛋白渗漏,有效降低血管通透性。
A:LPS组、黄芪治疗组各小鼠组间不同肺湿/干重比统计学分析B:各组小鼠BALF总蛋白含量统计学分析。与LPS治疗组相比,黄芪治疗组肺湿/干重比及BALF总蛋白含量差异均有统计学意义,P<0.05。*P<0.05,**P<0.01 vs. LPS,表示差异有统计学意义
2.5 黄芪显著抑制ALI模型中LPS诱导的氧化应激
本研究通过测量超氧化物歧化酶(SOD)活性来确定黄芪对LPS诱导的ALI小鼠BALF中的氧化应激的影响(图4)。与NS组、RA组相比,LPS组SOD活性显著降低(P<0.01)。与NS组相比,RA组SOD活性显著增加(P<0.01),表明黄芪具有优异的抗氧化能力,可能通过抑制氧化应激来减轻肺损伤。
3 讨论
ALI是各种肺内、肺外因素导致的急性弥漫性炎症性肺损伤综合征,其中肺内炎症细胞的过度活化,炎症因子瀑布性释放和氧化应激是早期急性肺损伤发病机制中关键的因素[5]。LPS是革兰阴性菌细胞壁外膜上的的主要成分之一,可诱导机体免疫应答,激活白细胞,诱导炎症反应及氧化应激。因此LPS常用于诱导ALI的动物模型[6]。
LPS给小鼠气管内直接滴入可诱导免疫细胞介导的炎症反应网络,引起一系列的前炎因子释放,最终导致肺部急性炎症反应[7-8]。本研究通过应用LPS气管内直接滴入法诱导小鼠急性肺损伤模型,结果显示LPS(0.5 mg/kg,100 μl)气管滴入24 h后BALF中的白细胞和中性粒细胞数目显著增加,肺水肿明显,肺湿/干重指数增高,肺组织以明显的炎症细胞浸润、肺毛细血管通透性增加、肺水肿为主要表现;BALF中SOD下降,肺组织中MPO增高,TNF-α、IL-1β、IL-6 mRNA顯著表达。这些均提示,LPS首先激活中性粒细胞和肺泡巨噬细胞、内皮细胞和血小板,进一步诱导氧自由基募集,失控性地释放炎症因子及溶酶体的产生和释放,参与ALI的发生和发展[9]。其中,早期反应细胞因子IL-1β与TNF-α进一步促进如IL-2、IL-6、巨噬细胞炎症蛋白1α(macrophage inflammatory protein 1α,MIP-1α)、MIP-1β等从而诱导单核/巨噬细胞迁移趋化,放大炎症过程,引起级联“瀑布效应”[10-11],最终导致血管通透性增高、肺水肿及透明膜形成[12]。
中草药治疗ALI疗效确切,并被临床及实验研究所证实[13-14]。传统医学认为ALI的发生与六淫邪气、房劳伤肾、情志内伤及先天禀赋不足有关[15-16]。其病位在肺,瘀、痰、热为标,涉及脾肾,属本虚标实之证;而黄芪作为补气健脾固表之圣药,先前研究中已明确证实其可有效预防肺损伤[18-20]。本研究结果同样表明黄芪对LPS诱导的小鼠急性肺损伤有很强的保护作用。黄芪能够显著减轻LPS诱导的肺部炎症,包括对炎症细胞渗出(巨噬细胞、中性粒细胞)和促炎介质(TNF-α、IL-6、IL-1β)产生有效抑制。同时黄芪及DEX对ALI小鼠BALF的蛋白渗出均有显著的抑制作用。因此,黄芪与地塞米松治疗ALI肺组织损伤及蛋白质渗出疗效可能是相近的[18-12]。同时肺组织形态学提示黄芪可以减轻LPS诱导所致的肺组织炎症水肿、出血、肺泡结构及血管损伤性改变。提示黄芪对LPS诱导的肺损伤保护作用可能与其阻止炎症细胞向肺泡腔内迁移能力有关。
综上所述,本研究通过建立黄芪治疗小鼠LPS诱导的小鼠肺损伤模型,评估黄芪对小鼠肺损伤的保护作用。发现黄芪能显著预防炎症细胞迁移,降低细胞计数、减轻肺水肿,降低BALF中总蛋白质含量,提高SOD活性,降低肺组织炎症细胞因子的表达,并显著保护LPS诱导小鼠的肺损伤。组织学研究表明,黄芪可显著抑制ALI小鼠肺组织中性粒细胞的浸润。结果表明,黄芪对LPS诱导的小鼠ALI具有保护作用。此外,对详细评价黄芪药理学机制至关重要,为ALI的防治研究提供新的实验基础。
[参考文献]
[1] Ashbaugh DG,Bigelow DB,Petty TL.Acute respiratory distress in adults[J]. Lancet,1967,2:319-323.
[2] Costa NDSX,Júnior GR,Belotti L,et al.Early and late pulmonary effects of nebulized LPS in mice:An acute lung injury model[J].PLoS One,2017,12(9):1-16.
[3] Auyenk KK,Han QB,Ko JK,et al. Astragalus membranaceus:A review of its protection against inflammation and gastrointestinal cancers[J].American Journal of Chinese Medicine,2016,44(1):1-22.
[4] 宣国平,张琳,钟明媚,等.脂多糖致大鼠急性肺损伤模型取材时间选择[J].中华实用诊断与治疗杂志,2015, 29(2):136-138.
[5] Yin X,Chen L,Liu Y,et al.Enhancement of the innate immune response of bladder epithelial cells by astragalus polysaccharides through upregulation of TLR4 expression[J].Biochem Biophys Res Commun,2010,397(2):232-238.
[6] Reilly JP,Christie JD,Meyer NJ,et al. Fifty years of research in ARDS. Genomic contributions and opportunities[J].American Journal of Respiratory and Critical Care Medicine,2017,196:1113-1121.
[7] Matute Bello G,Frevert CW,Martin TR,et al. Animal models of acute lung injury[J]. Am J Physiol Lung Cell Mol Physiol,2008,295:379-399.
[8] Broz P,DixitVM.Inflammasomes:Mechanism of assembly,regulation and signalling[J].Nat Rey Immunol,2016, 16(7):407-420.
[9] Schroder K,Sagulenko V,Zamoshnikova A,et al. Acute lipopolysaccharide priming boosts inflammasome activation independently of inflammasome sensor induction[J].Immunobiology,2012,217(12):1325-1329.
[10] Li L,Dong L,Zhao D,et al.Classical dendritic cells regulate acute lung inflammation and injury in mice with lipopolysaccharide induced acute respiratory distress syndrome[J].Int J Mol Med,2019,44: 617-629.
[11] 赵燕,程黎,宋志新,等.白介素-17对急性肺损伤时肺水肿液清除的影响[J].南方医科大学学报,2017,37:494-498.
[12] Dolinay T,Kim YS,Howrylak J,et al.Inflammasome regulated cytokines are critical mediators of acute lung injury[J].Am J Respir Crit Care Med,2012,185:1225-1234.
[13] Shah A,Rather MA,Hassan QP,et al.Discovery of anti-microbial and anti-tubercular molecules from Fusarium solani:An endophyte of glycyrrhiza glabra[J].Appl Microbiol,2017,122:1168-1176.
[14] Meenu Mehtaabc,Parvarish Sharmaa.Plant-based drug delivery systems in respiratory diseases[J]. Acdemic Press,2020,2020:517-539.
[15] 李小茜,杨爱东.急性肺损伤发病机制及中医辨证治疗的思考[J].中国中西医结合急救杂志,2018,25(1):9-15.
[16] Wang DY,Yang AD,Guo YJ,et al. Exploration and thinking of traditional Chinese medicine treating acute lung injury[J]. Liaoning J TCM,2008,35(7):1010-1012.
[17] 徐思娟,彭再梅.急性肺損伤和急性呼吸窘迫综合征发病机制的研究现状与展望[J].中华急诊杂志,2014,10(23):1179-1182.
[18] Lv J,Zhang Y,Tian Z,et al. Astragalus polysaccharides protect against dextran sulfate sodium-induced colitis by inhibiting NFκB activation[J]. International Journal of Bi-ological Macromolecules,2017,9(8):723-729.
[19] 范颖,乔铁,滕飞,等.黄芪功效主治的衍化及其应用与发展[J].中华中医药杂志,2010,8(25):1164-1167.
[20] 李程豪,任春贞,刘永琦,等.黄芪多糖对IL-6和TNF-α模拟炎性微环境中BMSCs增殖及TAFs分化的影响[J].中华中医药杂志,2018,7(33):3039-3042.
(收稿日期:2021-01-05)

