春雷霉素在番茄幼苗中的吸收与转运机制
张洪珍,卫国羽,赵 微,胡安龙*
(1.贵州大学作物保护研究所,贵阳 550025;2.贵州大学农学院,贵阳 550025)
农药分为内吸性农药和非内吸性农药。对于具有内吸性的农药而言,农药分子进入植物细胞有主动运输和被动运输。通常研究认为农药以被动扩散的方式进入植物细胞,而关于蚕豆叶原生质体吸收草甘膦的试验结果证明,植物对草甘膦的吸收是被磷酸盐转运蛋白介导[1]。春雷霉素(图1),又称春日霉素,其结构由二碳侧链、春雷胺和D-肌糖三部分组成[2]。该类抗生素是一种农用、医用抗生素,其能抑制氨酰-tRNA结合mRNA-核糖体蛋白复合体,阻止蛋白质翻译的起始,抑制菌丝生长和造成细胞颗粒化,从而使得病原菌凋亡[3]。春雷霉素自研发以来,由于其高效低毒的特性,在亚洲和南美洲被广泛应用于农业,对稻瘟病、番茄叶霉病、马铃薯环腐病、黄瓜和西瓜细菌性角斑病等具有很好的防效[4],在农业病害防治中具有很大的应用价值。目前关于春雷霉素的研究主要集中在作用机制[5]、田间防效[6]、残留[7]等方面,而对于春雷霉素在植株体内的内吸传导特性和转运机制研究较少。
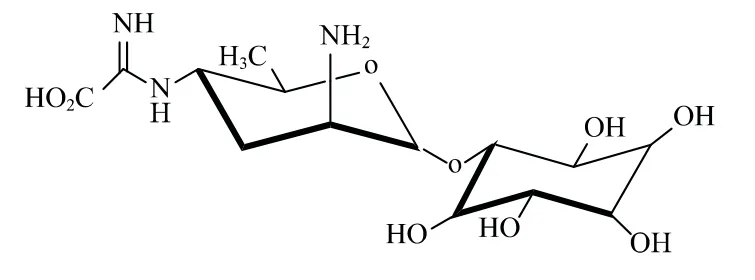
图1 春雷霉素化学结构式
农药的主动吸收及韧皮部输导对防治作物根部和维管束病害、刺吸式口器害虫等有较大优势。前人研究发现,草甘膦以主动方式跨膜运输并进入韧皮部向根部输导,使其表现出优良特性[8]。因此,探明农药分子在作物体内吸收机理与传导特性具有重要意义。本研究以番茄幼苗为研究对象,通过叶面和根部浸药,采用高效液相色谱串联质谱法探究了春雷霉素在植物体内的吸收与传导方式,以期揭示该药剂的传导特性与吸收机理,为后期该药剂研发设计靶向输导型农药分子提供依据,以及为田间科学合理施药提供参考。
1 材料与方法
1.1 仪器与试剂
Agilent 1290高效液相色谱仪、Agilent 6470质谱仪、ST16R冷冻离心机,赛默飞世尔科技(中国)有限公司;XW-80A涡旋混合器,上海精科实业有限公司;CPA225D电子天平,德国赛多利斯股份公司。
春雷霉素原药(纯度98%)、D-葡萄糖、根皮苷(纯度98%),阿拉丁试剂有限公司;氰化羰基间氯苯腙(CCCP,纯度98%)、N-丙基乙二胺(纯度98%),天津希恩思生化科技有限公司;二硝基苯酚(DNP,纯度98%),麦卡希试剂有限公司。以上均为市售国产分析纯产品。超纯水,美国密立波公司。
1.2 试验方法
1.2.1 番茄培养方法及样品前处理
精选适量饱满的种子,于30℃条件下用无菌水浸种催芽24 h,然后将种子均匀撒播在土壤表面,覆土,用喷壶洒水浸湿土壤。室内培养条件为室温(25±2)℃,用加湿器使室内湿度保持在85%左右,于光照、黑暗分别处理16、8 h。以培养3叶番茄幼苗为供试材料。称取2.00 g匀质化的番茄样品(精确到0.01 g)于10 mL离心管中,加入4 mL提取溶液(V甲醇∶V水为9∶1),涡旋振荡提取2~3 min;加入1 g氯化钠,涡旋振荡1 min,于4 000 r/min下离心5 min;取1 mL上清液至2 mL离心管中,加入30 mgN-丙基乙二胺(PSA),涡旋振荡30 s,于12 000 r/min下离心5 min;取上层净化液1 mL,过0.22μm有机滤膜,待用HPLC-MS/MS检测。
1.2.2 春雷霉素向顶传导试验
用超纯水稀释春雷霉素,使制剂质量浓度分别为50、100、150 mg/L,用5 mL药剂对每株番茄进行根部灌根施药,每个处理重复3次,以超纯水处理为对照,于相同条件温室培养。在施药后3、6、12、24、32、48 h,整株取样,取样时将根部和茎叶部分开,于-20℃保存,备用。
1.2.3 春雷霉素向基传导试验
用超纯水稀释,使制剂质量浓度分别为500、1 000、1 500 mg/L,将番茄第2张叶片(共3张叶片,浸药叶片即为中部叶片)浸于配制好的药液中,除去浸药叶,上下各有一片叶可取。用清水处理的番茄为对照,于相同条件下温室培养。在喷药后6、12、24、48、72 h整株取样,取样时将根部和茎叶部分开,称重并记录,于-20℃保存,备用。
1.2.4 不同影响因子对番茄吸收春雷霉素的影响
(1)用柠檬酸和氢氧化钾将春雷霉素药液pH值分别调至4、5、6、7、8、9,将番茄根部浸于不同pH值的春雷霉素药液中;(2)分别在24℃与4℃下将番茄根部浸于药液并分别于6、12、24 h取样;(3)将番茄根 部 分 别 浸 入 含 有0.15、0.30、0.50 mmol/L的CCCP和0.5、1.0、1.5 mmol/L的DNP溶液中培养1 h,随后转移至春雷霉素药液中培养后取样;(4)将n春雷霉素∶nD-葡萄糖=1∶20、1∶200和1∶300,以及将n春雷霉素∶n根皮苷喷=1∶10、1∶20和1∶30的配制药液分别用于番茄幼苗浸根培养,取样。以上处理药液最终浓度为150 mg/L、pH值为5(pH处理组除外),在温室培养(温度处理组除外)24 h后取番茄幼苗茎部。
1.3 检测条件
液相条件:流速为0.35 mL/min;柱温为30℃,进样量为5μL;流动相A为0.1%的甲酸水(75%);流动相B为乙腈(25%);ZORBAX HILIC Plus色谱柱(3.0 mm×50 mm,1.8μm)。质谱电喷雾离子源(ESI);正离子扫描;喷雾电压(IS+)为5 500 V;电喷雾离子源温度(TEM)为320℃;雾化气流量为310.275 kPa;碰撞室入口电压(EP)为150 V;碰撞室出口电压(CXP)为85 V;定量离子对为380.3/200.3(m/z);定性离子对为380.3/112.1(m/z)。
1.4 标准曲线及添加回收试验
用超纯水溶解纯度98%的春雷霉素,配制成质量浓度为10 mg/L的母液,再用超纯水稀释成浓度分别为0.001 0、0.062 5、0.125 0、0.250 0、0.500 0μg/L系列标准工作液,按1.3条件测定标准曲线。空白番茄样品中加入一定量春雷霉素标准工作溶液,使其添加水平分别为0.05、0.10、0.50 mg/kg,3次重复试验。按1.2.1方法进行样品前处理,按1.3条件测定,计算番茄各部位添加回收率和相对标准偏差。
1.5 数据处理
所有实验进行多次验证统计结果,每组处理番茄数为10株,重复3次。使用DPS 10.0,Duncan法对试验获得的数据结果进行差异显著性分析。
2 结果与分析
2.1 方法的线性关系、精密度和准确度
由图2可知,目标检测物保留时间为0.620 min。标准曲线线性回归方程为y=1.125 9x+5.699 9,相关系数为0.994 1。由表1可知,在0.05、0.10、0.50 mg/kg添加水平下,春雷霉素在番茄样品中的平均回收率为89%~96%,相对标准偏差(RSD)为1.00%~3.00%,均低于10.00%。按信噪比为3(S/N=3)计算检出限,可得春雷霉素检出限为0.003μg/L。结果表明,建立的方法线性关系良好,精密度和准确度较高,适用于番茄样品中春雷霉素的检测。

图2 春雷霉素在番茄各部位色谱图
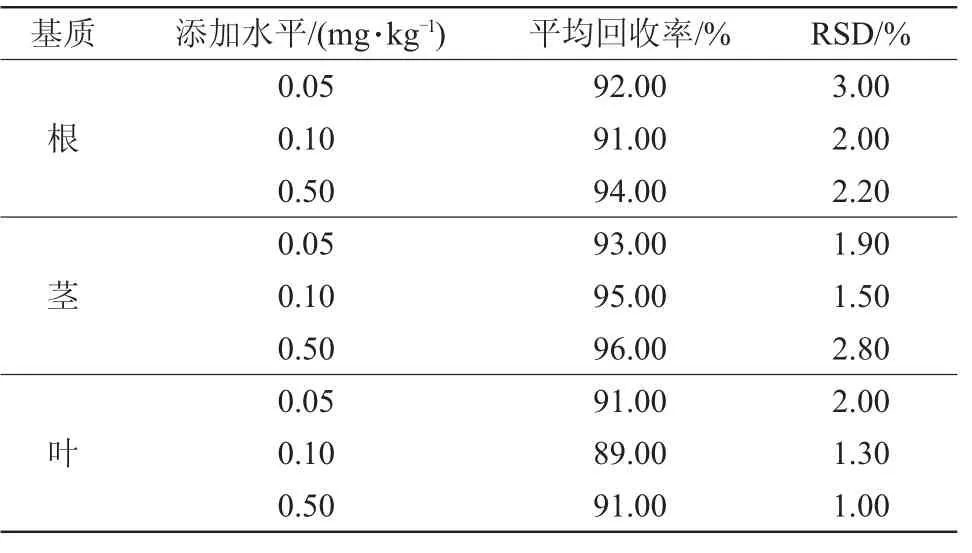
表1 春雷霉素在番茄各部位的添加回收率
2.2 根部施用春雷霉素在番茄植株中的吸收和传导
如图3所示,分别用50、100、150 mg/L春雷霉素处理番茄6 h后,在根部和茎部均能检测到春雷霉素。用药剂处理24 h后,3组不同浓度处理的叶片中检测到目标药剂含量分别为3.91、9.16、38.46μg/L。根部的春雷霉素含量在3~24 h内呈上升趋势,24~48 h内处于平衡状态,可能因为在该时间段内根部吸收的药剂迅速向茎部和叶部输送。处理48 h后,药剂在根部的累积达到最大量;50、100 mg/L处理组中,茎部的春雷霉素含量在3~48 h内差异不显著,但用150 mg/L处理后,茎部的春雷霉素含量呈显著上升趋势;高浓度处理组叶部中春雷霉素的积累量上升较快,且在24~48 h内也趋于稳定。研究结果表明,春雷霉素通过番茄幼苗根部吸收后向上传导,并在植株各个部位累积。

图3 不同浓度的春雷霉素在番茄幼苗中的吸收和分布
2.3 叶部施用春雷霉素在番茄植株中的吸收和传导
由表2可知,将幼苗中部叶片用不同质量浓度药液浸泡6 h后,在中部叶片均能检测到目标药剂,其含量分别为11.09、25.99、40.81μg/L,说明春雷霉素在番茄叶片上具有良好的吸收特性。6~12 h在幼苗上部和下部叶片均未检测到目标药剂,12 h后能检测到微量的春雷霉素,可能是药剂被叶片吸收后大部分都累积在番茄叶片的各个细胞及组织中,或是向下运输。药剂处理12 h后均可在茎部及根部检测到目标药剂,其中用1 500 mg/L处理叶片72 h后,春雷霉素在根部的累计含量可高达21.03μg/L。
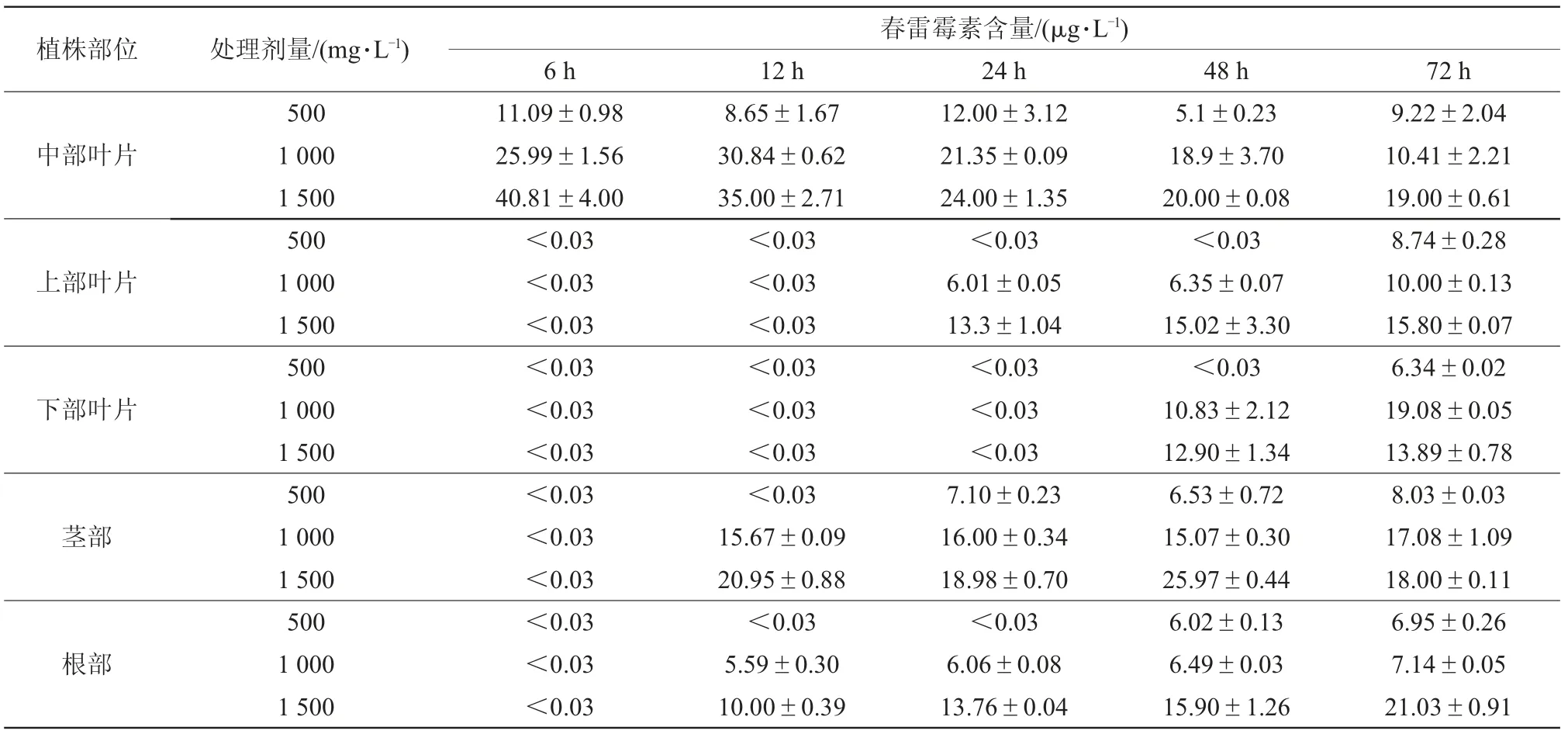
表2 春雷霉素处理中部叶片后在番茄幼苗中的吸收和分布
以上结果表明,春雷霉素在番茄体内既可通过由木质部向上运输的质外体转运,也可由韧皮部向下运输的共质体转运,具有双向运输的特性。
2.4 pH对番茄吸收春雷霉素的影响
由图4可知,春雷霉素吸收量随着碱性增强而逐渐下降。pH值为5时,春雷霉素的最大吸收量为83.07μg/L,随着pH值的升高吸收量降低,逐步降低至80.00、58.86、50.09、42.01μg/L,特别是pH值为9时直接下降到42.01μg/L,与pH值为5时的吸收量相差1.9倍,表明番茄吸收春雷霉素受酸碱性的影响。
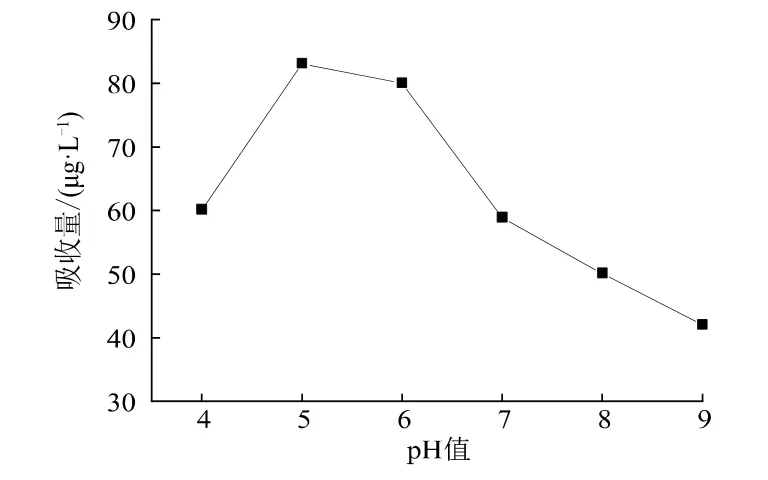
图4 pH值对番茄吸收春雷霉素影响
2.5 温度对番茄吸收春雷霉素的影响
如表3所示,2种不同温度处理下,春雷霉素的吸收量都随着时间的增加而升高,且都是在24 h吸收量最大,分别为25.90和81.46μg/L。相关研究表明,Q10值(24℃下的吸收量除以4℃下的吸收量)小于或大于2.0可作为判断作物对农药的吸收与生物代谢是否有直接的联系,还是属于被动物理过程的标准[9]。本研究中Q10值均大于2.0,表明番茄幼苗对春雷霉素的吸收属于主动运输。
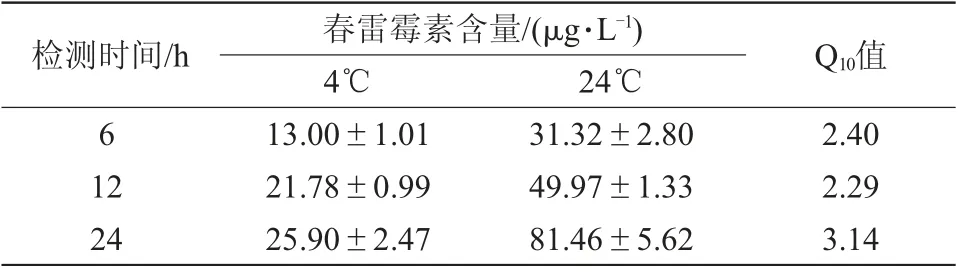
表3 不同温度条件下番茄幼苗茎部春雷霉素的吸收量
2.6 能量抑制剂对番茄吸收春雷霉素的影响
DNP可抑制细胞产生能量;CCCP是一种解偶联剂,会影响植物对化合物的吸收,能去除药物在跨膜过程中的质子驱动力,这是判断吸收过程是否需要能量的重要标准。由图5可知,加了0.50 mmol/L的CCCP和DNP的处理与未加的空白对照相比,处理24 h后,药剂吸收量由72μg/L分别下降至28、25 μg/L,均受到显著抑制,抑制率分别达60.12%、60.28%,说明番茄吸收春雷霉素需要能量。
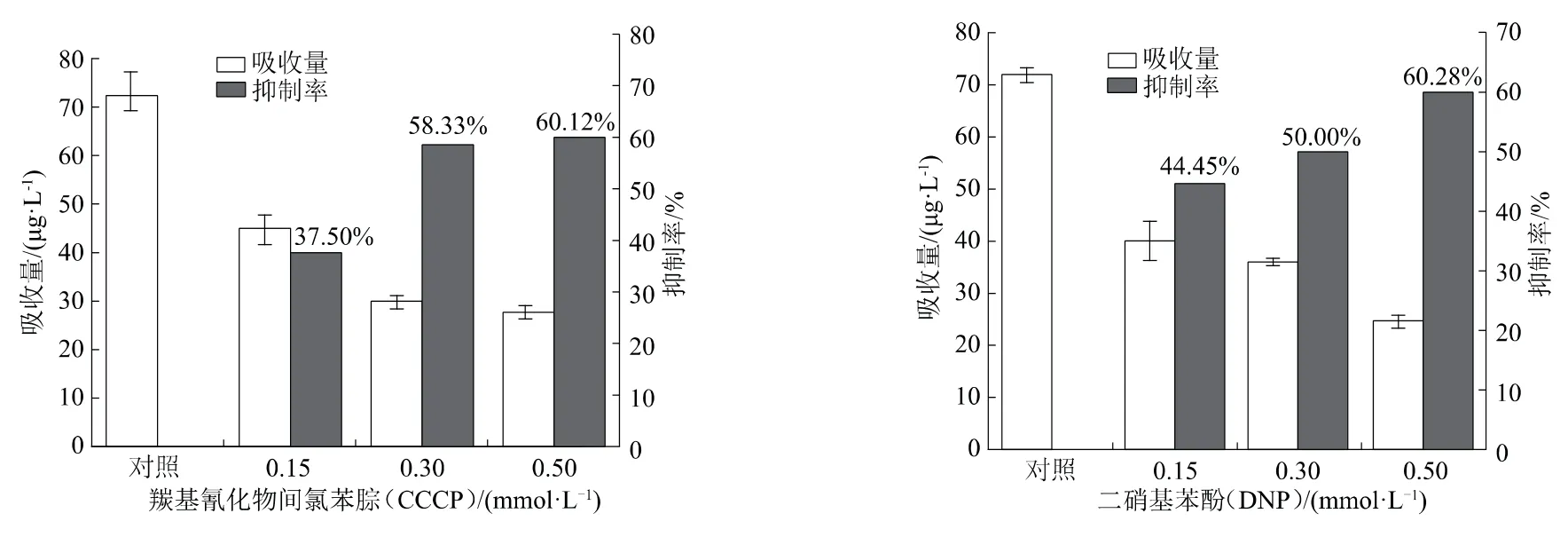
图5 能量抑制剂(CCCP、DNP)对番茄吸收春雷霉素的影响(P<0.01)
2.7 竞争性底物对番茄吸收春雷霉素的影响
D-葡萄糖进入植物体细胞,必须有载体蛋白才能完成运输。当药剂和D-葡萄糖同时存在时,药剂和D-葡萄糖同时竞争共用载体而影响药剂的吸收。由图6可知,加入D-葡萄糖后与空白对照相比,春雷霉素吸收量受到了明显的抑制作用,从72μg/L降低至60、46、25μg/L。随着D-葡萄糖配比量的升高,抑制效果增强,抑制率分别为16.67%、36.11%、65.28%。加入葡萄糖转运蛋白抑制剂根皮苷,春雷霉素吸收量也受到了显著的抑制效果,分别降低至50、35、30 μg/L,抑制率分别为30.56%、51.39%、58.33%。随着根皮苷浓度升高,抑制效果加强。上述结果表明,番茄对春雷霉素的吸收可能有单糖转运蛋白的参与。
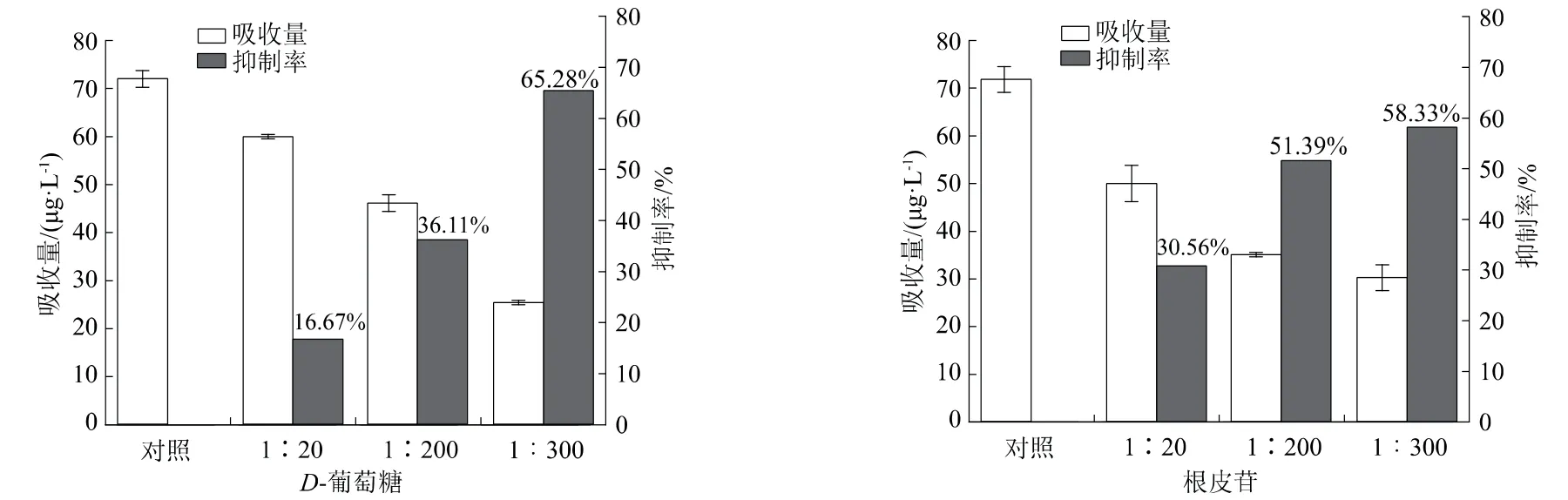
图6 竞争性底物(D-葡萄糖、根皮苷)对番茄吸收春雷霉素的影响(P<0.01)
3 结论与讨论
本研究采用浸根浸叶法,通过在番茄幼苗根部和特定叶位施药,分别研究了春雷霉素在番茄幼苗中的向顶和向基传导能力,以及番茄幼苗对春雷霉素的吸收机理。结果表明,春雷霉素具有较好的内吸性和传导能力,于番茄幼苗根部施药后,可被根部快速吸收并向地上部分传导,6 h后即可到达植株叶部;根部中春雷霉素含量在3~24 h内呈上升趋势,24~48 h内处于平衡状态。通过用药剂质量浓度分别为500、1 000、1 500 mg/L对幼苗中部叶片处理24 h后,上部叶片、茎部和根部均能检测到微量的春雷霉素,其中1 500 mg/L处理组在72 h后,春雷霉素在根部的累计含量可高达21.03μg/L,表明番茄叶片吸收药剂后,药剂能向根部输导。综合以上皆说明春雷霉素在番茄幼苗体内具有双向输导特性,即可以向上输导至顶部叶片,也可以向下运输至根部。
Michelet等[10]证明了植物质膜ATPase活性存在一个最适pH值,本试验中发现弱酸性和中性环境有利于番茄幼苗对春雷霉素的吸收,在pH为5时吸收量达到最大;在pH为9时吸收量最小。低温对春雷霉素的吸收有一定的抑制作用,与前人证明低温能抑制黄瓜对硅、小麦对菲主动吸收[11]的结果一致。4℃条件下的吸收量明显少于24℃条件下的吸收量,不同时间段的Q10值均大于2,表明番茄幼苗对春雷霉素的吸收属于主动吸收过程。DNP是一种能量抑制剂,CCCP是一种解偶联剂[12],二者可以作为判断植株对某种化合物的吸收是否需要能量的标志[13-15]。用CCCP、DNP处理后发现,春雷霉素吸收量受到显著抑制,高浓度处理组抑制率分别可达60.12%、60.28%。为进一步验证此吸收过程是否有载体蛋白参与,采用单糖转运蛋白竞争性底物D-葡萄糖和根皮苷进行处理,结果发现二者都对番茄幼苗吸收春雷霉素产生了抑制作用,与前人证明根皮苷、D-葡萄糖能抑制KPT2细胞对庆大霉素的吸收,且庆大霉素在动物细胞内的吸收是由钠-葡萄糖转运体SGLT2所介导的结果一致[16-17],由此表明春雷霉素的吸收可能受单糖转运蛋白介导。
综上所述,春雷霉素具有较好的内吸性,以及具有能同时向顶和向基运输的特性。其吸收受低温、能量抑制剂(CCCP、DNP)、pH、单糖转运蛋白竞争性底物等因素的影响,说明该药剂的内吸传导是由单糖转运蛋白介导的主动吸收的过程。所得研究结果有助于双向输导型药剂的开发,以及为指导春雷霉素田间科学合理用药提供理论依据。

