盐胁迫对桐花树生长及生理的响应
冯立辉,徐扬帆,陈文峰,刘剑彤,吴辰熙,胡红娟
(1.中交第二航务工程局有限公司,武汉 430040;2.中国科学院水生生物研究所,武汉 430072)
红树林是生长于热带、亚热带海岸和河口潮间带的木本植物群落,红树林湿地系统处于淡水和海水的交互地带[1]。而中国分布的种类多为桐花树、秋茄、白骨壤、木榄、海桑、无瓣海桑等[2,3]。桐花树(Aegiceras corniculata)属于紫金牛科,为泌盐型红树植物[4]。常见于红树林的外缘,其对盐适应性较强,在内滩、中滩、海湾港汊、淡水河口的淤泥和沙质盐土以及海水倒灌的淡水河两岸均有分布,尤其在淡水输入的河口、海湾较多[3]。桐花树群落在广东沿海分布最广,面积最大,分布于海滩前缘或咸淡水汇合河川出口的两岸。单一的桐花树林结构简单,只有一层,由于基部的分枝多,一般基部的直径达15 cm 左右,大者可达30 cm[4]。
目前,有关桐花树的研究适宜盐度范围大多较为广域[5],而在受不规则半日潮影响的广东广州珠江口内河地区[1],其内河区域的盐度变化尺度较小。针对这类区域桐花树的适宜生长盐度以及恢复建议研究报道较少,且大多为耐盐的机理研究[6],与实际结合较少。本研究通过研究盐胁迫桐花树的盐害程度,主要针对形态学和生理学指标变化,提出滨海湿地恢复建议,以期为沿海及盐碱化地区的湿地修复提供理论依据。
1 试验方法
1.1 试验设计
本试验选取的桐花树来自广州市南沙区某滨海湿地,试验在中国科学院水生生物研究所进行。在试验开始前,将选取的桐花树在室外培养2 周进行适应培养,之后选择无病虫害、发育良好、生长较为一致的桐花树试验。用塑料桶装20 cm 厚原土(来自桐花树取苗地),分别设置6 个不同盐度(0.5‰、1‰、1.5‰、3‰、6‰、9‰),每个桶内种植3~4 株植物。试验过程中适时补充去离子水,每天测定盐度并使桶内的盐度维持在设定的浓度。试验期间,每隔7 d 测定植物叶长等生长指标,每个处理随机选取3~4 片叶片用于生理指标的测定。
1.2 指标测定
植物生长指标有叶片长、宽增量,植株高度增量;生理指标有过氧化氢酶(Catalase,CAT)活性和丙二醛(Malondialdehyde,MDA)含量。其中,丙二醛含量采用硫代巴比妥酸法测定,过氧化氢酶活性采用钼酸铵比色法测定。每个样品各指标重复测定3次。
1.3 数据处理
使用SPSS 20.0 软件进行单因素ANOVA 和Tukey’s 检验(P<0.05),并对数据进行显著差异分析,采用Origin 8.0 软件绘图。
2 结果与分析
2.1 盐胁迫对桐花树幼苗形态的影响
2.1.1 盐胁迫对桐花树幼苗高度的影响 本试验所选取的桐花树幼苗,初始高度均为30 cm。每7 d 测定同一植株的高度,结果如图1 所示。在第7 天,盐度为0.5‰和1.5‰的处理中,生长较快(P<0.05),增量可达2 cm 以上;其余盐度的处理组,桐花树幼苗增量为0.8~1.6 cm。随着时间的推移,到第14 天,不同盐度处理生长显著(P<0.05),桐花树仍然是0.5‰和1.5‰盐度处理组增量最大,分别增加3.8 cm 和4.3 cm;其余组分别为2.8、2.8、3.2 cm。待第21 天时,盐度为0.5‰和1.5‰的处理组增量可达5.6 cm和5.5 cm;在盐度为3‰、6‰、9‰时,随盐度增加,植株增量也增加,最大可达到4.1 cm。第28 天时,盐度为0.5‰和1.5‰的植物组,增量均达到5.8 cm;其余组表现出同之前一样的规律,植株增量随盐度增加而增大,最大为盐度9‰ 时,植物增量为4.3 cm。

图1 不同盐度处理植株高度
2.1.2 盐胁迫对桐花树幼苗叶片的影响 每处理组选取固定叶片测定长、宽,叶片初始长1 cm,宽为0.5 cm。本试验中各阶段处理组(图2)中叶片的增量差异显著(P<0.05)。在第7 天除盐度为1.5‰的处理组外,叶片的增量随着盐度的增加而增加,在1.5‰的盐胁迫下增量最小仅为0.2 cm;其余组叶片增量最大可达2 cm。到第14 天,不同盐度处理的桐花树叶片生长变化较大(P<0.05),盐度为0.5‰的处理组,叶片的增量最大为5 cm;除1.5‰组植株增量较小,其余组总体表现为随盐度增加增量也增大,但增量均较低盐度0.5‰ 的试验组小,最大仅为3.6 cm。第21 天叶片的增量也表现出一致的规律。第28 天,盐度为0.5‰的试验组,叶片的增量最大为7 cm,其余处理组,最大仅为5.3 cm。

图2 不同盐度处理叶片长度
2.2 盐胁迫对桐花树幼苗生理的影响
2.2.1 盐胁迫对桐花树叶片过氧化氢酶的影响 不同盐度处理在培养7 d 后(图3),桐花树幼苗叶片的过氧化氢酶含量差异显著(P<0.05),其范围为19.25~27.67 μg/(g·min)。其中盐浓度越大,过氧化氢酶含量越高。随着时间推移,在培养第14 天时,桐花树幼苗对盐度反应也逐渐表现出来,到第21 天时,各处理组桐花树幼苗过氧化氢酶的含量均达到最大值,其中,1‰、1.5‰处理组的过氧化氢酶浓度均高于其他处理组,分别为249、532.5 μg/(g·min)。而到第28 天,不同处理组的过氧化氢酶的含量也逐步下降。整个试验过程中,各处理组桐花树幼苗叶片过氧化氢酶含量均表现出先上升后下降的趋势。

图3 不同盐度处理叶片过氧化氢酶含量
2.2.2 盐胁迫对桐花树叶片丙二醛的影响 在培养第7 天,桐花树幼苗叶片不同盐度处理组的丙二醛含量差异较大(P<0.05),范围为27.53~57.87 nmol/g。其中,低盐度处理组的丙二醛含量相对较高,盐度在0.5‰~3‰处理中丙二醛含量为50 nmol/g 左右,其中3‰的处理组最大,为57.87 nmol/g。随着盐度的增加,在6‰、9‰的处理组,丙二醛的含量分别为27.53、35.02 nmol/g。第14 天时,桐花树幼苗叶片丙二醛的含量均表现为下降趋势,最明显的是1.5‰处理组,降幅超过50%,丙二醛含量为25.02 nmol/g。而试验到第21 天时,所有处理组中桐花树幼苗叶片丙二醛含量与第14 天时含量变化不大。待试验进行到第28 天时,1‰、6‰处理组表现出上升趋势,且1‰处理组升幅近50%,含量为74.26 nmol/g。其余处理组表现为下降趋势,且不同处理组,叶片丙二醛含量范围为27.03~29.54 nmol/g。
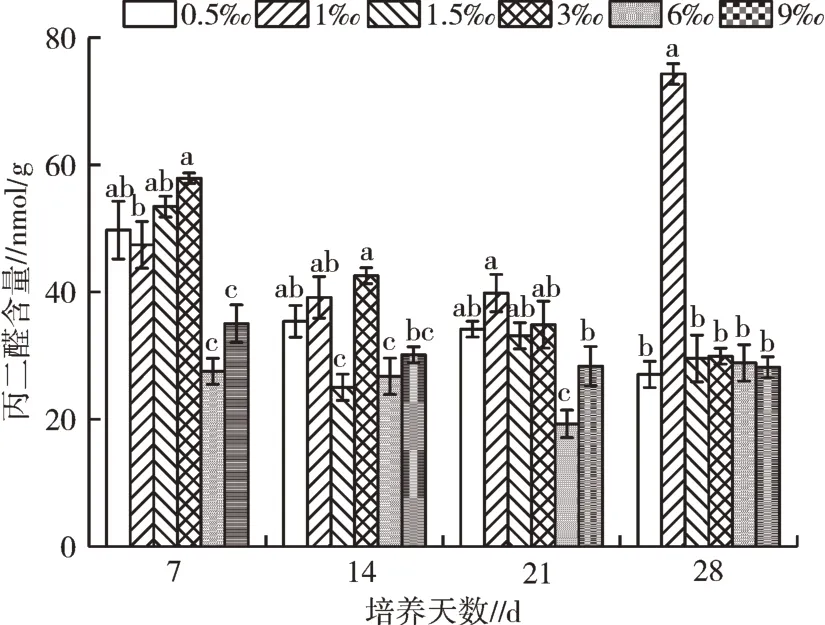
图4 不同盐度处理叶片丙二醛含量
3 小结与讨论
植物对盐胁迫的综合体现主要表现为植株生物量的变化,在不同的盐胁迫下,植物通过调节自身的生长和重新构建生物量分配等途径,来维持其在逆境下的生长[7]。本研究结果表明,随着时间的推移,在盐胁迫为0.5‰和1.5‰的桐花树幼苗植株的生长量明显高于3‰、6‰和9‰(P<0.05),并且盐度在0.5‰时,植株的叶片生长状况也优于其他处理组。这与李品芳等[8]的研究结果相似,即随着盐胁迫的增加,桐花树幼苗的生长速率明显减慢。这可能是在低浓度盐胁迫下,植物受到促进作用;随着盐胁迫的加强,其对植物的作用变为胁迫作用。在高浓度(9‰)盐胁迫处理下,植株仍能缓慢生长,说明桐花树植株在通过调节自身细胞膜的通透性和分泌渗透调节物质等生理响应来适应含盐度较高的水体,使其具有更强的耐盐能力[9]。
植物在逆境生长下会产生大量的活性氧,造成体内膜脂的过氧化,进而对植物细胞造成损害[10,11]物体内膜保护系统的关键酶类,如超氧化物歧化酶(SOD)、过氧化氢酶、过氧化物酶等能够清除体内过多的自由基(ROS),从而抑制膜脂的过氧化作用,以维持植物体内的动态平衡。在本研究中,在不同盐度处理下的桐花树幼苗体内过氧化氢酶的含量总体呈先上升后下降的趋势,且在低浓度(1‰、1.5‰)处理下过氧化氢酶的含量均高于高浓度处理组(3‰、6‰、9‰)(P<0.05)。这与对八棱海棠株、花生的研究结果相似[12]。这说明在盐胁迫下,为了清除植物体内过量的ROS,降低ROS 对细胞膜的伤害,桐花树的抗氧化能力均得到了增强,并且在高浓度盐胁迫下,桐花树幼苗体内保持了相对较高的CAT活性,可以更快地代谢ROS,缓解对胞膜脂的伤害。
丙二醛是膜脂过氧化作用的产物之一,它能与植物体内细胞膜上的酶类物质等反应使酶失去活性,进而破坏细胞膜的构造[13]。在本研究中桐花树叶片的丙二醛含量在3‰盐度时,总体趋势为随盐度增加而降低,而高于3‰呈先下降后上升的趋势。这说明在高浓度盐胁迫处理下,会加重细胞膜的过氧化反应,导致MDA 的含量增加。
桐花树作为一种泌盐红树植物,叶表皮可分化出了一种特殊的盐分泌结构(盐腺),使其可以将体内多余的盐分分泌到体外,以减少体内盐分;同时也可以通过调节光合色素合成速率,平衡碳氮代谢来适应盐胁迫[14],进而可以提高SOD 活性,降低MDA含量,减少活性氧的产生和膜脂过氧化反应的伤害,促进桐花树的正常生长[15]。

