用盐酸浸出—水解法从分银渣中分离锑铋铜
曾平生,梁 勇,杨 飞,刘 勇,刘 猛,刘德刚
(1.深圳市中金岭南有色金属股份有限公司 韶关冶炼厂,广东 韶关 512024;2.江西理工大学 材料冶金化学学部,江西 赣州 341000;3.广东省矿产应用研究所,广东 韶关 512026)
铅阳极泥中含有铜、铅、锑、铋、锡、银、砷、金等元素,还有少量硒、碲[1-3]。铅阳极泥经贵铅炉还原熔炼后得到贵铅,贵铅再经分银炉熔炼后得到含量较高的粗银和分银渣[4-6]。分银渣中富集了铜、铋、锑等有价金属,以及较多的银[7],因此,研究从分银渣中回收银、铜、锑、铋等有价金属意义重大。
分银渣传统处理方法主要是用硫酸浸出分离铜,得到的富银渣返回贵铅炉还原熔炼[8],该法仅能有效浸出铜,而不能浸出铋、锑、铅;从该分银渣中浸出铋,可用硫酸与盐酸的混合酸[7],该法能高效浸出铜、铋,但不能有效回收锑;用硫酸浸出铜、用盐酸浸出铋可将铜、铋有效回收,但银、锑均留在浸出渣中[9]。上述方法均无法有效回收分银渣中的铜、铋、锑、银等有价金属。试验研究用盐酸浸出分银渣中的铜、锑、铋,再分步水解分离浸出液中的锑、铋、铜,分别获得锑富集物、铋富集物、富铜溶液和富银渣,以期为分银渣的综合利用提供可选择的方法。
1 试验部分
1.1 试验原料
分银渣取自广东某铅冶炼厂,球磨至粒度-74 μm占90%以上,烘干,化学元素分析结果见表1、2,物相分析结果如图1所示。
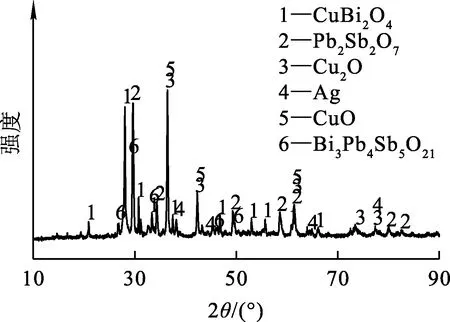
图1 分银渣的XRD图谱

表1 分银渣的化学组成 %

表2 分银渣中主要金属元素组成 %
试剂:盐酸、氢氧化钠等,均为分析纯。
1.2 试验原理与方法
1.2.1 试验原理
分银渣中含有CuBi2O4、Pb2Sb2O7、Cu2O、Ag、CuO和Bi3Pb4Sb5O21物相,其中部分单质银与其他物相形成连生体,更有部分呈滴状、丝状被包裹于赤铜矿中,要高效浸出银需使银充分暴露,故而需优先浸出铜、锑、铋,使银与这3种贱金属分离。Cu2O、CuO易溶于盐酸,且在Cl-H2O体系中,锑、铋水解的适宜pH分别在0.5~1.4和1.5~2.5范围内[10],而铜在该pH范围内不水解,可通过调节溶液pH分步沉淀溶液中的锑、铋。因此,从分银渣中分离铜、锑、铋、银有价金属分两步进行,先用盐酸浸出铜、锑、铋,然后调节浸出液pH水解沉淀锑和铋,使其与铜分离。
1)盐酸浸出。分银渣中的Cu2O与HCl反应生成CuCl,CuCl不溶于水但溶于浓盐酸。盐酸浓度较低时,CuCl溶解率较低;盐酸浓度较高时,CuCl溶解率显著增大。浸出反应如下:
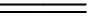
(1)
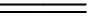
(2)
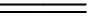
(3)

(4)
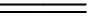
2SbCl5+7H2O。
(5)
2)富锑铋铜溶液分步水解。SbCl3首先水解生成氯氧锑(SbOCl或Sb4O5Cl2),并随水解进行氯氧锑逐渐转化为H3SbO4[11];SbCl5水解时生成SbO2Cl,当加热时可进一步水解成H3SbO4[12-13];BiCl3水解生成BiOCl[14]。水解反应如下:
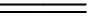
(6)
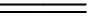
(7)
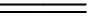
(8)
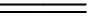
(9)
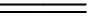
(10)
分银渣分步回收锑、铋、铜工艺流程如图2所示。
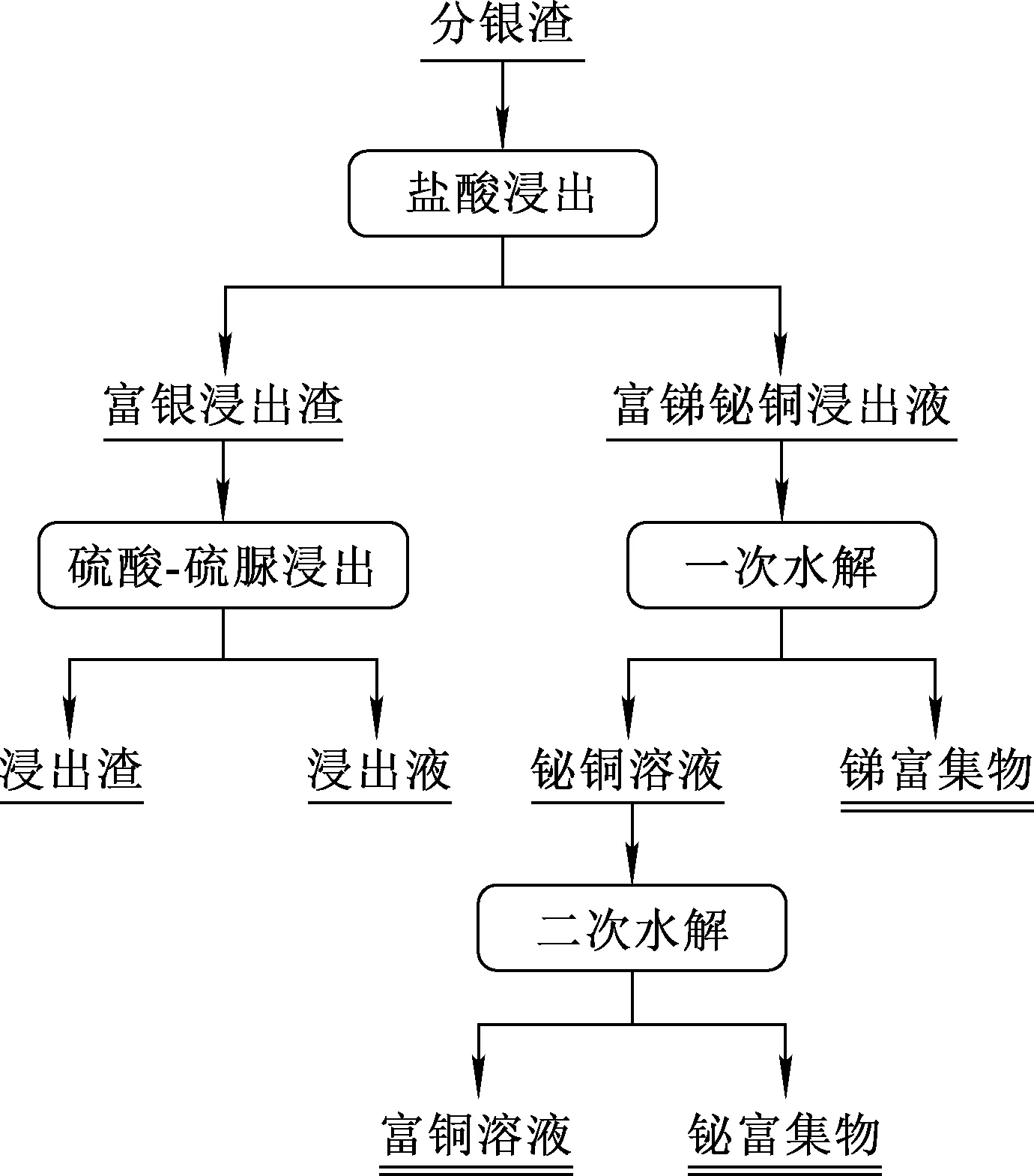
图2 分银渣分步回收锑、铋、铜的工艺流程
1.2.2 试验方法
浸出:称取分银渣20.00 g倒入圆底烧杯中,按比例加入一定量浓盐酸和去离子水,搅拌均匀;再将圆底烧杯置于恒温水浴锅中加热浸出;浸出结束后,过滤,得浸出液、浸出渣,分别测定铜、铋、锑含量。
水解:对上一步浸出液分步进行水解,浸出液中铜、锑、铋质量浓度分别为50.26、11.48和50.26 g/L,残酸浓度较高。一次水解:取200 mL浸出液,加入一定量氢氧化钠饱和溶液,搅拌均匀,同时测定pH;待pH达到设定值后陈化4.0 h,然后过滤,并用相同pH的盐酸溶液洗涤氯氧锑沉淀物;取沉淀母液测定锑、铋含量。
二次水解:取200 mL一次沉淀后溶液(含铋铜溶液)于烧杯中,加入氢氧化钠饱和溶液,搅拌均匀,并测定pH;待pH达到设定值后陈化4.0 h,然后过滤,并用相同pH的盐酸溶液洗涤BiOCl沉淀物,取沉淀母液测定铋质量浓度。分别计算锑、铋水解沉淀率。
2 试验结果与讨论
2.1 盐酸浸出锑、铋、铜
2.1.1 盐酸浓度对锑、铋、铜浸出率的影响
液固体积质量比6/1,温度80 ℃,浸出时间1.5 h,搅拌速度350 r/min,盐酸浓度对锑、铋、铜浸出率的影响试验结果如图3所示。
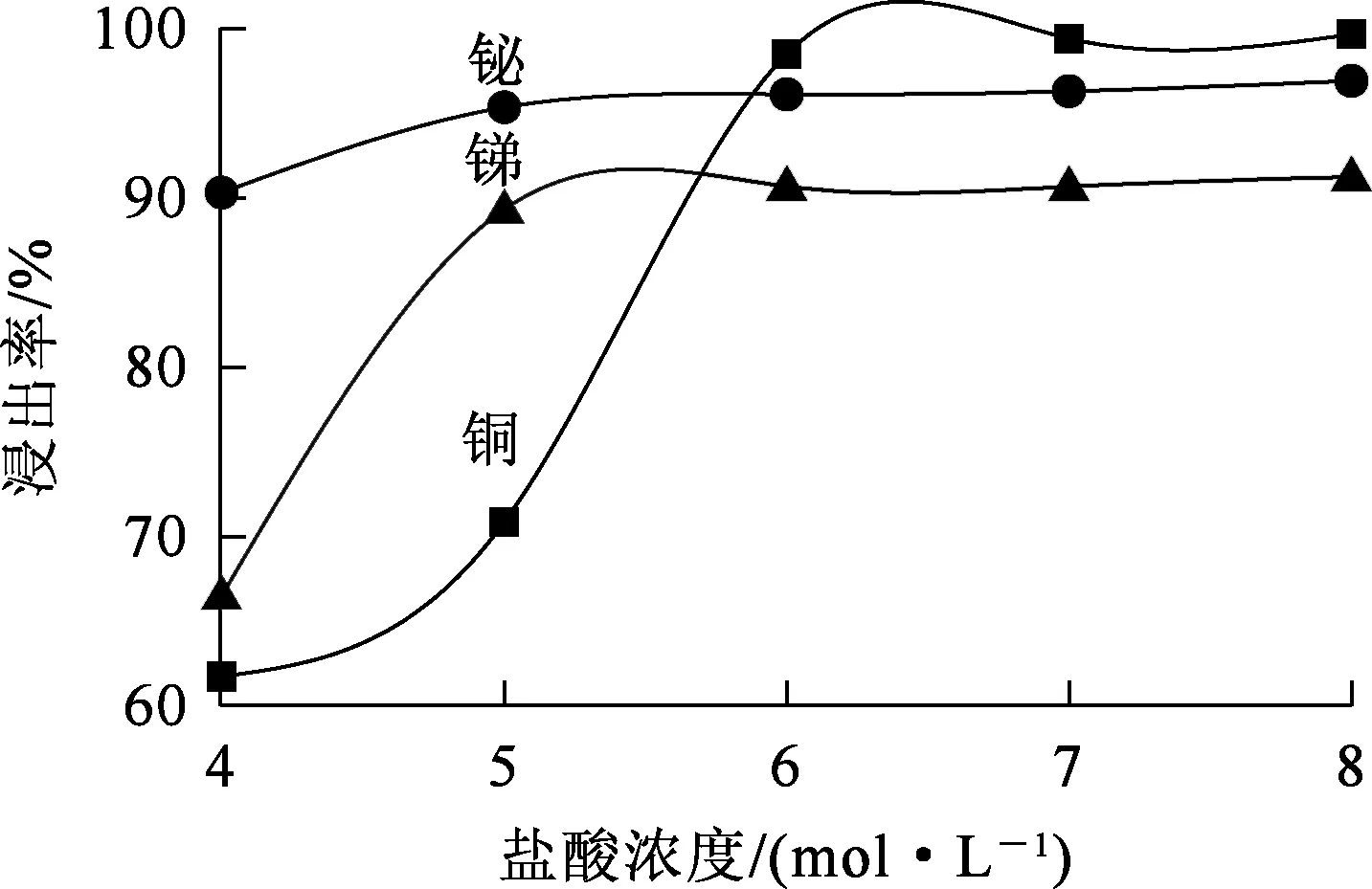
图3 盐酸浓度对锑、铋、铜浸出率的影响
由图3看出,锑、铋、铜浸出率均都随盐酸浓度升高而升高,后趋于平缓:盐酸浓度升高至6 mol/L时,铜、锑、铋浸出率分别达98.51%、90.68%和96.11%;再进一步升高盐酸浓度,锑、铋、铜浸出率变化不大。铜在分银渣中的物相以Cu2O为主,Cu2O与HCl反应生成的CuCl不溶于水但溶于浓盐酸。盐酸浓度较低时,CuCl溶解率较低,随盐酸浓度升高,CuCl溶解率显著增大。综合考虑,确定浸出时盐酸浓度以6 mol/L为宜。
2.1.2 液固体积质量比对锑、铋、铜浸出率的影响
盐酸浓度6 mol/L,温度80 ℃,浸出时间1.5 h,搅拌速度350 r/min,液固体积质量比对锑、铋、铜浸出率的影响试验结果如图4所示。
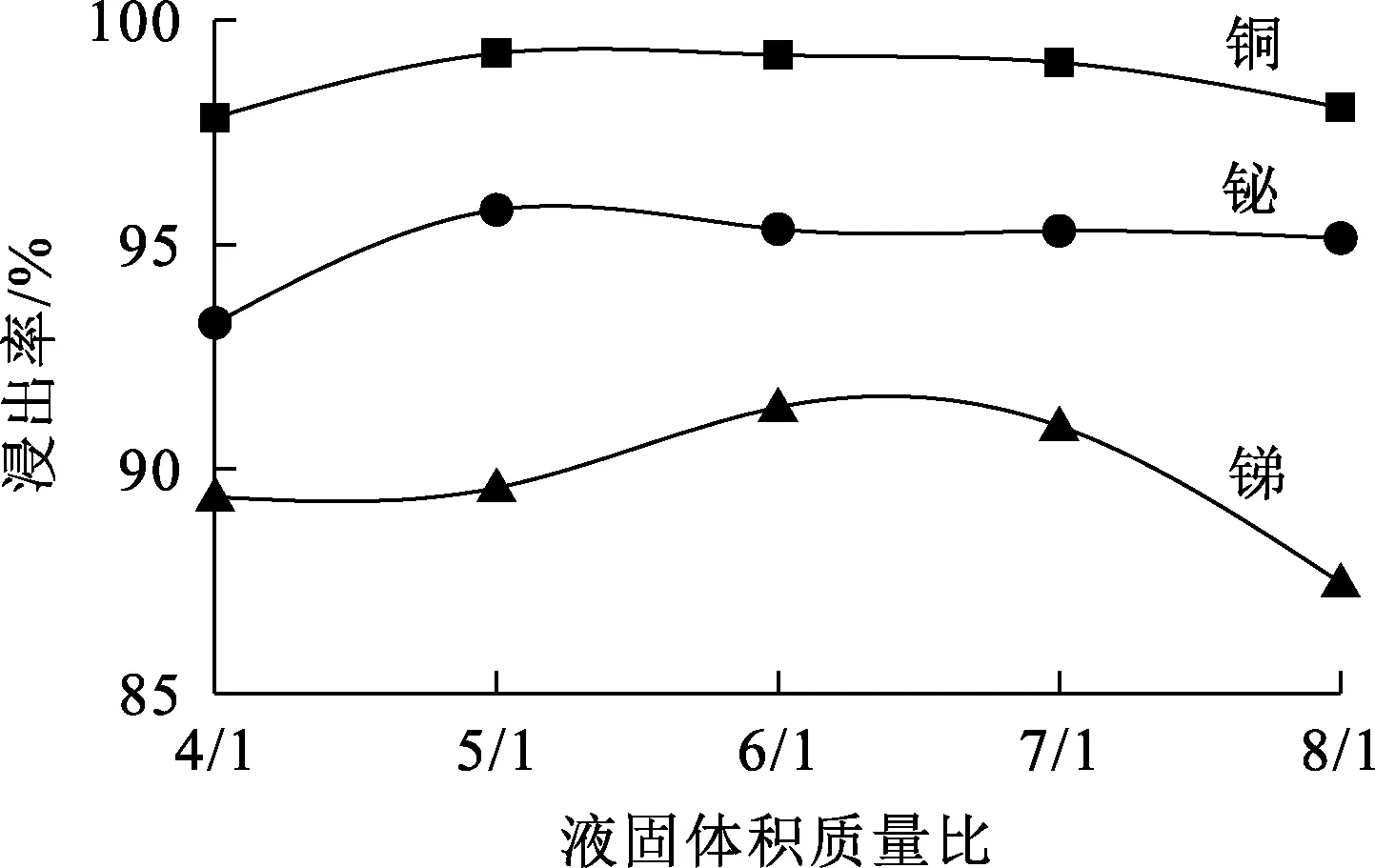
图4 液固体积质量比对锑、铋、铜浸出率的影响
由图4看出,随液固体积质量比增大,铋、铜浸出率变化不大,锑浸出率呈先升高后降低趋势:液固体积质量比增至6/1时,铜、铋浸出率分别为99.22%和95.34%,而锑浸出率达最大,为91.37%;进一步增大液固体积质量比,铜、铋浸出率略有降低,锑浸出率下降明显。综合考虑,确定液固体积质量比以6/1为宜。
2.1.3 温度对锑、铋、铜浸出率的影响
盐酸浓度6 mol/L,液固体积质量比6/1,浸出时间1.5 h,搅拌速度350 r/min,温度对锑、铋、铜浸出率的影响试验结果如图5所示。
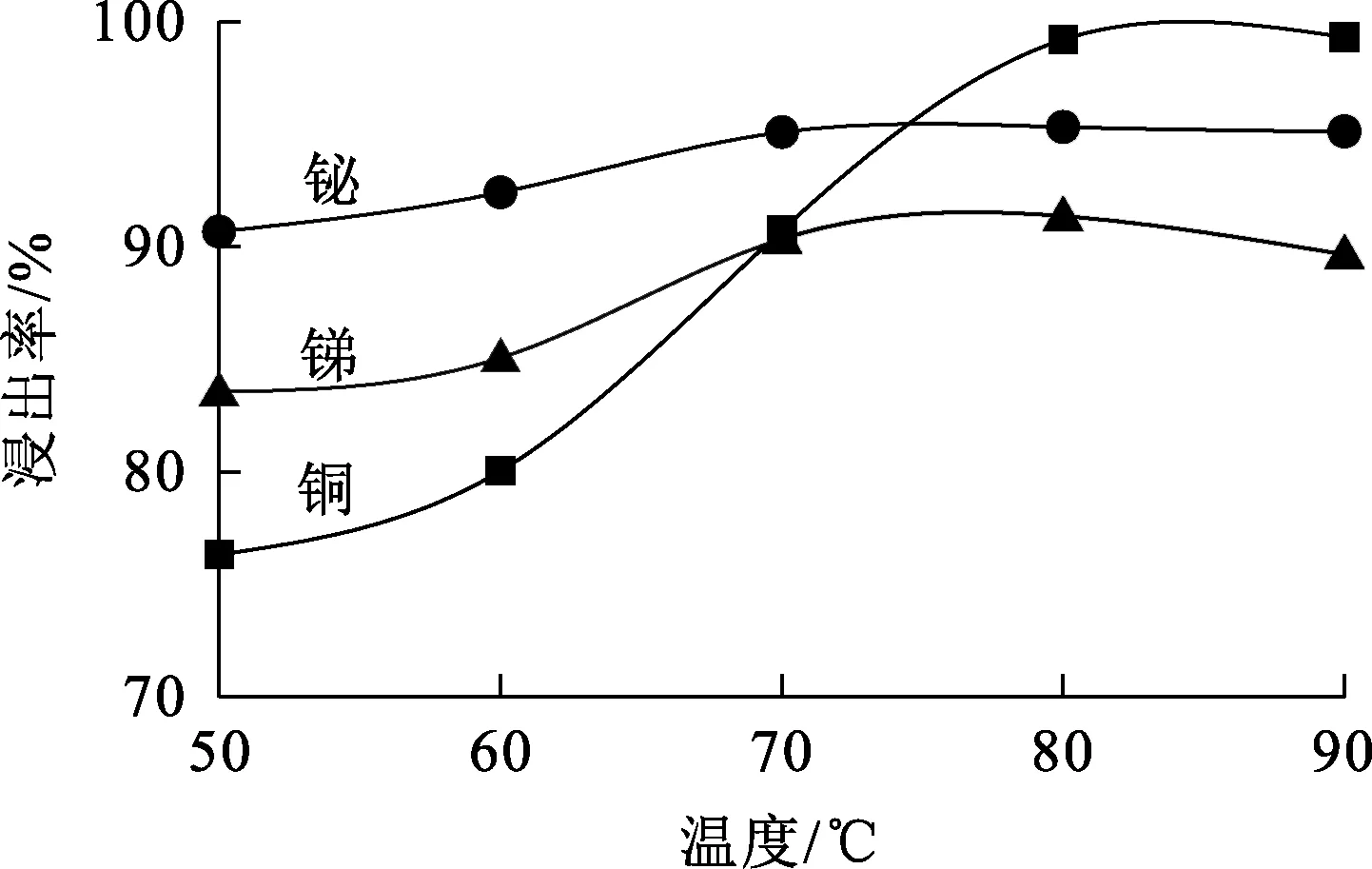
图5 温度对锑、铋、铜浸出率的影响
由图5看出:随温度升高,铜、锑、铋浸出率均先升高后趋于平缓,铜浸出率变化更大;温度为80 ℃时,铜、锑、铋浸出率均达最大,分别为99.22%、91.37%和95.34%;温度进一步升高,铜、锑、铋浸出率均无明显变化。综合考虑,浸出时温度以80 ℃为宜。
2.1.4 浸出时间对锑、铋、铜浸出率的影响
盐酸浓度6 mol/L,液固体积质量比6/1,温度80 ℃,搅拌速度350 r/min,浸出时间对锑、铋、铜浸出率的影响试验结果如图6所示。
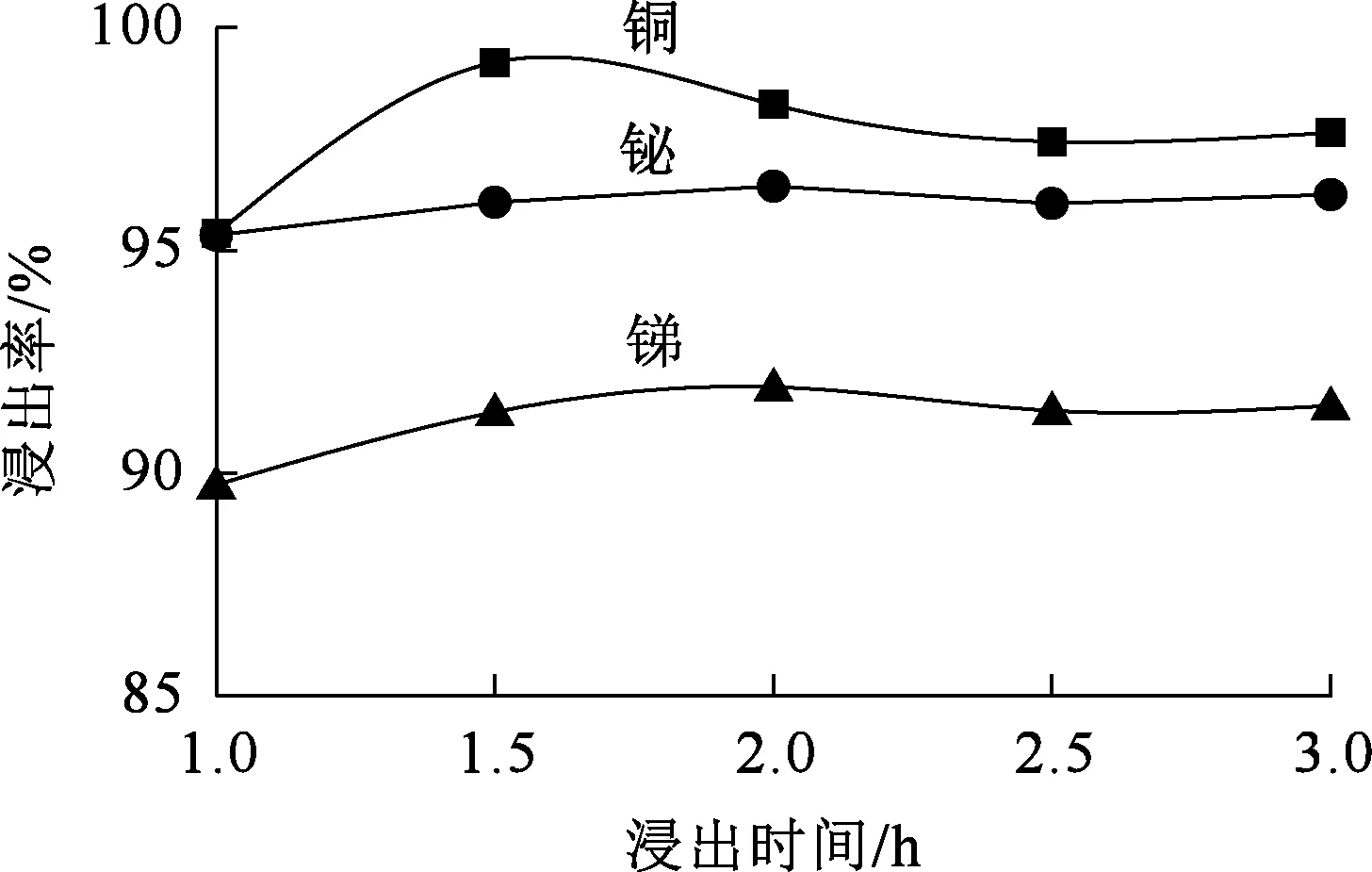
图6 浸出时间对锑、铋、铜浸出率的影响
由图5看出,随浸出时间延长,铜浸出率先升高后略降低,锑、铋浸出率变化不大:浸出1.5 h时,铜浸出率达最大,为99.22%;之后继续浸出,铜浸出率有所下降。综合考虑,确定浸出时间以2.0 h为宜。
2.1.5 浸出渣的物相分析
盐酸浸出前、后分银渣的XRD分析结果如图7所示。
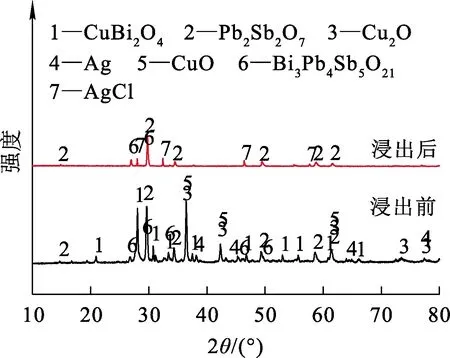
图7 盐酸浸出前、后分银渣的XRD分析结果
由图7看出:分银渣经盐酸浸出后,物相主要有Pb2Sb2O7、Bi3Pb4Sb5O21及AgCl;与浸出前相比,CuBi2O4、Cu2O、CuO、Ag的衍射峰消失,Pb2Sb2O7衍射峰明显变小,出现了AgCl衍射峰,表明Pb2Sb2O7大部分被溶解,CuBi2O4、Cu2O、CuO、Ag完全溶解,Ag与盐酸反应生成了AgCl沉淀。
2.2 富铜锑铋浸出液的分步水解
2.2.1 锑的水解分离
在温度25 ℃、陈化时间4.0 h条件下,溶液pH对锑、铋水解沉淀率的影响试验结果如图8所示。
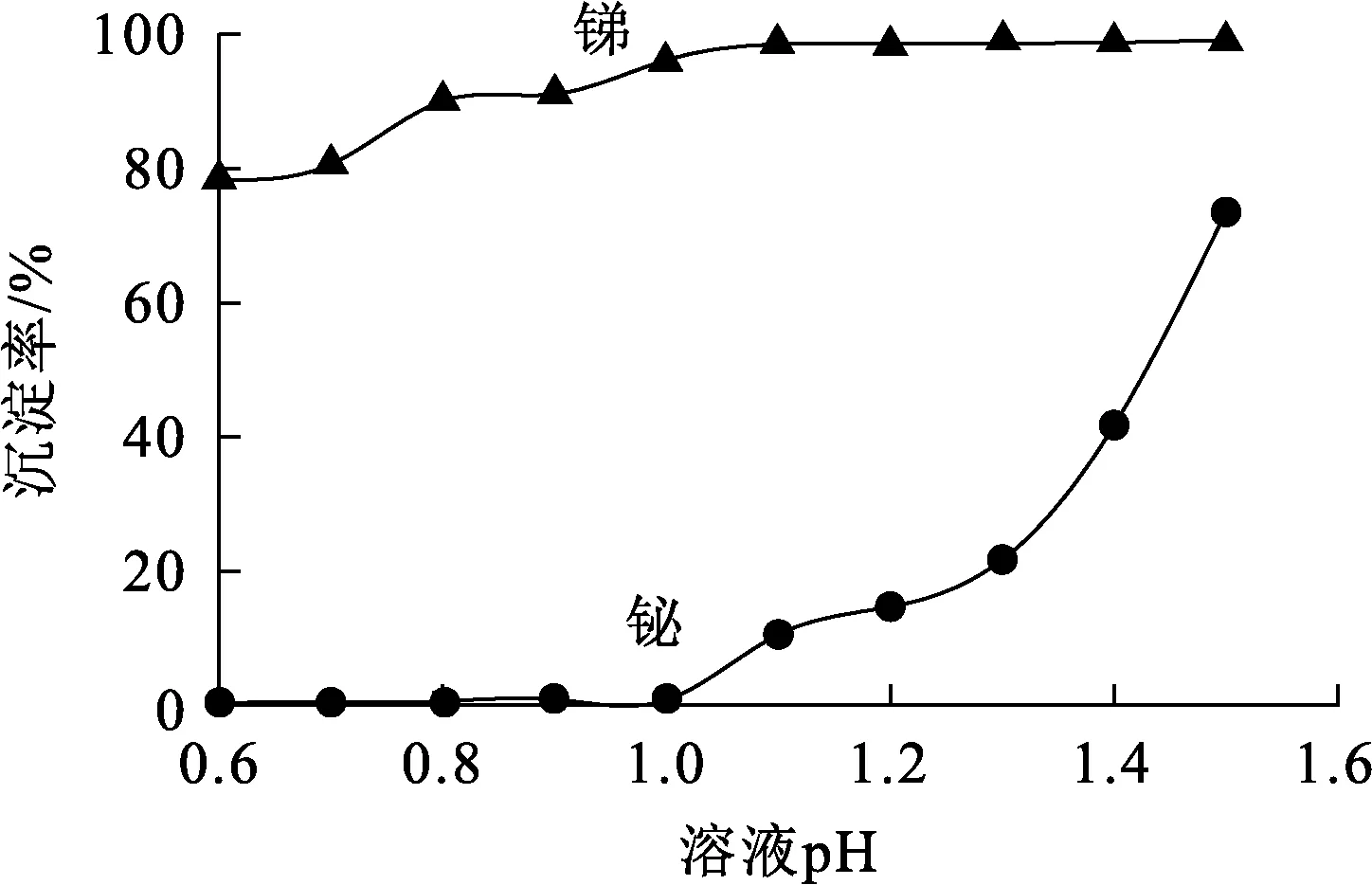
图8 溶液pH对锑、铋水解沉淀率的影响
由图8看出:溶液pH在0.6~1.0范围内,随pH增大,铋水解沉淀率很低,而锑水解沉淀率升高,在pH=1.0时,升至96.21%;溶液pH在1.1~1.5范围内,随pH增大,铋水解沉淀率显著升高,而锑水解沉淀率变化不大。综合考虑,确定锑水解分离适宜pH为1.0,此时,锑与铋可较好分离,得到锑质量分数为58.48%的锑富集物。
2.2.2 铋的水解分离
水解锑之后,体系中继续添加氢氧化钠溶液调高溶液pH水解沉淀铋,试验结果如图9所示。
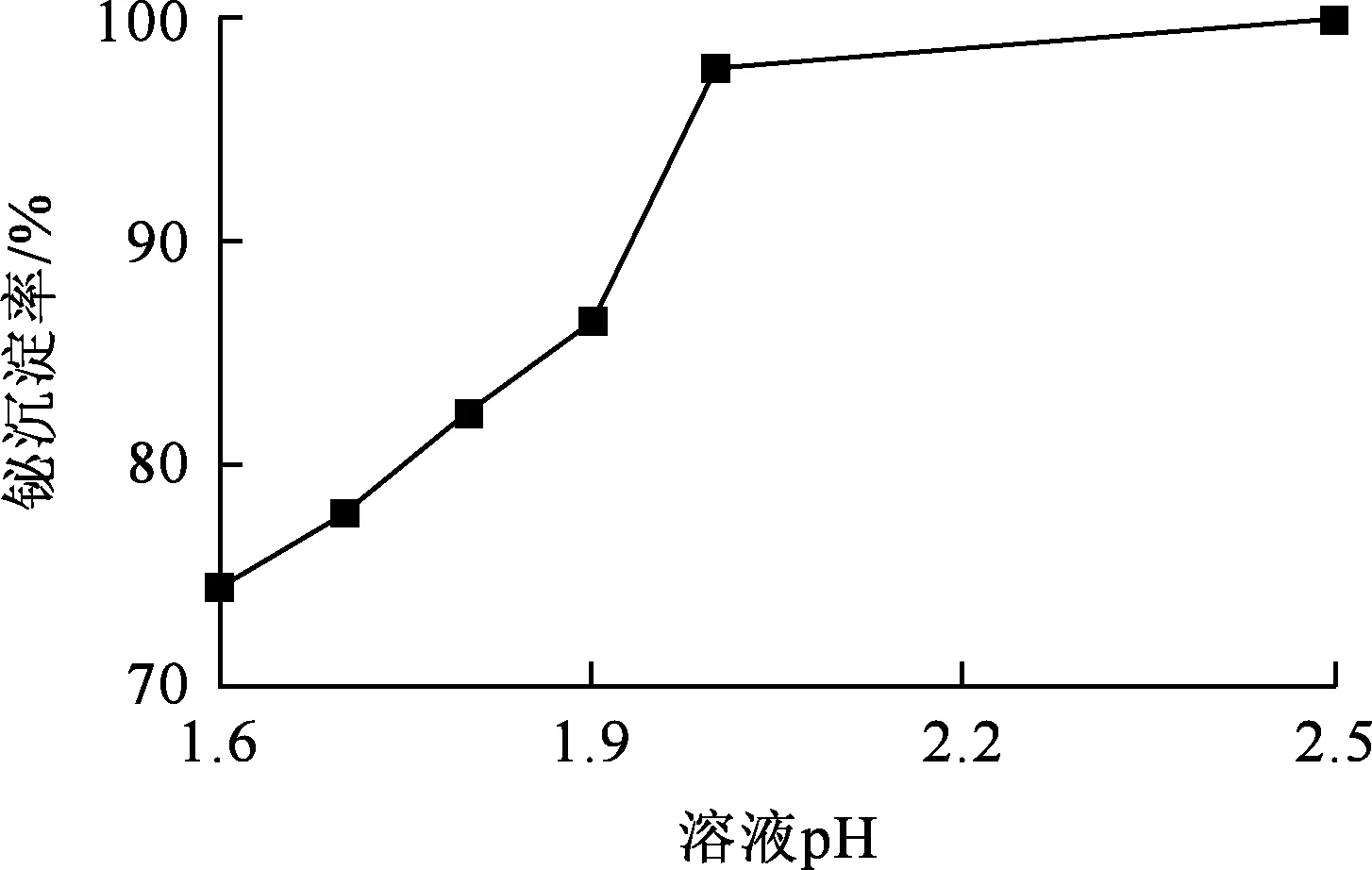
图9 溶液pH对铋水解沉淀率的影响
由图9看出:铋水解沉淀率随溶液pH增大而明显升高,pH增至2.5时,铋沉淀率高达99.96%。此条件下,可得到铋质量分数为54.78%的铋富集物和富铜溶液。
3 结论
采用盐酸浸出—浸出液水解分步沉淀工艺可从分银渣中分离锑、铋和铜。适宜条件下,铜、锑、铋浸出率分别为98.27%、91.93%和96.44%,Ag与HCl反应生成AgCl沉淀进入浸出渣中。对于浸出液,调pH=1.0、陈化4.0 h,96.21%的锑先水解沉淀,得到锑富集物;再调pH=2.5,陈化4.0 h,99.96%的铋水解沉淀,得到铋富集物;铜仍然留在浸出液中。铜、锑、铋可实现有效分离。

