土壤改良基质对土壤性状及微生物群落的影响
吴昊,欧阳俊峰,宋时丽,陆晓林,张振华,管永祥,张勇,戴传超*
(1.南京师范大学生命科学学院,江苏省微生物资源产业化工程技术研究中心,江苏省微生物与功能基因组学重点实验室,南京 210023;2.江苏省农业科学院资源与环境研究所,南京 210014;3.江苏省农业技术推广总站,南京 210036;4.江苏省句容蓝天碧水生物科技有限公司,江苏 句容 212402)
土壤有机质和微生物与作物产量及土壤质量关系密切[1]。随着人口数量的增加和生活水平的提高,粮食需求量也日益增长,尤其是在粮食低产和中产地区这种矛盾尤为突出。我国人均耕地有限,大多数地区的耕地贫瘠且产量较低[2]。因此提高耕地产量以满足食物需求对我国具有重要意义。
各类有机添加物(如豆科植物、粪肥和有机肥等)被用于农业生产以提高耕地产量[3-6],但这些有机添加剂对提升土壤肥力的效果有限。例如:种植豆科作物改良土壤时,需要很长时间来供植物吸收固氮,因此对土壤质量的改良见效较慢[7];植物残体和粪肥的使用有引入病原菌和提高土壤重金属含量的风险[3-4,8-9]。此外,商业化有机改良剂的生产还受到原料来源和成本的限制。因此,寻找可以快速培肥且成本低廉的土壤改良剂成为了一个重要的研究领域。
秸秆作为一种重要的农业废弃物,直接还田会伴随病原菌的侵染和对养分的争夺[10]。因此,本研究使用发酵和分解的秸秆作为土壤改良剂,即土壤改良培肥基质(SM)。基质的有机质含量超过55%,活菌数超过2×108cfu·g-1,原料廉价易得,密度低且便于运输。
为验证该基质对土壤酶、土壤微生物和作物产量的影响,本课题组在我国小麦-玉米的典型低产区进行了不同施用量的田间试验。研究分析了基质对土壤理化性质和生物学性质的影响,土壤性质对土壤微生物群落和多样性的影响,以及不同投入量的基质对小麦产量的影响。
1 材料与方法
1.1 试验地点与试验设计
试验区位于中国江苏省滨海县黄河湾农场(34°08'N,119°53'E),农场每年实行小麦-玉米轮作制。该地属温带季风气候,年平均气温14.1 ℃,年平均降水量949.5 mm。土壤类型为潮土,有机质含量为6.55 g·kg-1,全氮含量为0.55 g·kg-1,有效氮含量为8.67 mg·kg-1,有效磷含量为8.47 mg·kg-1,有效钾含量为65.54 mg·kg-1,容重为1.35 g·cm-3,pH 值为8.50(土水比为1∶2.5)。
田间试验设置5 个处理:(1)化肥(CK,无土壤改良基质);(2)3 000 kg·hm-2的土壤改良基质(SM1);(3)6 000 kg·hm-2的土壤改良基质(SM2);(4)9 000 kg·hm-2的土壤改良基质(SM3);(5)12 000 kg·hm-2的土壤改良基质(SM4)。所有处理的化肥用量与CK 相同。土壤改良基质理化性质见表1。5 个处理的总N、总P和总K含量见表2。

表1 土壤改良基质的物理和化学指标Table 1 Physical and chemical indexes of the soil amended substrate medium
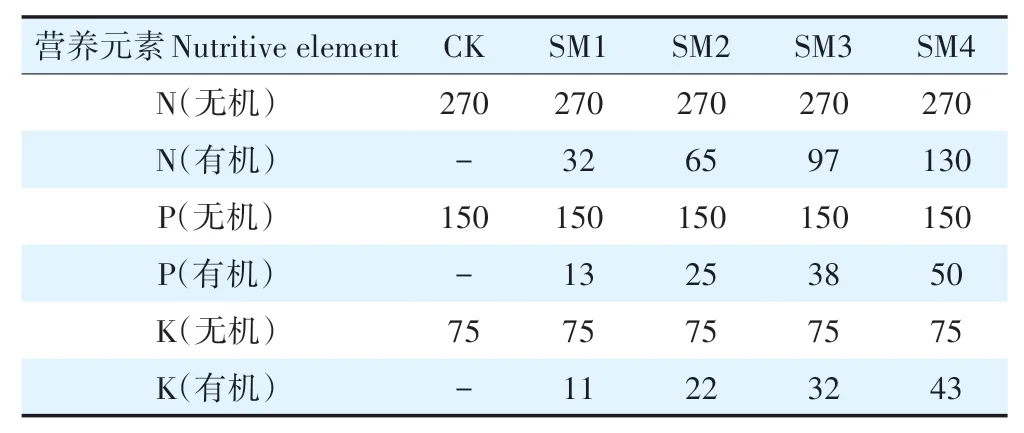
表2 对照和不同处理的营养成分(kg·hm-2)Table 2 Nutrient contents of the applied chemical fertilizer and soil amended substrate medium(kg·hm-2)
每个试验区均为15 m×10 m,每种处理3个重复,共15 个试验裂区,各裂区采用完全随机分配。按当地耕作习惯,在上季作物收获后,将残留秸秆粉碎还田。土壤改良基质于2017年7月,小麦种植前作基肥施用,小麦于2017 年10 月30 日种植。在小麦生长期内,各处理均有养分含量共计270 kg·hm-2N、150 kg·hm-2P2O5和75 kg·hm-2K2O的化肥施用到田间。本课题组开发的土壤改良培肥基质使用水稻秸秆和小麦秸秆作为原材料,秸秆干燥后湿度控制在65%以下作为堆肥材料,堆肥过程中加入枯草芽孢杆菌和黑曲霉促进发酵(成品中均能检测到两种微生物的存在)。每堆堆肥的原材料重达3 t,长、宽、高分别为18、1.5、1.5 m。根据堆体温度的变化,每10~15 d 翻堆一次,加入硅镁土促进黏合和成型。该基质完全由本课题组研发,并由句容蓝天碧水生物科技有限公司商业化生产。
1.2 样品采集
在2017 年10 月小麦种植前(S0)、2018 年3 月小麦返青期(S1)、2018 年4 月小麦拔节期(S2)和2018年6 月小麦成熟期(S3)采集土壤样本,Zadoks 编号分别为z00、z24、z37和z92[11]。在每个样地中随机采集5个直径38 mm、深度5~15 cm的土芯,同一地块的土壤混合成一个样本。将采集的新鲜土壤样品分为两个子样本,一个子样本储存在-20 ℃用于DNA 提取,另一个子样本立即分析土壤性质和土壤酶活性。
在每个地块对角线位置设置3 个等距采样点用于成熟期植物样品采集,每个采样点1 m2且距离地块边缘至少2 m。收获采样点内所有的小麦并记录穗数。小麦烘干后取20 株穗用于谷粒计数,计算每株穗的平均谷粒数和每1 000粒谷粒的质量。作物产量(kg·hm-2)=每平方米穗数×每穗平均谷粒数×每1 000粒谷粒质量(g)/100。
1.3 土壤物理、化学和生物分析
制备土水比为1∶2.5(m/V)的干土悬浮液,测定土壤pH值。采用1∶5(m/V)的土壤水混合物测定土壤电导率(EC)。采用重铬酸钾氧化法测定土壤有机质(SOM)。采用凯氏定氮法测定全氮(TN)。采用NaHCO3萃取-钼蓝比色法测定有效磷(AP)。采用醋酸铵浸提-火焰光度法测定有效钾(AK)。采用碱扩散法测定有效氮(AN)。体积密度(BD)由给定体积土壤的质量计算。根据《土壤农化分析》[12]对上述土壤性质进行分析。采用氯仿熏蒸提取法测定微生物生物量碳(MBC)和微生物生物量氮(MBN)[13-14]。
土壤中转化酶和纤维素酶的活性用3,5-二硝基水杨酸比色法测定[15-16],脲酶的活性用吲哚酚比色法测定[15]。
1.4 细菌和真菌群落的定量分析
采用Step1 实时荧光定量PCR 系统对试验前、小麦拔节期和小麦成熟期土壤中的细菌和真菌进行定量分析。根据CÉBRON 等[17]的方法,采用SYBRGreen 实 时PCR 法,测定 土壤总DNA 中16S rDNA 和18S rDNA 的拷贝数。将枯草芽孢杆菌16S rDNA 和杂色曲霉18S rDNA 插入p-easy blunt 载体中,将连接产物转化入DH5α。16S rDNA 通用引物为338f/518r,18S rDNA 通用引物为Fung5F/FF390R[18]。筛选Amp+平板进行阳性克隆转化和测序。提取质粒作为定量分析的标准。用10 倍梯度稀释质粒获得定量标准曲线,用于SYBR-Green 实时PCR 扩增。用无菌水代替模板DNA 作为阴性对照。通过与标准曲线比较,计算每个样本的Ct值,获得拷贝数。
1.5 变性梯度凝胶电泳(DGGE)分析
用PCR-DGGE法对各处理成熟期土壤的16S rDNA和18S rDNA 片段进行细菌和真菌的扩增。使用的引物为357F-GC/517R 和NS1/GC-Fung[19]。扩增反应重复3 次,PCR 产物经1%EB 琼脂糖凝胶电泳验证。用定量软件分析DGGE上观察到的条带。
1.6 统计分析
采用SPSS 20.0 统计软件对同一时期不同处理或同一处理不同时期下的产量、土壤性质和土壤微生物群落进行统计分析,采用Duncan 法进行多重比较。基于DGGE 谱带,利用软件计算Shannon 多样性指数(H)、均匀度指数(E)和Chao-1 指数。利用Gelcompar Ⅱ软件包对DGGE 谱带进行识别和聚类。利用Canoco 5 软件进行典型相关分析(CCA),揭示土壤性状与细菌和真菌群落组成的关系。
2 结果与分析
2.1 土壤特性和作物产量的变化
在本季试验之后,各试验裂区的SOM 含量总体随着土壤中加入土壤改良培肥基质含量的增加而增加(表3)。SM3 和SM4 处理各时期SOM 含量均显著高于CK(P<0.05)。在小麦拔节期,SM4 的平均SOM含量比CK 高出79.1%(表3)。TN 含量在基质处理与CK间无显著差异,然而基质处理的各阶段AN含量均低于CK,且4 个基质处理之间AN 含量均无显著差异。在小麦整个生育期内,AP 含量随着生长期的变化呈现先升高后降低的趋势,AP 含量在返青期达到最高,在成熟期降低至与播种前同一水平。在整个生育期,所有基质处理的AK 水平都高于CK。土壤EC值在基质处理与CK 间差异显著(表3),4个基质处理的EC值均显著低于CK,特别是拔节期和成熟期。
MBC 和MBN 在拔节期含量较高,在成熟期时略有下降(表3)。在各个时期处理组的MBC 和MBN 均高于CK,MBC 含量随着基质用量的增加而增加,且SM4处理显著高于CK。MBN在返青期和拔节期均是基质处理显著高于CK,然而在成熟期各处理与CK间差异减弱,没有达到显著水平。

表3 小麦生长期内土壤理化性质Table 3 Soil physicochemical properties of wheat
土壤改良培肥基质处理的小麦产量高于CK(表4)。SM4 处理的小麦产量最高,是CK 的1.32 倍。而SM2 处理的小麦产量低于SM1,这可能是由田间地形、水文等因素造成的。
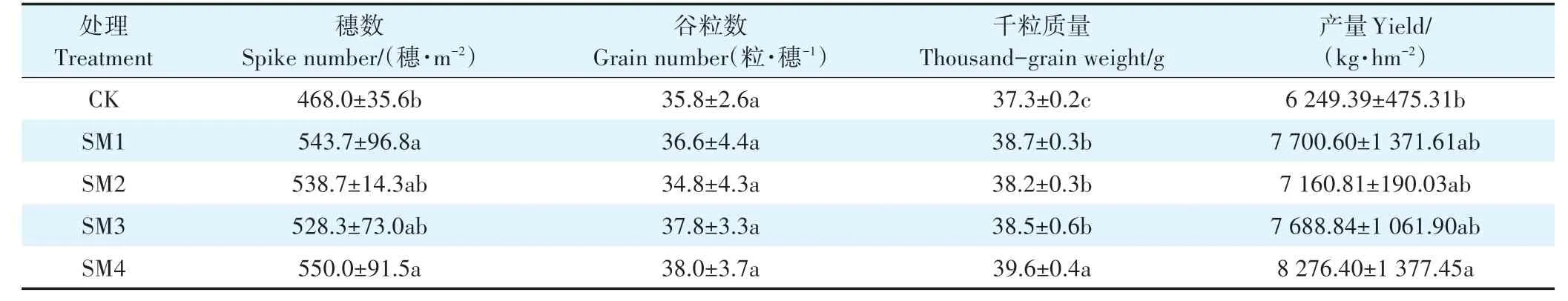
表4 小麦产量Table 4 The yield of wheat
2.2 土壤酶活性的变化
在各个处理中,蔗糖酶活性在不同时期间存在差异。总体而言,同一处理的土壤蔗糖酶活性呈现先增加(拔节期)后减少(成熟期)的趋势(图1a)。在同一阶段,不同基质处理的蔗糖酶活性均显著高于CK,且在拔节期这种差异最为显著,拔节期SM4处理的蔗糖酶活性最高,比CK 高60.4%。总体而言,在返青期与拔节期,蔗糖酶活性的变化趋势与基质的用量呈正相关,而在成熟期基质增加对蔗糖酶活性没有产生显著影响。
在返青期,SM2~SM4 处理的脲酶活性显著增加(图1b)。拔节期各处理的脲酶活性均较高,可能与期间追肥有关,其中SM3 和SM4 处理的脲酶活性显著高于CK。在成熟期,不同基质施加量处理的脲酶活性无显著差异。
同一处理的土壤纤维素酶活性在3 个生长阶段逐渐增加(图1c)。在3个生长阶段中,成熟期基质处理组的纤维素酶活均显著高于CK,其中SM4 处理的纤维素酶活最高,比CK高出65.1%。

图1 土壤蔗糖酶、脲酶和纤维素酶的活性Figure 1 The activities of invertase,urease and cellulase
2.3 土壤微生物群落丰度及多样性
土壤中细菌和真菌的丰度随着土壤改良培肥基质施用量的增加而显著增加(表5)。小麦拔节期,SM4 处理的真菌丰度最大,是CK 的15.8 倍。在成熟期,各处理真菌丰度均下降,但除SM1外,其余处理仍显著高于CK。总体而言,土壤细菌丰度是随基质的增加而增加,各处理组中细菌丰度在拔节期的SM3处理中达到最高,是CK的7.8倍(表5)。

表5 土壤细菌和真菌丰度Table 5 The abundance of bacteria and fungi in soil
与细菌DGGE 指纹图谱(图2a)相比,真菌DGGE指纹图谱(图3a)在小麦成熟期不同处理之间显示出更大的差异性。主成分分析结果显示,各处理间真菌微生物群落分区明显(图3b)。与CK 和SM1 处理相比,SM3和SM4处理的土壤真菌群落有显著差异。细菌DGGE 图谱检测到的条带数比真菌的更多,但是各个处理在主成分分析结果中区分不明显。

图2 小麦成熟期不同处理细菌16S rRNA基因片段的DGGE图谱(a)和主成分分析(b)Figure 2 Comparison of the DGGE profiles(a)and principal component analysis(b)of bacterial 16S rRNA genes fragments from the different treatments at the wheat ripening stage
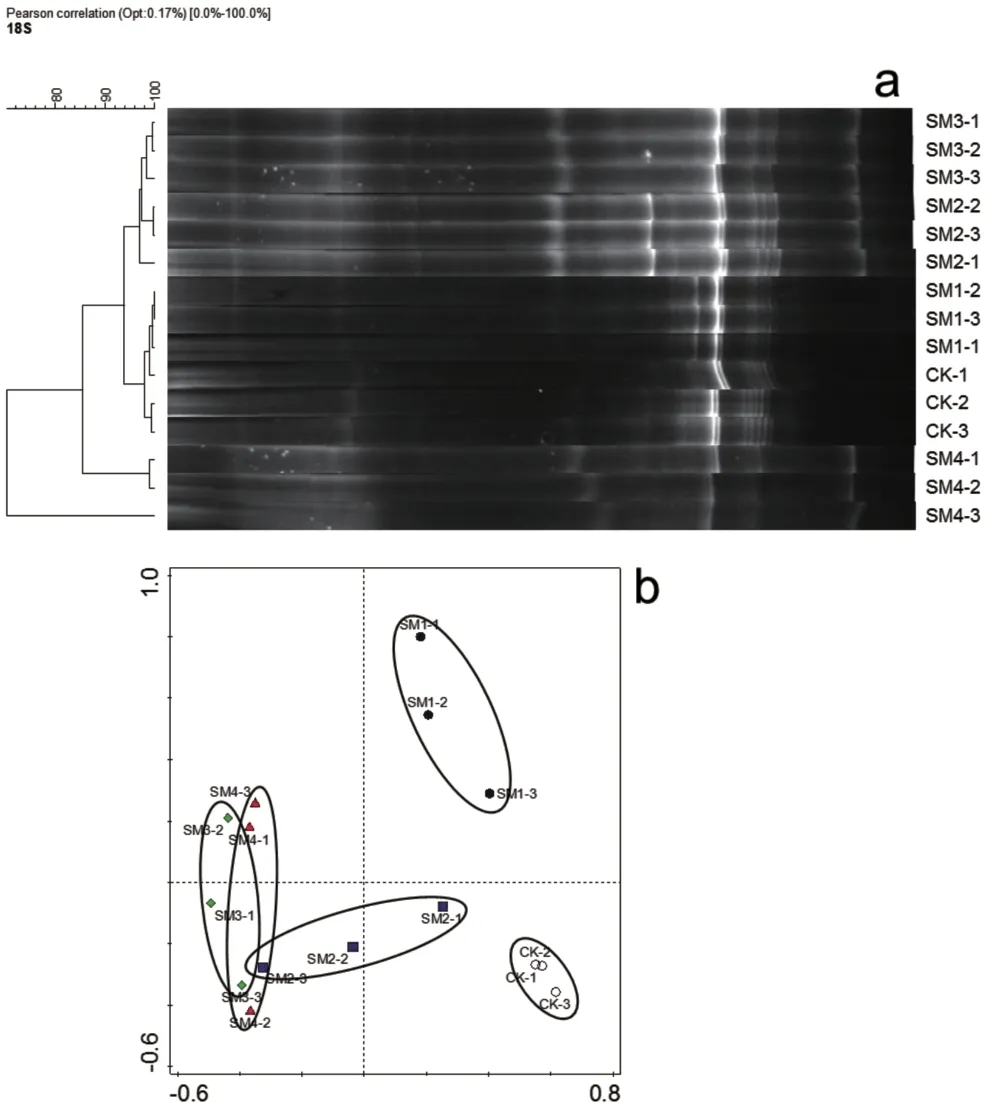
图3 小麦成熟期不同处理真菌18S rRNA基因片段的DGGE图谱(a)和主成分分析(b)Figure 3 Comparison of the DGGE profiles(a)and principal component analysis(b)of fungal 18S rRNA genes fragments from the different treatments at the wheat ripening stage
各处理组真菌群落Shannon 指数和Chao-1 指数高于CK,且在SM2 和SM3 两个基质处理中达到显著差异(表6)。而各处理间均匀度指数差异均不显著。有机质的提高进一步提高了Shannon 和Chao-1指数,SM3 处理的Shannon 和Chao-1指数达到最高值。然而,在SM4 处理中,Shannon 和Chao-1 指数显著低于SM3 和SM2 处理。细菌群落的各项指数中,只有SM2处理的均匀度指数显著高于CK(表7),SM2处理的Shannon 和均匀度指数最大,SM3的Chao-1指数最大。

表6 成熟期不同处理的真菌群落的α多样性指数Table 6 Alpha-diversity index of fungal communities treated with different treatments at ripening stage

表7 成熟期不同处理的细菌群落的α多样性指数Table 7 Alpha-diversity index of bacterial communities treated with different treatments at ripening stage
2.4 土壤真菌、细菌群落组成与土壤性质的相关性分析
采用典型相关分析法(CCA)分析了成熟期土壤真菌群落结构与土壤性质(SOM、pH、TN、AN、AP、AK、BD、EC、MBC、MBN)的关系(图4),总变异系数为4.36,解释变量占73.8%。真菌CCA 排序结果的前两轴特征值分别为0.573 7 和0.473 9,说明排序结果是合理的。CCA 结果表明,MBC 对真菌多样性和群落结构有显著影响,其次是SOM、TN、AN、AP 和BD(贡献率>10%)。但上述环境因子对细菌群落的变化无显著影响(P>0.05)。MBC 是影响真菌群落的主要因子(P<0.05)。SOM 是对细菌群落影响最大的环境因素,但是细菌的CCA 结果各处理之间没有很好区分(图5)。
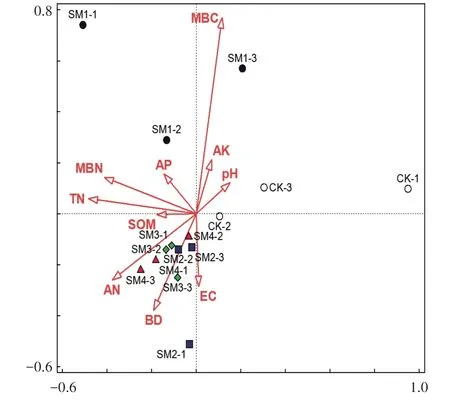
图4 小麦成熟期不同处理真菌群落组成与土壤性质的典型相关分析(CCA)Figure 4 Canonical correlation analysis of the fungal community compositions and soil properties from the different treatments at the wheat ripening stage
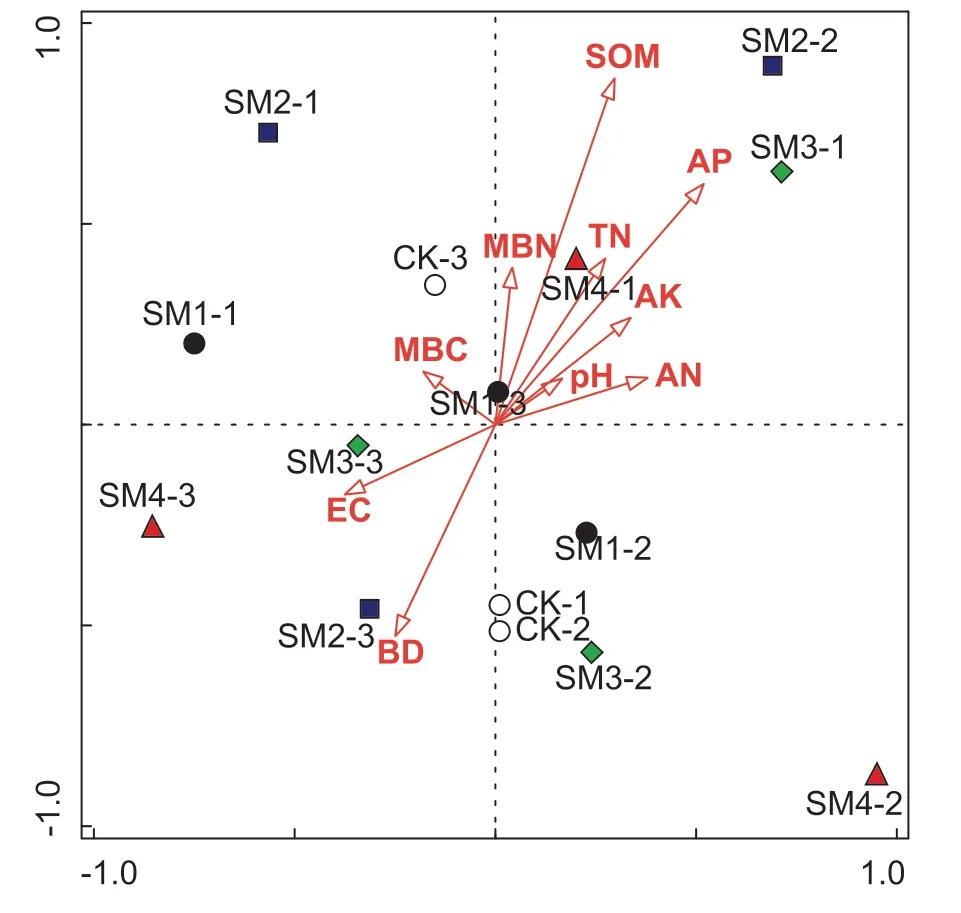
图5 小麦成熟期不同处理细菌群落组成与土壤性质的典型相关分析(CCA)Figure 5 Canonical correlation analysis of the bacterial community compositions and soil properties from the different treatments at the wheat ripening stage
3 讨论
3.1 增施基质对小麦产量的影响
本研究结果显示增施基质提高了小麦产量,特别是SM4 处理的小麦产量与CK 相比提升幅度达到显著水平。研究发现,无机肥料和有机物料(SM)联合配施可以维持甚至提高作物产量。已有的研究发现,大多数有机物料的投入对产量有正面影响,但也有一些有机物料(如绿肥和秸秆)的投入对产量有负面影响[20-21]。总体来说,与CHEN等[22]在我国广泛进行的3种农业措施(传统农业实践、改进实践、高产系统)相比,本研究SM4 处理的最大产量为8 276.40 kg·hm-2,达到了CHEN 等研究中改进实践的产量(8.3 Mg·hm-2),说明施用SM 是一种快速有效的施肥措施。使用有机材料时,化肥是维持生产所必需的[3-4,21]。虽然本研究在所有处理中都施用了相同数量的肥料,但在今后保持作物产量的同时减少SM处理中的化肥施用量是可行的。SM 的施用并不是为了替代化肥,而是增加退化土壤的生产率。
SOM 是影响作物生产力和土壤质量的关键因素[1,6]。试验区(黄河故道)SOM 含量普遍低于江苏省平均水平(22 g·kg-1)[23],因此利用有机投入维持并提高该地区土壤肥力具有重要意义。与研究开始前的未处理土壤相比,经SM3 和SM4 处理的土壤中的SOM 分别增加了2.66 g·kg-1和2.92 g·kg-1。同样,BEI等[3]在华北平原农田有机投入连续4 a,结果显示秸秆处理的农田SOM 增加了4.05 g·kg-1,有机肥处理增加了4.04 g·kg-1,秸秆还田加有机肥处理增加了5.12 g·kg-1。与其相比,本研究的管理方式在每年增加的SOM 的数量方面具有优势。尽管本试验周期较短,但与其他培肥措施相比,SM 的应用在改善SOM 方面已显示出优势。在试验过程中,各处理的SOM 均呈先升高后降低的趋势,这可能是由于一些基质产品留在土层中,没有被完全分解,这与JI 等[24]的研究结果一致,他们将这种有机质下降的现象解释为有机和无机肥料的联合添加引起的激发效应,这一措施刺激了土壤微生物的生长,加速了SOM的分解。
3.2 增施基质对土壤营养的影响
基质中的土壤速效养分含量较低,而有机质和微生物成分含量较高,因此增施基质处理对土壤养分供应,特别是对土壤AN 的影响不显著。但是基质中养分的缓慢释放仍然存在,并可以被植物快速吸收。增施基质使土壤有机质迅速增加,这与相应处理的产量、AP 和AK 的增加一致。此外,在小麦成熟期,SM3与SM4处理的土壤AP和AK显著高于CK。尽管豆科作物增加了土壤氮素含量,但其对土壤有机质提升的影响并不显著[4,7],因此豆科作物的种植并不适合应用于需要短期快速提升土壤有机质的场景。商用有机肥料或肥料也能有效改善贫瘠土壤的有机质含量[25-26],但由于我国粮食主产区的畜牧业集约化生产水平较低,用于大量生产有机肥料的畜禽粪便等原料的获取在地理上受到限制。因此,基质的生产清洁无污染、原材料易得、应用成本低、施肥效果全面,具有重要优势。
3.3 增施基质对土壤微生物的影响
土壤微生物通过参与有机质转化、养分循环和生物修复,在维持土壤功能方面发挥着重要作用[27]。不同的农业管理措施可能会改变土壤化学性质,这些性质通常与土壤微生物群落和丰度密切相关[28]。本研究结果表明,基质处理的土壤MBC 和微生物丰度显著增加,SM2 和SM3 处理的土壤微生物多样性高于CK、SM1 和SM4。微生物区系多样性的增加可能主要与纤维素降解和养分循环有关[29],其特征是生长过程中纤维素酶、脲酶和转化酶活性的增加。
在本研究中,基质的使用显著增加了脲酶活性,特别是在拔节期。而CK 处理脲酶活性也有增加,这与LIANG 等[30]的研究结果一致,但与BANDICK 等[31]的结果相反。蔗糖酶活性反映了土壤成熟程度和肥力水平。CK中较低的蔗糖酶活性表明化肥短期不会导致土壤熟化,蔗糖酶的活性不足也会加速籽粒败育从而导致小麦减产[32]。小麦生长期间纤维素酶活性逐渐增加,这与GAIND 等[33-34]的研究结果一致。纤维素酶活性增加可能促进微生物对有机质的降解并减轻未降解秸秆对作物生长的抑制作用。
基质与化肥配施能提高土壤MBC、MBN 和脲酶活性,这与ZHENG 等[35]的研究结果一致,他们发现,氮磷化学肥料与有机肥料的长期联合施用,显著提高了MBC 含量,而土壤微生物生物量通常与土壤生物功能密切相关[36-37]。
许多研究表明,微生物群落的结构和丰度与作物的生长和产量密切相关[38-39]。土壤细菌和真菌数量的显著增加可能是由于向土壤中引入了大量的土壤改良培肥基质。基质的松散颗粒结构和土壤性质的改善可能为微生物的生长提供了一个合适的环境[40]。与豆科作物覆盖影响细菌群落不同[41],本研究中DGGE结果显示真菌群落结构对有机输入的反应比细菌更敏感,SM3 和SM4 两处理与其他样品在CCA 分析中区分明显,这与LI 等[5]的研究结果一致。在本研究中,真菌比细菌具有优势可能是由于有机投入物和秸秆导致了土壤有机碳的增加[42]。DGGE 较低的分辨率可能会忽视一些低丰度微生物的变化,因此对于基质施用过程中低丰度微生物的功能和丰度的变化还需要通过进一步的研究来阐明。
土壤性质对解释土壤微生物群落组成的变化具有重要作用。本研究结果表明,MBC、SOM、TN、AN、AP、BD 对土壤真菌群落组成的影响大于其他土壤性质。先前的研究也表明,有机碳形态的变化与土壤真菌群落组成的变化密切相关[43]。MBC 是解释土壤真菌群落组成显著性水平的唯一因子,占土壤真菌群落组成方差的12.6%。土壤有效养分(如AN 和AP)与真菌群落结构之间存在很强的相关性。这表明土壤碳和营养是影响土壤微生物群落的主要影响因子,养分影响真菌群落结构已有研究报道[44]。土壤水稳性团聚体更适合真菌菌丝生长。秸秆的降解降低了土壤BD,这可能是BD影响真菌群落组成的原因。
4 结论
(1)本研究报道了一种管理模式:秸秆发酵+基质生产+田间施用。
(2)与传统的粪肥和有机肥相比,本研究以废弃秸秆为原料,通过菌剂发酵和降解生产的有机改良基质减少了病原菌的引入风险并降低了生产成本,可以在全国各地推广。
(3)田间试验结果表明该有机改良基质与化肥的联合施用显著改善了土壤养分和结构,提高了微生物群落的丰度和多样性,提高了贫瘠土壤的生产力。
(4)本研究使用的基质本身作为营养源,相对于仅施用化肥的处理,势必会带来额外的养分,因此基质添加带来的额外养分及其对土壤结构的改变等是否对产量产生影响还需进一步的研究。此外,本文对细菌和真菌群落结构的研究仅停留在丰度和多样性层面,对于具体的群落结构的变化,尤其是一些低丰度微生物的变化了解得还不够清楚,未来运用高通量测序结合纯培养技术研究关键微生物在有机添加过程中的变化和作用将有助于开发新的微生物组产品,因此需进一步探究土壤改良过程中微生物的作用和相关机制。
- 农业环境科学学报的其它文章
- 土壤环境生物安全与健康专刊特邀主编
- 生物菌剂对土壤微生物群落结构和功能的影响

