壮骨止痛胶囊对去卵巢大鼠体质量及脂/骨代谢的影响
杨珊珊 陈红琼 陈瑶 郁洁 罗坚 周薇 彭振 雷晓明



〔摘要〕 目的 探讨壮骨止痛胶囊对去卵巢大鼠体质量及脂/骨代谢的影响。方法 选用健康雌性SD大鼠30只,随机分为空白(Blank)组、假手术(Sham)组、模型(OVX)组、壮骨止痛胶囊(ZGZTC)组和雌激素(EV)组,每组6只。OVX组、ZGZTC组以及EV组均摘除双侧卵巢,Sham组仅在卵巢周围切除相应体积的脂肪。ZGZTC组(567 mg/kg)、EV组(0.21 mg/kg)灌胃相应药物,Sham组和OVX组灌胃相应体积生理盐水,Blank组不做处理。每周检测体质量,干预12 周后用显微CT检测大鼠右股骨骨密度(bone mineral density, BMD),扫描电镜分析左股骨骨小梁超微结构,HE染色评价胫骨组织微结构的变化,ELISA法测定血清雌激素(estrogen, E2)、脂联素(adiponectin, ADP)、瘦素(leptin, LEP)、骨碱性磷酸酶(bone alkaline phosphatase, BALP)、骨钙素(bone-Gla-protein, BGP)、I型前膠原N端前肽(N-terminal propeptide of type I procollagen, PINP)水平。结果 与Blank组和Sham组比较,OVX组大鼠BMD显著降低(Ρ<0.001),骨小梁孔隙率增加,骨小梁厚度变薄,间距增大,内部骨微结构紊乱,BALP及ADP水平显著升高(Ρ<0.05,Ρ<0.01,Ρ<0.001)。与Blank组比较,OVX组大鼠E2水平显著下降(Ρ<0.05)。与OVX组比较,ZGZTC组大鼠胫骨、股骨骨小梁形态结构改善,骨髓腔内脂肪空泡面积及数目减少(Ρ>0.05),体质量降低(Ρ<0.001),血清E2水平和PINP水平显著升高(Ρ<0.05), BALP水平显著降低(Ρ<0.01);其血清LEP水平升高,ADP、BGP水平降低,但差异无统计学意义(Ρ>0.05)。结论 壮骨止痛胶囊可能通过调节血清E2、脂肪因子ADP、LEP水平,抑制成脂分化过度,促进成骨分化,减少骨髓脂肪堆积,抑制过度骨代谢,改善骨小梁微结构,防治绝经后骨质疏松症,并维持体质量稳定,减少骨折的发生。
〔关键词〕 壮骨止痛胶囊;骨质疏松症;脂骨代谢;骨髓脂肪;扫描电镜;骨微结构
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2022.01.005
〔Abstract〕 Objective To investigate the effects of Zhuanggu Zhitong Capsule on body weight and lipid/bone metabolism of ovariectomized rats. Methods 30 healthy female SD rats were randomly divided into Blank group, Sham group, OVX group, ZGZTC group and EV group, with 6 rats in each group. Bilateral ovaries were removed in OVX group, ZGZTC group and EV group, and only the corresponding volume of fat around the ovaries was removed in Sham group. ZGZTC (567 mg/kg) and EV (0.21 mg/kg) groups were intragastricted with corresponding drugs, Sham group and OVX group were intragastricted with corresponding volume of normal saline, Blank group was not treated. The body weight was measured every week. After 12 weeks of intervention, the bone mineral density (BMD) of the rat's right femur was measured by micro-CT, the ultrastructure of the trabecular bone of the left femur was analyzed by scanning electron microscope (SEM), the changes of tibial tissue microstructure were evaluated by HE staining, ELISA method was used to determine serum estrogen (E2), adiponectin (ADP), leptin (LEP), bone alkaline phosphatase (BALP), bone-Gla-protein (BGP), N-terminal propeptide of type I procollagen (PINP) levels. Results Compared with Blank group and Sham group, BMD of rats from OVX group was significantly decreased (Ρ<0.001), and the porosity of bone trabecular was increased, the thickness was thinner and spacing of bone trabecular increased, the internal bone microstructure was disturbed, and the levels of BALP and ADP were significantly increased (Ρ<0.05,Ρ<0.01,Ρ<0.001). Compared with Blank group, E2 level of rats from OVX group was significantly decreased (Ρ<0.05). Compared with OVX group, the morphology and structure of tibia and femur trabecular bone of rats from ZGZTC group were improved, and the area and number of fat cavitation in bone marrow cavity were decreased (Ρ>0.05), body weight was decreased (Ρ<0.001), serum E2 and PINP levels were significantly increased (Ρ<0.05), and BALP level was significantly decreased (Ρ<0.01), serum LEP level was increased and ADP and BGP levels were decreased, but the differences were not statistically significant (Ρ>0.05). Conclusion Zhuanggu Zhitong Capsule may inhibit excessive adipogenicdifferentiation, promote osteogenic differentiation, reduce bone marrow fat accumulation, inhibit excessive bone metabolism, improve bone trabecular microstructure, prevent and cure postmenopausal osteoporosis, maintain stable body mass and reduce the occurrence of fractures by regulating serum E2, adipogenic factor ADP and LEP levels.
〔Keywords〕 Zhuanggu Zhitong Capsule; osteoporosis; lipid bone metabolism; bone marrow fat; scanning electron microscope; bone microstructure
骨质疏松症(osteoporosis, OP)是最常见的骨骼疾病,是一种以骨量低、骨组织微结构破坏导致骨脆性增加、易发生骨折为特征的全身性骨病,可发生于任何年龄,但多见于绝经后女性和老年男性[1]。骨髓微环境的变化与OP的发生、发展密切相关,骨髓微环境主要由骨髓基质、微血管、成骨细胞(osteoblast,OB)、破骨细胞(osteoclast, OC)、脂肪细胞、造血细胞及相关细胞因子等组成,是骨吸收和骨重建的重要场所[2]。近年来,人们发现骨髓间充质干细胞(bone marrow
mesenchymal stem cells, BMSCs)向OB和脂肪细胞分化紊乱可能是导致OP的重要原因,形成了“骨髓脂肪细胞过剩”导致OP的学说[3],因而OP也被称为“骨骼的肥胖症”[4]。在生理状态下,OB、成脂细胞平等竞争地从BMSCs分化形成;而在衰老、绝经后骨质疏松症(postmenopausal osteoporosis, PMOP)等状态下,BMSCs向成脂细胞分化增强,OB分化减弱,从而导致骨髓脂肪堆积、骨量减少等病理性改变[5-6]。PMOP状态下骨量与骨髓脂肪呈负相关,且骨髓脂肪作为参与调节能量与内分泌功能的组织可直接或间接抑制成骨分化与骨形成,促进破骨分化与骨吸收,从而影响骨代谢[7]。因此,通过改善其成骨-成脂分化的失衡,调节脂/骨代谢紊乱是防治PMOP的有效途径之一。
壮骨止痛胶囊是湖南省名中医莫新民教授的经验方,已获得国家新药证书(国药准字Z20050125),全方由淫羊藿、补骨脂、枸杞子、女贞子、狗脊、骨碎补、怀牛膝7味中药组成,对PMOP具有良好防治作用。但壮骨止痛胶囊发挥抗OP的作用是否与调节脂/骨代谢有关,尚未见相关报道。因此,本实验拟观察壮骨止痛胶囊对去卵巢大鼠体质量及脂/骨代谢的影响,并探讨此影响在抗OP中发挥的作用。
1 材料
1.1 动物
SPF级雌性SD大鼠30只,7周龄,体质量180~220 g,购自湖南斯莱克景达实验动物有限公司,许可证号:SCXK(湘)2019-0004,饲养于湖南中医药大学清洁级动物实验中心,许可证号:SYXK(湘)2019-0009。温度(22±2) ℃,湿度(50±10)%,12 h昼夜循环照明,分笼饲养。每日定时清洗笼舍,大鼠能自由摄食及饮水。饲料为标准普通饲料(湖南中医药大学动物实验中心提供),定期更换垫料。实验过程中对动物的处置符合实验动物管理和使用委员会的要求,符合3R原则。
1.2 药品与主要试剂
壮骨止痛胶囊(四川美大康药业股份有限公司,批号:Z20050118,0.45 g/粒);戊酸雌二醇(拜耳医药保健有限公司,批号:J20171038,1 mg/片);戊巴比妥钠(美国默克公司,批号:20200422);青霉素钠(华北制药股份有限公司,批号:F9102109);电镜固定液(武汉赛维尔生物科技有限公司,批号:G1102);雌激素(estrogen, E2,批号:C0317020308)、瘦素(leptin, LEP,批号:Z12036492)、骨碱性磷酸酶(bone alkaline phosphatase, BALP,批号:Z08036494)、脂联素(adiponectin, ADP,批号:Z07036493)、骨钙素(bone-Gla-protein, BGP,批号:Z07036125)、I型前胶原N端前肽(N-terminal propeptide of type I procollagen, PINP,批号:Z11036497)ELISA试剂盒均购自武汉华美生物工程有限公司。
1.3 主要仪器
Heraeus Fresco 21型微量冷冻离心机(德国Thermo Fisher科技公司);991型超低温冰箱(赛默飞世尔科技有限公司);MB-530型多功能酶标仪(深圳汇松科技發展有限公司);HM325型石蜡切片机(赛默飞世尔科技有限公司);BA410E型显微镜(麦克奥迪电气股份有限公司);K850型临界点干燥仪(英国Quorum公司);MC1000型离子溅射仪(日立公司);SU8100型扫描电子显微镜(日立公司);Quantum GX型小动物显微CT(珀金埃尔默股份有限公司)。
2 方法
2.1 动物分组及给药
大鼠适应性喂养7 d后开始试验,遵循随机原则,将30只SD大鼠分为空白(Blank)组、假手术(Sham)组、模型(OVX)组、雌激素(EV)组、壮骨止痛胶囊(ZGZTC)组,每组6只。OVX组、EV组、ZGZTC组均摘除双侧卵巢,Sham组仅在卵巢周围切除相应体积的脂肪。
各组均从术后1周开始给药,每天灌胃1次,连续12周。给药量按照70 kg成人与0.2 kg大鼠体表面积等效换算(成人剂量×70 kg×0.018/0.2 kg)。Sham组和OVX组每天灌胃相应体积生理盐水,ZGZTC组(567 mg/kg)、EV组(0.21 mg/kg)灌胃相应药物,Blank组不做处理。
2.2 PMOP大鼠模型的建立
采用国内外公认的雌性大鼠PMOP模型[8-9]。用2%戊巴比妥钠(0.2 mL/100 g体质量)麻醉,无菌条件下摘除大鼠双侧卵巢,Sham组仅在卵巢周围切除相应体积的脂肪,术后连续3 d大腿肌肉注射青霉素钠,每只大鼠4万U/d,术后5 d连续观察大鼠阴道脱落细胞涂片,发现模型大鼠细胞涂片以白细胞为主,提示造模成功[10]。5 d后拆线,每周测量体质量,12周后麻醉,取股骨、胫骨、血清。
2.3 显微CT检测大鼠股骨骨密度(bone mineral
density, BMD)
应用小动物显微CT评价大鼠右侧股骨远端的微观结构。感兴趣区域(region of interest, ROI)包括从生长板最高点以下1 mm位置开始往下数40层的骨小梁平扫图片。对ROI区三维图像进行定性和定量分析BMD。扫描模式为:扫描电压90 kV,扫描电流为80 μA,扫描时间为14 min,旋转角度360°,分辨率为18 μm。扫描完成后采用Analyze 12.0分析。
2.4 扫描电镜观察股骨骨小梁超微结构
剖取左侧完整的股骨,去除上面附着的肌肉组织,保留骨膜,使用0.1%磷酸缓冲液进行清洗后在2.5%戊二醛溶液中进行固定,叔丁醇梯度脱水,-10 ℃冰冻,干燥。导电胶固定标本,喷金,使用扫描电子显微镜观察钛合金材料表面与孔隙内骨组织及纤维组织生长情况。
2.5 HE染色法检测大鼠胫骨组织微结构变化
剖取左侧完整的胫骨,去除上面附着的肌肉组织,保留骨膜,在中性福尔马林溶液中固定一周,随后置于EDTA脱钙液中浸泡两月,保证液体完全覆盖样本,每周更换新的脱钙液,液体为标本体积的5倍。然后常规脱水,浸蜡,包埋,切片,展片,烤片,染色。通过显微镜拍照观察骨小梁结构,应用Image-Pro Plus 6.0图像分析处理软件测定脂肪空泡数目及面积。
2.6 ELISA法检测大鼠血清激素的表达
腹腔注射2%戊巴比妥钠(0.2 mL/100 g)麻醉,腹部切口分离腹主动脉,用负压采血管采血5 mL,静置2 h,3000 r/min,离心半径8.6 cm,离心15 min后分离血清,使用大鼠特异性试剂盒检测血清E2、ADP、LEP、BALP、BGP、PINP水平。
2.7 统计学处理
数据用“x±s”表示,所有资料进行正态性检验。符合正态分布者,多组计量资料采用单因素方差分析,方差齐者用LSD和SNK法,方差不齐者用Tamhane’s T2或Dunnett’s T3法;不符合正态分布者,采用多个独立样本比较的秩和检验(K Independent Samples)。所有数据使用SPSS 25.0软件进行处理。以P<0.05为差异有统计学意义。
3 结果
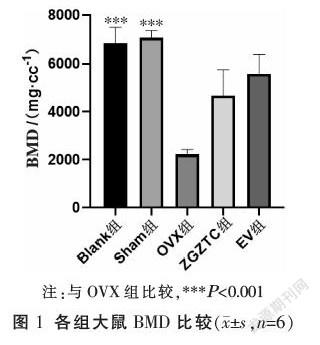
3.1 壮骨止痛胶囊对去卵巢大鼠BMD的影响
与Blank组和Sham组比较,OVX组大鼠BMD显著降低(P<0.001);与OVX组比较,ZGZTC组BMD升高,但差异无统计学意义(P>0.05)。见图1。
3.2 壮骨止痛胶囊对去卵巢大鼠体质量的影响
Blank组、Sham组、ZGZTC组、EV组各组间体质量比较,差异无统计学意义(P>0.05);与其余各组比较,OVX组体质量显著升高(P<0.001)。去卵巢手术后第2、3个月,各组体质量增长量均较第1个月有所降低。与Sham组比较,OVX组去卵巢手术后第二个月体质量增长显著(P<0.05);与OVX组比较,ZGZTC组及EV组去卵巢手术后第1、2、3个月体质量增长均减少,但差异均无统计学意义(P>0.05)。见图2。
3.3 壮骨止痛胶囊对去卵巢大鼠骨小梁超微结构的影响
Blank组和Sham组骨小梁相互交织成网状结构,骨小梁表面被覆的骨胶原纤维排列紧密,其走行方向与骨小梁长轴方向基本一致,骨胶原纤维表面的纤丝排列紧密,呈束状无分离现象,OVX组骨小梁网状结构破坏严重,骨小梁明显变细变薄,表面凹凸不平极为粗糙,排列杂乱无章,断裂、缺失现象严重,骨小梁表面骨胶原纤维结构散乱、粗细不等,出现卷曲及断裂现象,骨胶原纤维间空隙增大,骨胶原纤维的纤丝排列紊乱、粗细不均匀,出现退行性改变。与OVX组比较,ZGZTC组、EV组骨小梁结构明显增粗增厚,骨胶原纤维排列致密,但尚未恢复至正常。见图3。
3.4 壮骨止痛胶囊对大鼠胫骨组织微结构的影响
Blank组和Sham组胫骨组织结构完整,骨小梁密集,粗细均匀,排列整齐,连接成网状,骨髓腔较小,骨髓细胞数量丰富,脂肪细胞少;而OVX组骨髓腔明显变大,骨小梁变细、稀疏,间隙增大,排列紊乱,结构缺失严重,髓腔内见大量空泡状脂肪细胞,脂肪细胞周围OB、骨细胞等显著减少;与OVX组比较,ZGZTC组和EV组骨组织形态均有不同程度的改善,骨小梁增多、疏松,空泡状脂肪细胞减少,OB和骨细胞增多,但结构仍不完整。与Blank組比较,OVX组大鼠胫骨脂肪空泡数目和面积显著增加(P<0.05),药物干预后,脂肪空泡数目和面积均减少,但差异无统计学意义(P>0.05)。见图4-5。
3.5 壮骨止痛胶囊对大鼠血清激素水平的影响
给药治疗12周后,与Sham组及Blank组比较,OVX组大鼠血清BALP(P<0.01或P<0.05)、ADP(P<0.05或P<0.001)水平显著升高;与Blank组比较,OVX组大鼠血清E2水平显著降低(P<0.05);与OVX组比较,各药物治疗组血清E2水平均显著上升(P<0.05),ZGZTC组血清PINP水平显著上升(P<0.05),BALP水平显著下降(P<0.01);各组间大鼠血清BGP、
LEP表达水平比较,差异无统计学意义(P>0.05)。见图6。
4 讨论
体质量对骨折风险的影响是复杂的。与稳定体质量相比,体质量增加或减轻均可能增加骨折发生率,但不同骨折部位的相关性不同[11]。
脂肪、骨转换和BMD密切相关,是OP的一种诊断方法和潜在的治疗靶点[12]。骨髓脂肪细胞数量增加,骨折风险也随之增高[13-14]。此外,骨骼老化与成骨标志物下降和成脂标志物增加有关[15]。有研究表明,骨髓脂肪细胞的副产物会影响骨髓环境中的其他细胞和骨骼微结构[16],骨髓脂肪细胞可通过在骨髓中分泌游离脂肪酸显著增加脂肪毒性[17-18],这些游离脂肪酸对OB和骨细胞有毒性,从而导致自噬和细胞凋亡[19-20]。当骨髓脂肪中不饱和脂肪酸的比例较低时,BMD降低而骨折患病率增高[21]。研究证实,Louvain大鼠中骨髓脂肪区的OB数和骨细胞数显著减少[22],表明在骨髓内脂肪区附近可以影响局部细胞密度,从而影响骨的转换和结构,体现了骨髓脂肪细胞在OP的病理生理学中的作用。
ADP是至今发现的所有脂肪细胞因子中唯一可以进行负性调节的激素,其与骨代谢息息相关,由骨髓脂肪所产生的ADP能通过自分泌或旁分泌的路径促进骨形成,而处于血液循环中的ADP则通过内分泌的方式抑制骨形成[23]。LEP是肥胖基因的编码产物,是一种具有内分泌作用的蛋白,主要由外周白色脂肪组织产生,也可由骨髓中的脂肪组织产生,其对骨代谢的作用具有组织特异性和双重性,其对骨质的影响既有中枢性抑制成骨,也有外周促进成骨的双重作用[24]。LEP被脂肪组织合成并释放进入外周循环,可直接作用在外周的骨组织,促进BMSCs向OB分化,并抑制向脂肪细胞分化[25]。有研究表明,脂代谢影响骨代谢还有可能与高脂导致的抗氧化能力受损相关[26]。氧化脂质能够促进BMSCs向脂肪细胞分化,同时还能刺激OC生成和诱发炎症反应导致骨吸收,共同加剧骨的破坏[27]。E2水平降低可引起氧化应激从而导致BMSCs的成脂-成骨分化失衡,其通过诱导核心蛋白β-catenin与FoxO3a和PPARγ的结合,从而抑制骨髓的成骨性分化,使脂肪形成,最终导致OP[28]。
骨形成标志物包括BALP、BGP、PINP等。骨骼矿化受阻时,OB合成大量碱性磷酸酶,使血清BALP明显升高[29]。应用药物治疗可以使BALP下降,且这种下降通常出现在BMD增加之前,所以BALP是OP治疗疗效评价的重要指标之一,而BGP是骨基质矿化的必需物质,在调节骨钙代谢中起重要作用,反映骨代谢的总体水平,血清中BGP水平可直接反映OP患者OB活性和骨形成情况,PINP在血清中的含量则反映OB合成骨胶原的能力,其血液中的含量主要反映Ⅰ型胶原的合成速率和骨转换的情况,是新骨形成的特异性的敏感指标[30]。
从以上实验结果分析,去卵巢后大鼠血清E2水平显著下降,ADP水平显著升高,LEP水平下降,脂/骨代谢紊乱,成骨-成脂分化失衡,BMSCs向成脂细胞分化增强,OB分化则减弱,从而导致骨髓脂肪细胞数量显著增加,骨髓脂肪区OB数和骨细胞数相应减少,导致骨量减少,最终造成PMOP。而壮骨止痛胶囊干预后,大鼠血清E2、PINP、LEP水平显著上升,ADP、BALP水平下降,骨髓脂肪细胞减少,OB数和骨细胞数增多,骨量增多,骨小梁结构改善,表明BMSCs向OB分化增强,成脂细胞分化减弱,成骨-成脂分化失衡的脂骨代谢紊乱情况改善,从而避免了PMOP的发生。因此,通过本次实验研究可以推测出壮骨止痛胶囊通过上调血清E2、LEP水平和降低ADP水平等促进成骨分化,抑制成脂分化,调节脂/骨代谢紊乱,减少骨髓脂肪堆积,抑制过度骨代谢,使骨量增多,从而改善骨小梁微结构,并维持体质量稳定,以防治PMOP,减少骨折的发生。这是可能的作用机制之一,然而这只是目前从实验中得出的推断结论,由于样本量较小,导致有些指标只呈现出一些变化趋势,结果差异不显著,对于壮骨止痛胶囊调节脂/骨代谢防治PMOP的具体机制以及临床研究,还有待进一步深入探索。
参考文献
[1] 中华医学会骨质疏松和骨矿盐疾病分会.原发性骨质疏松症诊疗指南(2017)[J].中国骨质疏松杂志,2019,25(3):281-309.
[2] TENCEROVA M, KASSEM M. The bone marrow-derived stromal cells: Commitment and regulation of adipogenesis[J]. Frontiers in Endocrinology, 2016, 7: 127.
[3] 唐 睿,湯光宇,诸静其.骨质疏松症骨髓脂肪的影像学研究进展[J].中国骨质疏松杂志,2021,27(2):284-288.
[4] ROSEN C J, BOUXSEIN M L. Mechanisms of Disease: Is osteoporosis the obesity of bone[J]. Nature Clinical Practice Rheumatology, 2006, 2(1): 35-43.
[5] JAMES A W. Review of signaling pathways governing MSC osteogenic and adipogenic differentiation[J]. Scientifica, 2013, 2013: 684736.
[6] GRAFE I, ALEXANDER S, PETERSON J R, et al. TGF-β family signaling in mesenchymal differentiation[J]. Cold Spring Harbor Perspectives in Biology, 2018, 10(5): a022202.
[7] 胡美思,任艳玲.中药调节绝经后骨质疏松症成脂分化研究进展[J].辽宁中医药大学学报,2021,23(3):81-85.
[8] LELOVAS P P, XANTHOS T T, THOMA S E, et al. The laboratory rat as an animal model for osteoporosis research[J]. Comparative Medicine, 2008, 58(5): 424-430.
[9] 张 悦,李运峰.骨质疏松症动物模型研究进展[J].中国骨质疏松杂志,2020,26(1):152-156.
[10] 陈 沙,王桂云,李荣慧,等.雌性大鼠手术去势骨质疏松症模型建立及评价[J].湖南中医药大学学报,2020,40(11):1315-1319.
[11] CRANDALL C J, YILDIZ V O, WACTAWSKI-WENDE J, et al. Postmenopausal weight change and incidence of fracture: Post hoc findings from Women's Health Initiative Observational Study and Clinical Trials[J]. British Medical Journal, 2015, 350: h25.
[12] CHAN G M F, RIANDINI T, NG S H X, et al. Role of fat and bone biomarkers in the relationship between ethnicity and bone mineral density in older men[J]. Calcified Tissue International, 2018, 102(1): 64-72.
[13] ZHU M, HAO G Y, XING J M, et al. Bone marrow adipose amount influences vertebral bone strength[J]. Experimental and Therapeutic Medicine, 2019, 17(1): 689-694.
[14] SHEN W, CHEN J, GANTZ M, et al. MRI-measured pelvic bone marrow adipose tissue is inversely related to DXA-measured bone mineral in younger and older adults[J]. European Journal of Clinical Nutrition, 2012, 66(9): 983-988.
[15] DEVLIN M J, ROSEN C J. The bone-fat interface: Basic and clinical implications of marrow adiposity[J]. The Lancet Diabetes & Endocrinology, 2015, 3(2): 141-147.
[16] LV S, WU L, CHENG P, et al. Correlation of obesity and osteoporosis: Effect of free fatty acids on bone marrow-derived mesenchymal stem cell differentiation[J]. Experimental and Therapeutic Medicine, 2010, 1(4): 603-610.
[17] VELDHUIS-VLUG A G, ROSEN C J. Clinical implications of bone marrow adiposity[J]. Journal of Internal Medicine, 2018, 283(2): 121-139.
[18] GILLET C, DALLA VALLE A, GASPARD N, et al. Osteonecrosis of the femoral head: Lipotoxicity exacerbation in MSC and modifications of the bone marrow fluid[J]. Endocrinology, 2017, 158(3): 490-502.
[19] GUNARATNAM K, VIDAL C, BOADLE R, et al. Mechanisms of palmitate-induced cell death in human osteoblasts[J]. Biology Open, 2013, 2(12): 1382-1389.
[20] GUNARATNAM K, VIDAL C, GIMBLE J M, et al. Mechanisms of palmitate-induced lipotoxicity in human osteoblasts[J]. Endocrinology, 2014, 155(1): 108-116.
[21] PATSCH J M, LI X J, BAUM T, et al. Bone marrow fat composition as a novel imaging biomarker in postmenopausal women with prevalent fragility fractures[J]. Journal of Bone and Mineral Research, 2013, 28(8): 1721-1728.
[22] AL SAEDI A, CHEN L L, PHU S, et al. Age-related increases in marrow fat volumes have regional impacts on bone cell numbers and structure[J]. Calcified Tissue International, 2020, 107(2): 126-134.
[23] 劉 洋.罗格列酮对牙周炎大鼠牙龈组织ADPR1 mRNA和ADPR2mRNA表达的影响[D].郑州:郑州大学,2016.
[24] 刘玉川,王 亮,马远征.骨质疏松和瘦素关系的研究进展[J].中国骨质疏松杂志,2012,18(5):469-473.
[25] XU J C, WU G H, ZHOU L L, et al. Leptin improves osteoblast differentiation of human bone marrow stroma stem cells[J]. European Review for Medical and Pharmacological Sciences, 2016, 20(16): 3507-3513.
[26] WU Q, ZHONG Z M, PAN Y, et al. Advanced oxidation protein products as a novel marker of oxidative stress in postmenopausal osteoporosis[J]. Medical Science Monitor, 2015, 21: 2428-2432.
[27] 柏茂盛,赵建宁,洪 叶.脂代谢与骨代谢信号通路及与骨代谢相关疾病的关系:理论进展与热点方向[J].中国组织工程研究,2018,22(20):3269-3274.
[28] REN Z Q, WANG Y F, AO G F, et al. Overall adjustment acupuncture for postmenopausal osteoporosis (PMOP): A study protocol for a randomized sham-controlled trial[J]. Trials, 2020, 21(1): 465.
[29] 张萌萌.中国老年学学会骨质疏松委员会骨代谢生化指标临床应用专家共识[J].中国骨质疏松杂志,2014,20(11):1263-1272.
[30] 张萌萌,张秀珍,邓伟民,等.骨代谢生化指标临床应用专家共识(2020)[J].中国骨质疏松杂志,2020,26(6):781-796.

