新型麦胚活性肽对脂多糖诱导RAW264.7细胞的抗炎作用
陈元蓉,张 宸,杨高红,沈新春,宋海昭,熊 玲,王銮凤,汪 芳
(南京财经大学食品科学与工程学院;江苏省现代粮食流通与安全协同创新中心;江苏高校粮油质量安全控制及深加工重点实验室;粮食储运国家工程实验室,南京 210023)
巨噬细胞是调控炎症反应的中心细胞,在炎症的发生、维持和解决中起着关键作用[1]。在炎症发生过程中,巨噬细胞主要通过抗原呈递、吞噬和产生各种细胞因子和生长因子进行免疫调节。巨噬细胞对内毒素脂多糖(LPS)的识别激活了下游细胞内信号级联,导致多种炎症介质和细胞因子的产生[2],例如TNF-α、IL-1β、IL-6、IL-8和IL-12等[3]。TNF-α、IL-1β和IL-8通过协同诱导其他细胞因子、趋化因子和黏附分子的产生来放大炎症反应。IL-6与其受体结合后,通过参与抗凋亡基因的表达,从而防止T细胞凋亡,最终扩大了炎症反应。这些促炎细胞因子的mRNA表达在炎症反应中被上调。然而,IL-10作为抗炎细胞因子,可以抑制促炎细胞因子的合成,从而调节炎症反应[4]。
近年来,越来越多的研究表明食源性多肽具有良好的抗炎活性,其比药物的副作用低,且呈现出对靶组织的高特异性,具有低毒高效的特点,其通过调节细胞因子的释放,从而减轻炎症细胞因子诱导的炎症,在治疗慢性炎症性疾病方面具有明显的优势[5, 6, 7]。Hao等[8]从大豆中分离得到的Lunasin肽在LPS诱导的RAW 264.7 巨噬细胞炎症模型中显示出较高的抗炎活性,并显著抑制了炎症细胞因子的分泌。Gao等[9]研究发现鲟鱼蛋白衍生的3种肽在LPS刺激的RAW 264.7巨噬细胞炎症模型中,可有效抑制炎症细胞因子IL-1β和IL-6的释放。Ji等[10]研究表明小米谷醇溶蛋白肽(MPP)通过抑制LPS刺激的RAW 264.7巨噬细胞中炎症细胞因子TNF-α、IL-6和IL-1β的产生,进而显著减轻炎症反应。Ren等[11]研究发现来源于榛子蛋白酶水解物的多肽LDAPGHR在LPS诱导的RAW264.7细胞炎症模型中表现出抗炎作用,其通过抑制IL-1β、IL-6和TNF-α的分泌量来发挥抗炎作用。随着越来越多的食源性多肽的抗炎活性被发现,从食品中寻找发现新型食源性抗炎活性肽将对炎症性疾病具有重要意义。
小麦胚芽中麦胚蛋白约占30%,是一种完全蛋白,含有人体必需的8种氨基酸,被称为“人类天然营养宝库”[12]。生物活性肽通常由3~20个氨基酸组成,在母体蛋白质中不起作用。然而,它们可以通过酶水解、发酵或食品加工等手段得以释放。有研究表明,小麦胚芽可提高动物对急性和慢性炎症的抵抗作用,并通过抑制血清中促炎细胞因子的分泌恢复良好的肠道抗炎环境,从而治疗佐剂性关节炎[13]。Jeong等[14]研究发现,柠檬酸处理的小麦胚芽提取物(CWG)在LPS刺激的巨噬细胞模型中显示出良好的抗炎作用,其通过抑制促炎细胞因子TNF-α的分泌、白细胞介素IL-6、IL-12和COX-2的合成来发挥抗炎作用。虽然已有研究通过酶解、发酵等手段得到麦胚活性肽[15],但通过体外模拟消化来得到麦胚抗炎活性肽鲜见报道,内肽酶水解可提高活性肽的生物利用度,避免其在胃肠道中进一步被消化。此外,胃肠道酶消化比单一酶消化产生的多肽效果更好[16]。基于此,本研究利用体外模拟胃肠道消化对麦胚蛋白进行酶解,通过超滤膜分离技术对蛋白酶解产物进行逐级分离,根据各级分离产物的抗炎活性筛选出具有较高抗炎活性的目标肽段,鉴定其氨基酸序列,并结合PeptideRanker数据库活性预测结果筛选出抗炎活性最高的肽序列,进一步采用LPS诱导的RAW 264.7细胞体外炎症模型检测其抗炎活性,以期为麦胚活性肽的发现与分离纯化提供研究基础,并为麦胚蛋白应用于抗炎活性肽的开发与利用提供参考。
1 材料与方法
1.1 材料与试剂
小麦胚芽;小麦胚芽肽纯度>98%。胰蛋白酶(2 500 U/mg)、胃蛋白酶(3 000 U/mg)、胰凝乳蛋白酶(250 U/mg);NO试剂盒和ELISA试剂盒(TNF-α、IL-1β、IL-6和IL-10);RAW 264.7细胞株;噻唑蓝(MTT);胎牛血清(FBS)和RPMI Medium 1640培养基;地塞米松(DEX);所有分离用有机溶剂均为分析纯。
1.2 仪器与设备
Labscale小型切向流超滤系统,H1850高速冷冻离心机,Thermo Scientific酶标仪,2XZ 旋片真空泵,MX-RD-E标准型旋转混均仪,MZE多功能酶标仪,ZDDN-II全自动凯氏定氮仪器,Axio Observer A1荧光倒置显微镜,Easy-nLC 1200高效液相色谱仪和Q Exactive高分辨质谱仪,SCIENTZ-10N-A冷冻干燥机。
1.3 方法
1.3.1 麦胚蛋白的制备
小麦胚芽采用正己烷进行脱脂。将脱脂后的小麦胚芽,用粉碎机粉碎后过100目筛。称取50.0 g小麦胚芽粉加入500 mL蒸馏水,称取5.0 g NaCl用少量水溶解加入溶液中,调pH至9.0,用磁力搅拌器搅拌提取30 min,再于4 ℃,5 000 r/min离心10 min,取上清液,然后调pH至4.0,待沉淀完全后,二次离心10 min,弃去上清液,取沉淀,用蒸馏水溶解并调pH至7.0,透析脱盐后,真空冷冻干燥得麦胚蛋白粉,于-20 ℃保存,备用[17]。参考GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》,采用凯氏定氮法测定麦胚蛋白粉中的蛋白含量,小麦胚芽转换系数为5.8。
1.3.2 麦胚蛋白体外模拟胃肠消化
根据Sangsawad等[18]的方法对模拟胃肠消化过程略做修改,用去离子水溶解麦胚蛋白冻干粉,搅拌均匀,形成8%的蛋白溶液,95 ℃水浴加热30 min,调pH至7.0后使蛋白质完全变性。在模拟胃消化阶段,用1 mol/L HCl溶液将pH保持在2.0,在37 ℃下用胃蛋白酶(0.4%,干基)消化悬浮液4 h。在模拟肠道消化阶段,用1 mol/L NaOH溶液将pH保持在7.6,在37 ℃下用胰蛋白酶(0.3%,干基)和α-胰凝乳蛋白酶(0.1%,干基)消化6 h。消化过程中每隔1 h采样,测定样品水解度(DH)。消化10 h后,待消化液冷却至室温,5 000 r/min离心20 min,收集上清液,透析脱盐后,于4 ℃下保存待进一步分离纯化。
1.3.3 水解度测定
标准曲线的绘制:分别取0、100、200、300、400 μL丝氨酸标准液于5 mL试管中,加入去离子水补足至400 μL,加入3 mL OPA试剂,混匀,反应2 min,测定吸光度(以去离子水做参比)。以吸光度为纵坐标Y,丝氨酸浓度为横坐标X,绘制标准曲线。
水解度的测定:取不同时间点的水解液1 mL,用去离子水稀释100倍(使测定值在标准曲线范围内),取稀释后的水解液400 μL加入3 mL OPA试剂,反应2 min,测定吸光度。在同一条件下重复测定3次,根据测得的吸光度平均值从标准曲线上计算出CSerine-NH2(mmol/L),按公式计算水解度[19]。
式中:Wserine-NH2为每克蛋白质中含serine-NH2的量/mmol/g;x为样品质量/g;P为样品中蛋白质质量分数/%;V为样品水解液体积/L;N为水解液稀释倍数;h为水解过程中每克麦胚蛋白被断裂的肽键数/mmol/g prot;htot为每克麦胚蛋白质所含的总肽键数(8 mmol/g);α、β分别用常数1.00、0.40表示。
1.3.4 双缩脲法测定多肽含量
标准曲线的绘制:用5%的TCA依次配制0.0、0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6和1.8 mg/mL的Gly-Gly-Tyr-Arg四肽标准溶液10 mL。分别取6.0 mL不同质量浓度的标准溶液,加入4.0 mL双缩脲试剂,混合均匀,静置10 min,2 000 r/min离心10 min,取上清液于540 nm下测定OD值。以四肽标准溶液的质量浓度为横坐标X(mg/mL),OD值为纵坐标Y,绘制标准曲线[20]。
取2.5 mL样品溶液,加入2.5 mL质量分数10%的三氯乙酸(TCA)水溶液,于漩涡混合仪上混合均匀,静置10 min,4 000 r/min离心15 min,将上清液全部转移至50 mL容量瓶中,并用5%的TCA定容,摇匀。取6.0 mL溶液于15 mL离心管中,加入4.0 mL双缩脲试剂(样液:双缩脲试剂体积比=3∶2),于漩涡混合仪上混合均匀,静置10 min,2 000 r/min离心10 min,取上清液于540 nm下测定OD值,对照标准曲线求得样品溶液中的多肽质量浓度C(mg/mL),计算样品中多肽含量。通过四肽标品的测定,得到标准曲线方程为y=0.108 9x+0.040 4,R2=0.992 6。
1.3.5 超滤膜分离
选用分子截流量为3 ku和1 ku的超滤膜,采用Labscale小型切向流超滤系统对酶解物进行分离,分别得到3个组分WGPH-Ⅰ(>3 ku)、WGPH-Ⅱ(1~3 ku)和WGPH-Ⅲ(<1 ku)。具体操作步骤:用0.1 mol/L,pH 7.6的KH2PO4-K2HPO4缓冲液将样品配成质量浓度为0.1%的溶液,用0.45 μm的纤维素膜过滤除去不溶物。调节泵的压力控制流速并在4 ℃下进行超滤。将超滤后不同分子量的组分脱盐并冷冻干燥,得到不同分子量的多肽组分,用于下一步的抗炎活性筛选。
1.3.6 Nano-LC-MS/MS测多肽序列
将肽粉溶于200 μL Nano-HPLC Buffer A中,混匀离心提取上清液,将上清液转入0.22 μm旋转过滤器中,收集滤液[21]。
制备C18膜填充柱;将挥干的多肽样品重新溶解于Nano-HPLC Buffer A中,然后用40 μL甲醇过柱离心1遍,弃掉EP管底部液体,重复2次;40 μL Nano-HPLC Buffer A过柱离心1遍,弃掉EP管底部液体,重复2次;多肽样品过柱离心1遍,取EP管底部液体再过柱1遍;40 μL Nano-HPLC Buffer A过柱离心1遍,弃掉EP管底部液体,重复2次;更换新的EP管,40 μL 洗脱相Buffer B过柱离心1遍,收集EP管底部液体,重复1次。脱盐后将含多肽样品的80 μL 洗脱相Buffer B进行挥干。
将挥干的多肽样品重新溶解于Nano-HPLC Buffer A中。采用Nano-HPLC液相系统EASY-nLC1200进行分离。液相A液为0.1%甲酸-水溶液,B液为0.1%甲酸-乙腈溶液。100 μm×20 mm RP-C18色谱柱Trap column以100%的A液平衡。样品由自动进样器上样并吸附到Trap column柱上,再经分析柱,75 μm×150 mm RP-C18色谱柱分离,流速为300 nL/min。样本间用空白溶剂30 min流动相梯度清洗1次。酶解产物经毛细管高效液相色谱分离后用Q-Exactive质谱仪进行质谱分析。检测方式为,使用前经标准校正液校正,母离子扫描范围:350~2 000m/z,质谱扫描方式为信息依赖的采集工作模式下(DDA),每次全扫描后采集最强的20个碎片图谱(MS2 scan),碎裂方式为高能碰撞解离(HCD),NCE能量28,动态排除时间25 s。MS1在M/Z 200时分辨率为70 000,AGC target设置为3e6,最大注射时间100 ms,MS2分辨率设置为17 500,AGC target设置为1e5,最大注射时间50 ms。
1.3.7 多肽合成
利用高效固相肽合成仪合成抗炎肽,并通过反相高效液相色谱(RP-HPLC)质谱(LC-MS/MS)联用对其纯度进行了验证,合成的肽在使用前保存在-20 ℃。
1.3.8 抗炎活性的测定
1.3.8.1 噻唑蓝(MTT)法检测RAW 264.7增殖活力
取对数生长期的RAW 264.7巨噬细胞,用10% FBS RPIM 1640培养液配制成3×104个/mL的细胞悬浮液100 μL于96孔板中,在细胞培养箱中培养12 h使细胞贴壁,另设置无细胞孔作为空白组。除去96孔板中培养液后,将多肽溶解于含10% FBS的RPIM 1640培养液中制成不同质量浓度多肽(20、80、320 μg/mL)培养液,再加到96孔板中,置于细胞培养箱中,37 ℃培养24 h后每孔加入10 μL的MTT溶液(5 mg/mL),培养4 h后吸去96孔板中溶液,加入50 μL的DMSO溶液,37 ℃恒温振荡20 min后在570 nm下测吸光度[22]。
1.3.8.2 Griess方法检测LPS诱导的RAW264.7中NO含量
同1.3.8.1所述方法培养RAW 264.7巨噬细胞,加入不同质量浓度多肽(20、80、320 μg/mL)预保护2 h,然后加入LPS(1 μg/mL),于培养箱中继续恒温(37 ℃)培养24 h。从96孔板各孔中吸取50 μL上清液分别转移到另一个96孔板各孔中,每孔依次加入NO检测试剂盒中的Griess Ⅰ和Griess Ⅱ溶液各50 μL,混匀后。在540 nm下的检测吸光度值,换算成NO摩尔浓度[23]。
1.3.8.3 炎症因子的测定
根据试剂盒说明书使用ELISA试剂盒(IL-1β、IL-6、IL-10和TNF-α)检测炎症因子含量[24]。
1.3.9 统计学分析
所有实验重复3次,实验数据以平均值±标准差表示,数据分析使用SPSS17.0软件进行student-t检验,P<0.05表示数据具有统计学差异。
2 结果与分析
2.1 麦胚蛋白体外模拟消化过程中水解度的变化
测得小麦胚芽中蛋白质质量分数为(28.47±2.65)%,其纯度为(82.49±3.97)%。水解度(DH)表示蛋白质的降解程度,目前在评价水解效率方面应用广泛。如图1所示,麦胚蛋白在体外模拟消化阶段其水解度整体呈上升趋势;在胃消化阶段(0~4 h),麦胚蛋白经胃蛋白酶水解后,其DH最终达到6.87%。有研究表明蛋白质经过胃蛋白酶的初步水解后其产物一般为分子量较大的多肽[25]。在肠道消化阶段(4~10 h),DH在前2 h加速上升,到达11.99%并趋于稳定,其水解度最终为13.08%。小肠是人体的主要营养物质吸收部位,其中胰蛋白酶和α胰凝乳蛋白酶发挥着重要作用。胰蛋白酶作为内肽酶,可以沿底物蛋白的一级结构在氨基酸链的中间切割肽键。因此胰酶的加入大幅度提高了麦胚蛋白的DH,并产生大量的小分子活性肽。此外,由于消化液浓度的降低以及蛋白质底物和酶切位点的减少导致DH逐渐趋于稳定。

图1 麦胚蛋白在不同消化时间的水解度的变化
2.2 超滤膜分离和多肽含量
超滤分离是分离提纯的过程,其根据物质之间相对分子质量的不同达到分离的目的。本实验利用超滤膜对麦胚消化酶解液进行分离纯化,以去除分子量大于3 ku的多肽杂质,最终得到纯度较高的多肽溶液。最终分别得到3个组分WGPH-Ⅰ(>3 ku)、WGPH-Ⅱ(1~3 ku)和WGPH-Ⅲ(<1 ku),真空冷冻干燥得到冻干粉后测得3个组分的多肽质量分数分别为(4.03±0.33)%、(4.27±0.24)%和(5.68±0.06)%。不同组分肽段的含量、颜色和澄清度均不相同。大于3 ku超滤膜分离的肽段组分颜色最深,偏黄色,可能含有一些小分子物质存在。其他组分颜色为黄白色或白色,低分子量多肽的澄清度高于高分子量的澄清度。
2.3 麦胚抗炎活性肽的筛选
2.3.1 麦胚多肽(WGPHs)对RAW 264.7细胞活力的影响
通过MTT实验探究麦胚多肽WGPH-Ⅰ(>3 ku)、WGPH-Ⅱ(1~3 ku)和WGPH-Ⅲ(<1 ku)在不同浓度下对巨噬细胞活力的影响,结果如图2所示,与对照组相比,不同组分对RAW 264.7细胞的活力产生了一定的影响。当质量浓度在20~320 μg/mL时,3个组分对RAW 264.7细胞活力均无显著影响(P>0.05),表明其在20~320 μg/mL质量浓度下对巨噬细胞无毒性。而当质量浓度达到640 μg/mL时,细胞活力显著降低(P<0.01),表明过高浓度的麦胚多肽对细胞毒性较大。因此,综合细胞活力实验结果,选择20、80、320 μg/mL 3个质量浓度进行后续实验,进一步探究其抗炎作用。

注:**表示与LPS模型组相比具有极显著差异(P<0.01)。
2.3.2 麦胚多肽(WGPHs)对LPS诱导的RAW 264.7细胞NO分泌量的影响
NO是一种重要的跨膜分子信号,能够损伤机体周围组织,当炎症发生时,巨噬细胞会分泌大量NO。已有报道表明LPS刺激RAW 264.7细胞可以急剧增加NO的释放量,造成细胞产生炎症反应[26]。因此,本研究采用LPS诱导的巨噬细胞炎症模型分析不同多肽组分的抗炎活性。通过Griess法检测麦胚多肽(WGPHs)对LPS诱导的巨噬细胞NO分泌量的影响。结果如图3所示,与空白组相比,LPS诱导的RAW 264.7细胞NO分泌量明显升高(P<0.01),其释放量增加了5.98倍,表明该模型成功。麦胚多肽WGPH-Ⅰ和WGPH-Ⅱ干预组NO浓度与模型组相比无显著差异;WGPH-Ⅲ干预组则显著抑制了NO的释放,表现出较好的抗炎活性。WGPH-Ⅲ组分的分子量(<1 ku)低于WGPH-Ⅰ和WGPH-Ⅱ组分,表明分子量较小的多肽其抗炎活性可能更高。该结果与Torresfuentes等[27]的研究相似。因此,选择WGPH-Ⅲ组分进行后续质谱鉴定以及抗炎活性的进一步验证。

注:##表示与正常组相比有极显著差异(P<0.01),*表示与LPS模型组相比具有显著差异(P<0.05),**表示与LPS模型组相比具有极显著差异(P<0.01),下同。
2.4 Nano-LC-MS/MS鉴定WGPH-Ⅲ(<1 ku)多肽序列
采用Nano-LC-MS/MS对WGPH-Ⅲ的多肽组分进行结构鉴定,其色谱主要出峰时间集中在7~90 min,对应的流动相中乙腈质量分数为50%~67%,表明WGPH-Ⅲ多肽呈现非极性,推测多肽中可能含有一定量疏水性氨基酸。
通过Mascot 2.3软件分析得到与小麦胚芽蛋白质组中同源性最高的20个短肽。从350~2 000m/z中,选取峰面积前14的碎片进行二级质谱分析,共鉴定出14条多肽,其氨基酸序列及分子量如表1所示,这些肽均由7~12个氨基酸组成,且观察肽序列可以看出Phe(F)、His(H)、Trp(W)、Cys(C)和Tyr(Y)等小分子疏水氨基酸残基高频率出现,说明其生物活性好。通过Peptide Ranker数据库(http://distilldeep.ucd.ie/Peptide Ranker/)对每个肽进行评分,评价肽的生物活性概率。从预测结果可以得出,疏水氨基酸多且分子量小的肽活性较强。其中APEPEPAF(P1)、MDTSAPSPF(P2)、IDIPNGR(P3)和VDPAVPPK(P4)序列活性较强,因此,通过高效固相肽合成仪合成4条多肽,进一步验证其生物活性,其二级质谱图见图4。

图4 肽段的二级拟合质谱图

表1 目标肽段的鉴定及生物活性的预测
2.5 小肽P1、P2、P3和P4分别对LPS诱导的巨噬细胞NO分泌量的影响
通过Griess法检测小肽P1、P2、P3和P4对LPS诱导的巨噬细胞NO分泌量的影响,结果如图5所示,与空白组相比,模型组的RAW 264.7细胞NO分泌量极显著升高(P<0.01)。与模型组相比,小肽组的NO浓度均明显降低,且随着浓度的增加,NO的分泌量逐渐降低,表明P1、P2、P3和P4都可以抑制RAW 264.7细胞NO的分泌,表现出较强的抗炎活性,且具有剂量依赖性。其分子机制可能是LPS激活巨噬细胞,诱导局部炎症和抗体的产生,并影响体内iNOS的表达,从而影响NO的产生。其中小肽P1的抗炎活性最好,在炎症性疾病的治疗或预防中具有潜在意义。因此,选取P1(APEPEPAF)进行下一步研究。

图5 小肽P1、P2、P3、P4对LPS诱导的巨噬细胞NO分泌量
2.6 小肽P1(APEPEPAF)对LPS诱导的巨噬细胞炎症介质的影响
LPS是革兰氏阴性细菌细胞壁的主要成分,能与Toll样受体4(TLR4)结合,进而诱导巨噬细胞产生炎症。当机体发生炎症时,LPS的生成量会随革兰氏阴性菌数量增加而增加,影响炎症性疾病的发生,且长期的炎症会成为肿瘤发展的主要诱因[28]。经LPS刺激后,巨噬细胞会合成或释放炎症因子,阻断炎症因子是抑制炎症的一个有效治疗策略。采用Elisa试剂盒测定LPS诱导的巨噬细胞炎症介质(IL-6、IL-10、TNF-α和IL-1β)的分泌量,并分析小肽P1对炎症因子水平的影响,结果如图6所示。
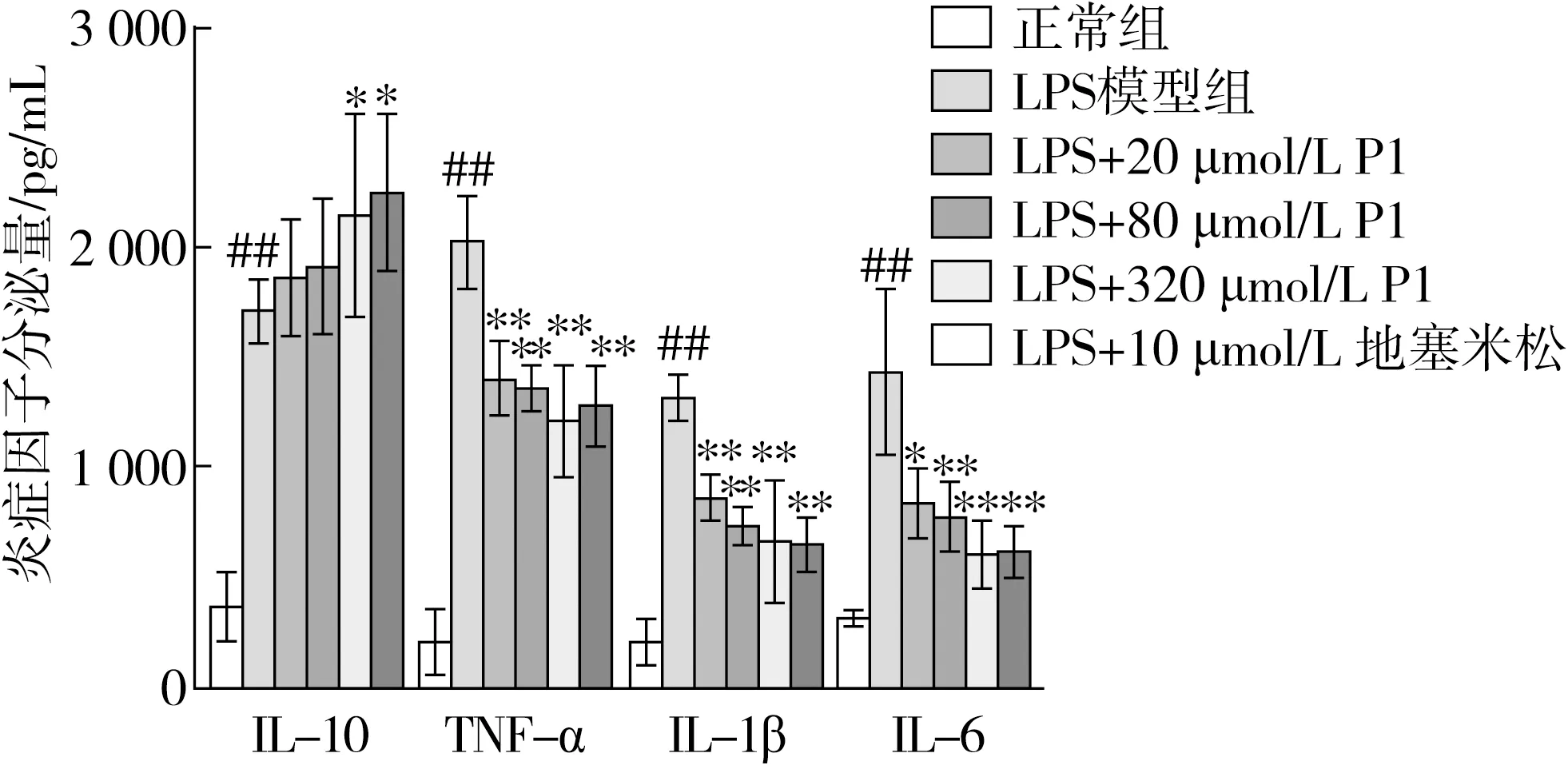
图6 小肽APEPEPAF对LPS诱导的RAW264.7分泌炎症因子的影响
与正常组相比,LPS诱导细胞后,其促炎因子IL-6、TNF-α和IL-1β的分泌显著升高(P<0.05)。当小肽P1或阳性药DEX干预后,与LPS组相比,促炎因子IL-6、TNF-α和IL-1β的分泌显著得到抑制(P<0.01)。此外,与正常组相比,LPS诱导巨噬细胞后,其抗炎因子IL-10的分泌显著升高(P<0.01),小肽P1或阳性药DEX干预后均在不同程度上增加了抗炎因子IL-10的分泌,随着小肽P1干预浓度的增加,其分泌量呈现出上升趋势(P<0.01)。
通过检测炎症因子分泌水平的结果表明,小肽P1对促炎因子IL-1β、IL-6和TNF-α的分泌具有抑制作用,对抗炎因子IL-10的分泌有一定的促进作用。即小肽P1能够抑制LPS诱导的巨噬细胞促炎因子IL-1β、IL-6和TNF-α的分泌,促进抗炎因子IL-10的分泌,呈现出良好的改善炎症的作用效果,表明小肽干预后能在蛋白表达和基因转录水平上抑制细胞炎症因子的表达,降低机体炎症反应,从而发挥抗炎作用。
已有研究表明,多肽的抗炎活性与其氨基酸组成存在密切关系,Saisavoey等[29]和Zhao等[30]研究发现含有P、F残基的多肽具有抗炎活性;此外,Liang等[31]发现玉米多肽—PPYLSP和FLPPVTSMG也呈现出较强的抗炎活性。由此推测,含有P、F、L等氨基酸残基的多肽呈现出较好的抗炎活性;本研究中小肽P1(APEPEPAF)、P2(MDTSAPSPF)、P3(IDIPNGR)和P4(VDPAVPPK)的氨基酸序列中含有P、F等氨基酸残基,其中小肽P1的P、F氨基酸残基最多,且抗炎活性最强,小肽P1由于含有P、F等氨基酸残基而呈现出较好的抗炎活性,说明小肽P1在预防或治疗炎性疾病方面具有很大的应用潜力,可以作为一种新型的抗炎药物用于疾病的预防和治疗。
3 结论
采用碱溶酸沉法、体外模拟胃肠道消化法、超滤膜分离以及PeptideRanker数据库活性预测,从麦胚蛋白消化产物中分离筛选得到14条新的生物活性肽,并进一步通过脂多糖(LPS)诱导的巨噬细胞RAW 264.7炎症模型,筛选得到抗炎活性较强的4条抗炎活性肽,P1(APEPEPAF)、P2(MDTSAPSPF)、P3(IDIPNGR)和P4(VDPAVPPK),均能降低LPS诱导的巨噬细胞中NO的分泌量。其中抗炎活性最强的小肽P1,其氨基酸序列为APEPEPAF,分子量为856 u,该小肽能够显著抑制脂多糖诱导的巨噬细胞中NO及促炎因子的分泌,说明麦胚蛋白可作为抗炎肽的前体,通过内肽酶的酶解得以释放,且安全性强、稳定性高,可以作为一种潜在的功能性食品加以开发利用。

