补骨颗粒对体内异位成骨影响研究
余光书,林焱斌,庄福毅,吴春玲
(1. 福州市第二医院,福建 福州 350007;2. 福建中医药大学研究生院,福建 福州 350122;3. 厦门大学医学院,福建 厦门 361102)
骨是一种高度血管化的组织,血管生成对于维持骨稳态和骨再生具有重要的意义,许多患者的骨折修复失败可归因于血液供应受损,因此成功的骨再生意味着新血管的形成。然而,新血管的形成受不同类型细胞活性及细胞因子等诸多因素的影响,研究血管新生的调控机制以及血管新生和成骨之间如何相互影响仍是目前的热点。血管内皮生长因子(VEGF)是血管生成和体内稳态的关键调节剂,能够与包括骨形成蛋白2(BMP-2)在内的多种细胞因子相互协调作用以调控骨组织的修复,并且VEGF表达水平代表了骨组织修复重建的潜能,因此通过添加VEGF等生长因子来促进血管生成成为研究的热点[1]。但是目前大多数研究发现外源性添加VEGF以维持一定水平的难度大且易于失活[2],通过外源性药物干预以激活相关细胞活性以提高VEGF的表达成为近年的研究方向[3]。因此,本研究在既往应用补骨颗粒治疗股骨颈骨折具有良好效果的基础上[4],观察了补骨颗粒对体内异位成骨及VEGF、BMP-2表达的影响,探讨补骨颗粒对骨折愈合的影响机制。
1 实验材料与方法
1.1实验动物 清洁级SD雄性大鼠30只,6周龄,体重(160±20)g,由湖南斯莱克景达实验动物有限公司提供[SYXK(湘)2019-0004],室温饲养,自由饮水。
1.2实验试剂 VEGF试剂盒(酶联生物科技有限公司,货号:ml002862),BMP-2试剂盒(酶联生物科技有限公司,货号:ml102832),VEGF165冻干粉(同立海源生物有限公司,货号:GMP-TL653)。
1.3实验仪器 手术器械(北京中镜科仪),超净台(北京亚泰科隆仪器),电子天平(中国民桥),缝合线(爱惜康慕丝线),缝合针(上海金环),植入式缓释泵(瑞沃德),台式高速冷冻离心机(湖南湘仪实验室仪器开发有限公司),全自动酶标洗板机(深圳市汇松科技发展有限公司),多功能酶标分析仪(深圳市汇松科技发展有限公司),摇床(其林贝尔),恒温箱(北京六一),微波炉(美的),切片刀(莱卡),切片机(浙江金华益迪试验器材),包埋机(常州中威电子仪器),普通冰箱(荣事达),精密PH计(雷磁),显微镜(Motic),盖玻片(海门远泰),载玻片(海门远泰)。
1.4实验药物及制备 补骨颗粒由厦门大学附属福州第二医院药剂科负责加工制备,组方:骨碎补20 g、鹿衔草12 g、淫羊藿12 g、潞党参15 g、茯苓20 g、三七3 g、川牛膝9 g、当归9 g、川芎6 g、女贞子15 g、枸杞9 g、生地15 g、甘草3 g,每克颗粒药含原生药9.8 g,使用时用生理盐水加热溶解,制成1 g/mL的水溶液。
1.5缓释泵的灌充 在室温23 ℃的无菌条件下,使用1.0 mL的注射器抽取VEGF165溶液(使用蒸馏水溶解VEGF165冻干粉并配置为浓度36 μg/mL),将注射器与27G平头灌充针链接,将缓释泵竖直拿在手中,从顶端开孔位置插入灌充针,直到针头轻触缓释泵底部再稍微向上提起灌充针约1 mm,然后缓慢推动注射器将溶液灌充进缓释泵直至缓释泵开孔位置看到溶液溢出为止。
1.6实验方法 30只SD大鼠适应性饲养1周后按照随机对照原则分为空白组、对照组、补骨颗粒组,每组10只。将大鼠称重,10%水合氯醛0.3 mL/100 g腹腔注射。剔除右侧后腿毛发,切开股四头肌附近的皮肤和肌肉,然后于补骨颗粒组与空白组大鼠的股四头肌肌袋中植入灌有生理盐水的缓释泵,于对照组大鼠股四头肌肌袋中植入灌有VEGF165溶液的缓释泵(速率0.25 μL/h),缝合肌肉和皮肤,消毒切口,放回饲养笼饲养。依据临床常用量按实验动物与人体表面积折算的等效剂量比值换算,补骨颗粒组给予补骨颗粒3.08 g/kg灌胃;对照组与空白组给予生理盐水2 mL/kg灌胃,均每日1次,连续2周。于灌胃前进行眼眶取血(留血清),灌胃2周后于末次灌胃2 h后处死大鼠,腹主动脉取血(留血清),同时取股四头肌肌袋区域肌肉,使用4%多聚甲醛固定备用。
1.7检测指标及方法
1.7.1HE染色-免疫荧光法检测骨骼肌成骨情况 将组织切片于60 ℃烤片12 h,将切片置于二甲苯中15 min×3次,然后依次在100%,100%,95%,85%和75%乙醇中放置5min,再用蒸馏水浸洗5 min,苏木素染3 min,蒸馏水冲洗,PBS返蓝;伊红染5 s,蒸馏水冲洗;梯度乙醇(95%~100%)脱水,每级5 min。取出后置于二甲苯10 min×2次,中性树胶封片。显微镜观察,应用IPP(Image-Pro-Plus)软件观察骨骼肌的形态并计算成骨面积的比率。
1.7.2天狼猩红检测骨骼肌胶原形成情况 将组织切片于160℃烤片12h,将切片置于二甲苯中20 min×3次,然后依次在100%,100%,95%,85%和75%乙醇中放置5 min,再用蒸馏水浸洗5 min;天狼星红染色液染10 min,蒸馏水冲洗干净,再自来水冲洗5 s,吹干、透明、封片。显微镜观察,应用IPP(Image-Pro-Plus)软件观察骨骼肌的染色情况并计算胶原面积的比率。
1.7.3免疫组化方法检测CD31在骨骼肌的表达情况 将组织切片于60 ℃烤片30 min,将切片置于二甲苯中10 min×2次,然后依次在100%,95%,85%和75%乙醇放置5 min,再用蒸馏水浸洗5 min。将切片浸入0.01 mol/L 枸橼酸盐缓冲液(pH 6.0),微波炉加热至沸腾后断电,连续煮15 min后冷却10 min后拿出,冷却至室温。冷却后使用0.01 mol/L PBS(pH 7.2)洗涤3 min×3次;加入3% H2O2于室温10min以灭活内源性酶。再使用PBS冲洗3 min×3次;滴加适当稀释的一抗(CD31),4 ℃过夜,PBS冲洗5 min×3次。滴加50 μL抗-兔-IgG抗体-HRP多聚体37℃孵育30min,PBS冲洗5 min×3次;滴加预制好的显色剂DAB工作液50 μL,室温孵育5 min,镜下控制反应时间,蒸馏水洗涤;苏木素复染5 min,蒸馏水冲洗,PBS返蓝;各级乙醇(60%~100%)脱水,每级5 min。取出后置于二甲苯10 min×2次,中性树胶封片。显微镜观察,应用IPP(Image-Pro-Plus)软件观察CD31阳性染色情况(血管生成数)。
1.7.4ELISA法检测血清VEGF及BMP-2含量将采集的血清作为检测样本,然后设空白孔(空白对照孔不加样品及酶标试剂)、待测样品孔,按照VEGF及BMP-2试剂盒说明书进行检测。在酶标包被板上待测样品孔中先加样品稀释液40 μL,然后再加待测样品10 μL。每孔加入酶标试剂100 μL,空白孔除外。用封板膜封板后置37 ℃温育60 min。将20倍浓缩洗涤液用蒸馏水20倍稀释后备用。小心揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置30 s后弃去,如此重复5次,拍干。每孔先加入显色剂A 50 μL,再加入显色剂B 50 μL,轻轻震荡混匀,37 ℃避光显色15 min。每孔加终止液50 μL以终止反应(此时蓝色立转黄色)。以空白孔调零,450 nm波长依序测量各孔的吸光度(OD值)。

2 结 果
2.13组大鼠骨骼肌成骨面积、胶原面积、血管生成数比较 补骨颗粒组的成骨面积明显高于空白组(P<0.05),与对照组比较差异无统计学意义(P>0.05);3组间胶原面积比较差异均无统计学意义(P均>0.05);补骨颗粒组的血管生成数明显多于空白组及对照组(P均<0.05),空白组与对照组比较差异无统计学意义(P>0.05)。见表1及图1~3。
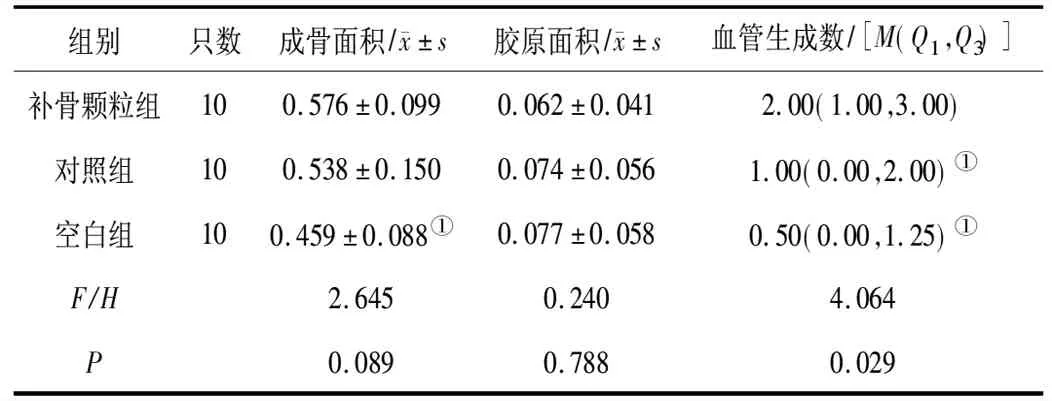
表1 3组大鼠股四头肌肌袋区域骨骼肌成骨面积、胶原面积及血管生成数比较

图1 3组大鼠股四头肌肌袋区域骨骼肌成骨情况(HE染色,×100)

图2 3组大鼠股四头肌肌袋区域骨骼肌胶原形成情况(天狼猩红染色,×100)

图3 3组大鼠股四头肌肌袋区域骨骼肌中血管生成情况(CD31免疫组化,×100)
2.23组大鼠血清VEGF、BMP-2含量比较 干预前,3组血清VEGF、BMP-2含量比较差异均无统计学意义(P均>0.05)。干预2周后,补骨颗粒组血清VEGF含量明显高于空白组(P<0.05),与对照组比较差异无统计学意义(P>0.05);补骨颗粒组血清BMP-2含量明显高于对照组(P<0.05),与空白组比较差异无统计学意义(P>0.05)。见表2。

表2 3组大鼠干预前后血清VEGF、BMP-2含量比较
3 讨 论
骨组织损伤的修复过程是不同类型细胞及相关因子相互作用的一个复杂过程,在这种过程中血管化和骨矿化同时发生[5-6]。而血管化可能在这些过程中发挥关键作用,可以为细胞的生长提供必要的营养物质并去除废物,同时将循环和局部信号与骨微环境的细胞联系起来,并积极参与骨细胞生理的调节,因此微血管系统形成在成功构建骨组织结构中起着关键作用[7-9]。既往有实验研究表明,外源性VEGF可以促进小鼠股骨骨折中的血管形成及骨折部位的修复[10]。但目前药物对于促进骨组织损伤后血管新生的作用有限或者因价格昂贵受到限制,而补肾活血中药在促进血管新生及骨组织损伤方面显示出明显优势。本实验观察了具有补肾活血作用的补骨颗粒对大鼠体内异位成骨的影响,结果显示补骨颗粒组的成骨面积明显高于空白组,血管生成数明显多于空白组及对照组。说明补骨颗粒可以促进体内异位成骨和血管新生,且促进血管新生的作用强于外源性VEGF,故认为补骨颗粒主要通过促进血管新生而加速骨折愈合。
成功的骨组织再生意味着新血管的形成,但是血管新生和成骨之间如何相互影响仍不明确。VEGF和BMP-2是骨再生过程中血管生成和成骨的关键调节剂[11-12],VEGF主要在重建血管的早期阶段表达,BMP-2在骨形成和重塑过程中持续表达,因此骨重建过程中VEGF表达加快是否可以增强BMP-2诱导的骨形成便成为研究的热点。目前有研究发现在骨折愈合过程中VEGF的表达发生在早期愈合阶段(在5~10d内),而BMP-2的分泌发生在整个过程中[13-14]。如果通过递送的方式增加VEGF和BMP-2含量则会起到协同作用并促进早期骨再生,并且与单独递送BMP-2相比,VEGF可显著促进异位骨形成[15-16]。本实验对比了补骨颗粒及外源性补充VEGF对血液中VEGF和BMP-2表达的影响,结果显示补骨颗粒组血清VEGF含量明显高于空白组,与对照组比较差异不明显;补骨颗粒组血清BMP-2含量明显高于对照组,与空白组比较差异不明显。这说明补骨颗粒可以促进VEGF及BMP-2的表达,并且补骨颗粒促进BMP-2表达的效果优于外源性补充VEGF,这或许与补骨颗粒的活血作用促进含氧物质的递送而影响相关细胞活性及补骨颗粒可激活成骨细胞活性等有关。
综上所述,补骨颗粒可以促进体内异位成骨,机制与上调VEGF和BMP-2的表达,促进血管新生有关。但骨组织损伤的修复过程复杂,补骨颗粒的作用机制仍有待深入探讨。
利益冲突:所有作者均声明不存在利益冲突。

