TRPV1/SIRT1介导吴茱萸次碱抗Ang Ⅱ诱导的血管平滑肌细胞衰老
余艳荣,汪小英,祝思路,王寒霞,彭维杰,4,罗 丹
(1.南昌大学基础医学院生理学系,2.南昌大学药学院基础药理重点实验室,江西 南昌 330006;3.阜阳市人民医院药剂科,安徽阜阳 236000;4.赣南医学院,医用组织工程材料与于生物制造江西省重点实验室,江西 赣州 341000)
血管老化是高血压、动脉粥样硬化等心血管疾病发生、发展的重要病理改变,表现为血管结构和功能的改变,包括动脉内中膜厚度增加,顺应性降低和血管炎症表现。血管老化与构成血管壁的细胞衰老有关,其中衰老的血管平滑肌细胞(vascular smooth muscle cells,VSMCs)出现迁移、表型转变等功能紊乱,并向成骨样细胞分化而加速血管钙化。大量研究发现,血管紧张素Ⅱ(Ang Ⅱ),作为肾素血管紧张素系统的关键分子,在高血压、年龄等多种因素诱导的血管老化中起到关键作用。老年人和老龄动物的动脉血管壁及VSMCs中Ang Ⅱ显著增高,而Ang Ⅱ长期刺激可激活衰老通路p53/p21,诱导VSMC出现应激性早衰[1]。
SIRT1(sirtuin1)是一种依赖于NAD+的去乙酰化酶,参与调控细胞内各种代谢活动,尤其和细胞衰老密切相关,被称为长寿蛋白[2]。检测不同年龄人体血管发现,血管平滑肌中SIRT1水平随年龄增长而显著降低,伴随血管平滑肌功能的改变,提示年龄相关的SIRT1水平下降导致VSMC衰老及功能失调[3]。此外,Ang Ⅱ引起的高血压小鼠血管壁SIRT1水平下降,发生动脉斑块区域的SIRT1表达也较对应正常区域下降[4]。而用药物或基因手段上调SIRT1水平则可明显抑制Ang Ⅱ、高糖和动脉粥样硬化等因素诱导的VSMC衰老和功能紊乱[5]。因而,SIRT1被认为是抑制VSMC衰老和血管老化的热门靶点。
吴茱萸次碱(rutaecarpine,Rut)是中药吴茱萸中的主要活性物质,具有显著的心血管保护效应,其舒血管和降压作用已被广泛研究[6]。我们和其他学者的前期研究表明,Rut可显著抑制Ang Ⅱ引起的VSMC增殖和表型转换,并减轻高血压导致的血管重构[7]。Zhou等[8]报道,在高血压动物模型中,Rut可降低其内皮祖细胞的衰老,且抑制Ang Ⅱ引起的内皮祖细胞衰老,表明Rut具有潜在的抗细胞衰老作用。大量证据表明,Rut的主要心血管效应均与激活瞬时受体电位香草酸亚型1 (transient receptor potential vanillic acid subtype 1,TRPV1)有关,后者广泛存在于心血管系统,VSMC也能表达TRPV1。在Ox-LDL引起的VSMC源性泡沫细胞发现,TRPV1激动剂辣椒素可上调SIRT1的水平,提示TRPV1参与调节SIRT1表达[9]。因而本研究进一步在血管紧张素Ⅱ诱导的VSMC衰老模型中,探讨Rut的保护作用,并研究其信号通路是否与TRPV1/SIRT1途径有关。
1 材料与方法
1.1 药品与试剂Rut(上海君拓生物技术有限公司),Ang Ⅱ、TRPV1抑制剂CAPZ(Sigma,USA),AMPK抑制剂Compound C(Selleck,USA),β-半乳糖苷酶和活性氧检测试剂盒(江苏碧云天生物有限公司),SIRT1抗体,p-AMPK抗体和AMPK抗体(Cell Signaling,USA),p21抗体(ABclonal),p53抗体(Proteintech)和山羊抗兔/小鼠IgG二抗(武汉BOSTER);BCA蛋白定量试剂盒,Transwell 小室(3422)(Costor,USA)
1.2 仪器电泳仪和自动曝光仪(BIO-RAD,USA),荧光显微镜(Olympus,日本)。
1.3 实验分组取出大鼠胸主动脉,组织块贴壁法原代培养VSMCs,传代后取第3~8代用于实验。实验分组如下:① Control组:正常对照组;② Ang Ⅱ诱导衰老组:加入终浓度为1 μmol·L-1Ang Ⅱ孵育VSMCs 72 h;③-⑤不同剂量的Rut保护组:加入的终浓度分别为0.3、1和3 μmol·L-1的Rut孵育VSMCs 10 min后,加入Ang Ⅱ继续孵育72 h;⑥ +CAPZ+Rut组:TRPV1受体阻断剂CAPZ(10 μmol·L-1)预处理细胞10 min后,再加入3 μmol·L-1Rut孵育10 min,最后加入Ang Ⅱ继续孵育72 h。⑦ +Compound C+Rut组:在加入Rut和Ang Ⅱ前,预先加入AMPK阻断剂1 μmol · L-1Compound C孵育VSMC 10 min。
1.4 β-半乳糖苷酶(SA-β-Gal)染色法测定衰老细胞数目细胞衰老时会生成大量的β-半乳糖苷酶,该酶作用于底物X-Gal后,细胞会生成一种蓝色物质。VSMC用Ang Ⅱ 诱导培养3 d后,去上清,各孔分别加入1 mL染色固定液15 min。吸弃染色固定液,用PBS洗3次。加入染色工作液封口膜密封,避光37 ℃烘箱过夜。显微镜下观察拍照,ImageJ软件算出衰老蓝染的细胞数。
1.5 荧光探针法检测细胞内ROS水平荧光探针DCFH-DA自身无荧光,但可自由穿过细胞膜后转化为DCFH,后者可被细胞内的ROS氧化,生成发绿色荧光的DCF,从而间接计算出细胞内的ROS含量。细胞处理结束后,去上清,PBS洗2次。加入1 ∶1 000的DCFH-DA探针,用锡箔纸包裹6孔板,37 ℃避光孵育。0.5 h后用无菌的PBS洗2次,加入1 mL DMEM,镜下进行观察拍照,ImageJ算出荧光量。
1.6 划痕愈合实验测定细胞迁移细胞以2×105/孔的密度种于24孔板,待细胞长至100%后,用灭菌的Tips头进行划线,洗掉被破坏的细胞,再加入serum-free的培养基和对应药物,在各个时间点(0、12、24 h)观察同部位划痕愈合情况。用ImageJ计算细胞的平均划痕宽度,以反映细胞迁移状况。细胞迁移率/%=(0 h划痕宽度-24 h后划痕宽度)/0 h划痕宽度×100%。
1.7 Transwell迁移实验对数生长期的VSMCs消化后,含1%血清的培养液重悬,调整细胞密度为5×108L-1,在小室(8 μm)的每孔上室加入100 μL细胞悬液,下室加入400 μL 含有1%血清的培养液;将加有细胞的小室放置于孵育箱继续培养24 h后,弃上室的培养基,用PBS洗涤3次,4%多聚甲醛固定20 min;然后加入1%结晶紫染色液,37 ℃染色30 min;PBS洗涤2~3次,在显微镜下拍照。每组细胞均设3个重复孔,每孔随机取 6个视野进行拍照。
1.8 Western blot检测VSMCs中SIRT1、p53、p21及p-AMPK蛋白表达细胞裂解提蛋白,BCA法蛋白定量。SDS-PAGE电泳、转膜、8%的脱脂牛奶封闭2 h,结合一抗(1 ∶1 000),4 ℃孵育过夜。洗膜,结合二抗(1 ∶5 000),室温孵育2 h。洗膜,ECL化学发光于曝光仪下检测。使用ImageJ软件分析条带灰度,以β-actin为内参计算目的条带的相对表达量。

2 结果
2.1 吴茱萸次碱对Ang Ⅱ 诱导的血管平滑肌细胞衰老和ROS生成的影响SA-β-Gal染色显示(Fig 1A和C),1 μmol·L-1Ang Ⅱ处理细胞72 h可明显增加衰老阳性染色(蓝染)细胞数量(P<0.01),不同剂量的Rut能剂量依赖性地降低衰老染色细胞数量,其中3 μmol·L-1Rut的效果最为明显(P<0.01),CAPZ可消除Rut这一作用(P<0.01)。ROS结果表明(Fig 1B和D),与对照组相比,Ang Ⅱ显著性地升高细胞内ROS水平,不同剂量的Rut呈剂量依赖性地减少ROS产生,且提前加入CAPZ可消除Rut这一作用(P<0.01)。
2.2 吴茱萸次碱对Ang Ⅱ诱导的血管平滑肌细胞迁移的影响Transwell结果显示,与Con组相比,1 μmol·L-1Ang Ⅱ可明显增加迁移到小室对侧的VSMC细胞数目(P<0.01),Rut可剂量依赖性抑制Ang Ⅱ引起的VSMCs迁移(P<0.01),预先加入CAPZ可消除Rut的作用(P<0.01)。划痕愈合实验也证实,划痕24 h后Ang Ⅱ组细胞的划痕距离明显减小(P<0.01),而加入不同剂量的Rut后细胞划痕距离依次增宽,CAPZ可消除Rut的效应(P<0.01),见Fig 2。
2.3 Rut对VSMC中长寿蛋白SIRT1及下游衰老通路p53/p21的影响Western blot结果表示,1 μmol·L-1Ang Ⅱ孵育VSMCs 72 h可显著降低SIRT1的表达,同时使p53和p21的表达升高(P<0.01)。不同剂量的Rut呈剂量依赖性恢复SIRT1的表达,并抑制Ang Ⅱ诱导的p53和p21表达上调,高剂量Rut(3 μmol·L-1)效果最明显(P<0.01)。提前加入CAPZ可消除或削弱Rut对这些蛋白的调节效应,见Fig 3。
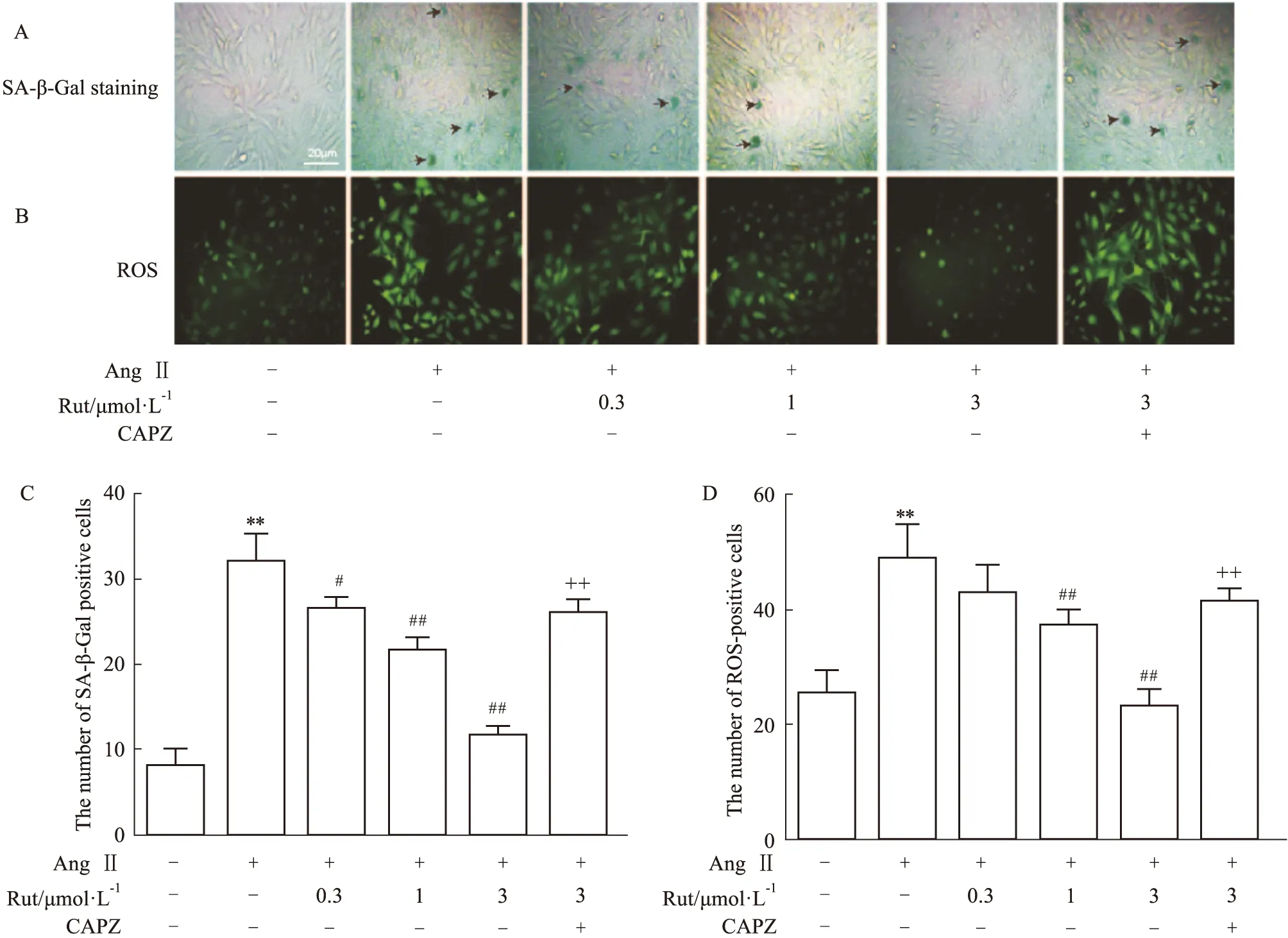
Fig 1 Rut inhibited premature senescence of VSMCs and ROS production induced by Ang n=6)**P<0.01 vs control group;#P<0.05,##P<0.01 vs Ang Ⅱ group;++P<0.01 vs Ang Ⅱ+ Rut (3 μmol·L-1)group.
2.4 TRPV1/AMPK通路介导吴茱萸次碱上调SIRT1表达的作用如Fig 4A和B所示,提前给予Compound C(AMPK抑制剂)能消除3 μmol·L-1Rut上调SIRT1的作用(P<0.01)。结果进一步证实(Fig 4C和D),与对照组相比,Ang Ⅱ可明显减少p-AMPK水平(P<0.01),Rut剂量依赖性地恢复p-AMPK的水平,提前加入CAPZ可部分消除Rut的这一作用(P<0.01)。

Fig 2 Effects of Rut on migration of VSMCs induced by Ang n=6)**P<0.01 vs control group;##P<0.01 vs Ang Ⅱ group;++P<0.01 vs Ang Ⅱ+Rut(3 μmol·L-1)group.

Fig 3 Rut regulated expression of SIRT1,p53 and p21 in VSMCs treated by Ang Ⅱ via activation of **P<0.01 vs control group;#P<0.05,##P<0.01 vs Ang Ⅱ group;+P<0.05,++P<0.01 vs Ang Ⅱ+Rut (3 μmol·L-1)group.

Fig 4 Involvement of TRPV1/AMPK pathway in regulation effects of Rut on SIRT1 n=6)**P<0.01 vs control group;#P<0.05,##P<0.01 vs Ang Ⅱ group;++P<0.01 vs Ang Ⅱ +Rut (3 μmol·L-1)group.
3 讨论
我国传统中药吴茱萸在临床用于治疗心血管疾病已有近百年历史,其主要成分Rut不仅能舒张血管产生降压效应[10],还可抑制VSMC增殖和表型转换,从而抑制血管重构。近年来VSMC衰老在高血压等疾病相关的血管老化中的作用日益收到重视,本研究进一步在Ang Ⅱ诱导的VSMC衰老模型观察Rut的保护作用。SA-β-Gal染色是检测细胞衰老的有效方法,衰老的细胞胞质内会生成大量蓝色物质。结果显示,加入1 μmol·L-1Ang Ⅱ到VSMC72 d可显著增加蓝染的衰老细胞数量,而预先给予吴茱萸次碱则可明显减少衰老细胞。细胞衰老往往伴随氧化应激反应增强,而产生过多的ROS又可进一步促进细胞发生衰老。本研究采用DCFH-DA荧光探针法检测ROS水平发现,Rut在抑制Ang Ⅱ引起的VSMC 衰老同时还明显抑制ROS生成。Rut的这一抗氧化效应在心肌细胞和单核细胞也有报道[11-12]。随年龄增长,VSMC的迁移能力也随之增强,从中膜迁移至内膜而导致血管壁重构,而Ang Ⅱ是促进这种衰老相关VSMC迁移的重要因素。本研究通过划痕愈合和Transwell实验进一步证实Rut还可明显抑制Ang Ⅱ引起的VSMC迁移。这些结果表明,Rut可显著抑制Ang Ⅱ引起的VSMC衰老和相关功能改变。
大量证据表明,SIRT1参与调节VSMC功能,被认为是药物抑制VSMC衰老的重要靶点。在Ang Ⅱ引起的高血压小鼠发现,SIRT1水平降低,而VSMC高表达SIRT1可降低血压,减轻由Ang Ⅱ引起的血管重构,抑制ROS生成和血管炎症。二甲双胍、白藜芦醇等SIRT1激活剂则可抑制Ang Ⅱ、高糖和动脉粥样硬化等因素诱导的VSMC衰老和功能紊乱[13]。文献报道SIRT1的抗衰老机制与抑制p53/p21有关[1]。SIRT1使p53乙酰化从而抑制其转录活性。p53是一种重要的衰老调节因子,能激活其下游基因p21,促进细胞衰老。p21是细胞周期依赖性激酶的广谱阻滞剂,能抑制细胞周期依赖性激酶(CDKs),阻止细胞从G1期进入S期和G2/M期。它被认为是细胞衰老的标志。此外,有证据表明SIRT1水平改变还可影响VSMC的迁移。Ox-LDL引起的VSMC源性的泡沫细胞迁移,与SIRT1水平降低有关,过表达SIRT1则可显著抑制VSMC的迁移和侵入[14],而白藜芦醇和辣椒素等药物可通过上调SIRT1水平可抑制VSMC迁移[15]。本研究结果表明,Ang Ⅱ可抑制SIRT1的表达,升高p53和p21的表达,不同剂量的Rut可剂量依赖性地恢复SIRT1的表达,同时抑制其下游p53和p21的表达上调。这些结果提示,Rut抗VSMC衰老和迁移作用与上调长寿蛋白SIRT1表达有关。
许多证据表明,Rut是TRPV1的激动剂[16],Rut的降压和抑制血管重构效应均与激活TRPV1有关[10]。本研究发现,预先给予TRPV1选择性抑制剂CAPZ可取消Rut上调SIRT1表达及抑制Ang Ⅱ诱导的VSMC衰老效应,表明TRPV1介导了Rut上调SIRT1的抗衰老作用。在Ox-LDL引起的VSMC源性泡沫细胞和前脂肪细胞中,TRPV1激动剂辣椒素能上调SIRT1的表达[14],提示TRPV1可能是调节SIRT1的重要靶点,但具体机制尚未阐明。腺苷酸活化蛋白激酶(AMPK)是维持细胞能量平衡的关键分子,是SIRT1的上游分子而调节其活性。运动、能量限制、及AMPK激活剂白藜芦醇等可均通过激活AMPK升高SIRT1的表达[17]。有研究报道,TRPV1引起的一些作用与AMPK途径有关[18],如TRPV1的激动剂辣椒素引发的VSMC自噬和脂肪细胞的褐化效应,与促进p-AMPK相关[9]。激活TRPV1后可促进细胞内钙生成,细胞内钙通过CaMKII途径激活AMPK。本研究发现,AMPK抑制剂Compound C可消除Rut上调SIRT1表达的作用。进一步检测AMPK的磷酸化水平发现,Ang Ⅱ可抑制p-AMPK,提前加入Rut能恢复p-AMPK水平,这一作用可被CAPZ部分取消。结果提示,Rut通过激活TRPV1促进p-AMPK,从而上调SIRT1表达。
综上所述,吴茱萸次碱可使SIRT1表达上调,抑制Ang Ⅱ诱导的VSMCs衰老和迁移,其机制涉及激活TRPV1/AMPK信号途径。