Ghrelin 对IBDV感染雏鸡法氏囊T 淋巴细胞浸润的影响
郭子强,崔梦幻,帅文娜,郭子凯,王秋霞,余燕
(河南科技学院动物科技学院,河南 新乡 453003)
鸡传染性法氏嚢病毒(Infectious bursal disease virus, IBDV)是鸡传染性法氏囊病(Infectious bursal disease,IBD)的病原,该病是雏鸡的一种急性、高度接触性传染病,于1957 年首次发现于美国特拉华州甘布罗镇的肉鸡群中,现已遍及全世界养禽业.IBDV 的主要靶器官是鸡特有的中枢免疫器官——法氏囊,当雏鸡IBDV 感染时,病毒在法氏囊B 淋巴细胞中复制,引起大量的B 淋巴细胞坏死、凋亡,产生免疫抑制,同时IBDV 还会造成多器官损伤,进而使鸡发病死亡.该病毒极其稳定,在环境中难以彻底清除,对养鸡业的危害除直接导致雏鸡死亡外,更重要的是感染该病毒的雏鸡能引起严重的免疫抑制,使鸡群对其他疾病如肝炎、球虫病、马立克、传染性喉气管炎、传染性支气管炎、沙门氏菌病和大肠杆菌病等易感性增加[1-7],对其他疫苗接种的免疫应答能力降低.我国作为家禽饲养总量位居世界第一的大国,自1979 年首次于广州出现此病以来,至今仍未全面得以控制,给养禽业造成重大经济损失.
IBDV 粒子是非囊膜、二十面体、双股RNA 病毒,属于双RNA 病毒科,禽双RNA 病毒属.基因组分为A、B 两个节段,A 节段编码VP2、VP3、VP4、VP5 四种蛋白;B 节段编码VP1 蛋白.虽然IBDV 的靶细胞是B 淋巴细胞,但并不是唯一的靶细胞,可能还有其他细胞也能被IBDV 感染.IBDV 通过口、鼻和眼等途径感染再被巨噬细胞吞噬,巨噬细胞随血液将IBDV 运输到法氏囊和其他周围组织[8].在IBDV 感染的急性阶段,病毒在法氏囊中的复制会引起大量的T 细胞浸润[9],尽管法氏囊中的T 细胞在体外受到IBDV 刺激后能够启动和增殖, 但已有充分的证据表明T 淋巴细胞并不是IBDV 的靶细胞,IBDV 不能在T 细胞内增殖[10].然而,浸润的T 细胞却能在法氏囊病毒感染早期(5 dpi 以前)抑制病毒增殖,但由于法氏囊受T淋巴细胞释放的细胞因子和细胞毒性的影响而促进了法氏囊的损伤和延迟组织修复[9].
Ghrelin 是Kojima 于1999 年从大鼠胃组织中分离提取的具有28 个氨基酸残基的脑肠肽,是生长激素促分泌素受体的内源性配基[11],也是具有多种生物学功能的小肽,在人和哺乳动物的免疫系统中具有促进T、B 淋巴细胞增殖[12-13]、调节细胞因子的表达和免疫细胞的功能[14-15]、抗炎及保护受损器官等作用[16-17].鸡的Ghrelin 由26 个氨基酸组成,与人和大鼠的Ghrelin 具有较高的同源性[18],然而鸡Ghrelin 在其免疫作用方面的研究报道较少.近年来本研究团队和其他研究者均发现家禽Ghrelin 在禽类免疫器官中广泛分布[19-23],当雏鸡IBDV 感染时,血浆中的Ghrelin 也异常升高[24],外源性添加Ghrelin 能降低IBDV感染雏鸡法氏囊炎性因子的表达,缩短法氏囊修复的进程[25],然而,Ghrelin 对法氏囊内T 细胞浸润的影响尚未见报道.本试验经过石蜡切片、HE 染色、免疫组化方法探讨了Ghrelin 对IBDV 感染雏鸡法氏囊指数、法氏嚢内T 淋巴细胞浸润和法氏嚢滤泡大小的影响,以期为Ghrelin 在鸡免疫系统中的功能提供基础资料.
1 材料和方法
1.1 动物处理及取材
将80 只1 d 龄SPF 雏鸡随机分为四组,每组20 只,其中一组为对照组(C 组).在饲养19 d(D19)时,其余三组分别通过点眼(50 μL)、滴鼻(50 μL)和肛门吸收(100 μL)接种实验室保存的IBDV(编号:19951128),所接种病毒的剂量为106.23EID50/0.1 mL.其中两组在雏鸡接种IBDV 前一天、接种当天和接种后两天,每100 g 雏鸡分别腹腔注射0.5 nmol(LG 组)和1.0 nmol 的Ghrelin(HG 组),剩下一组为I 组.在IBDV 感染后的第2 天(2 dpi)、第3 天(3 dpi)、第4 天(4 dpi),每天从各组分别随机挑选6 只雏鸡,称质量后腹腔注射戊巴比妥钠(1μg/g)麻醉,采用颈椎脱臼法处死,取法氏囊,生理盐水洗去血污后称质量,固定在质量分数为4%多聚甲醛中,HE 染色和免疫组织化学染色备用.
1.2 石蜡切片、HE 染色和免疫组织化学染色
将固定组织制作成石蜡切片,常规HE 染色.免疫组织化学染色按如下步骤:脱蜡复水后经过体积分数为的3%H2O2- 甲醇封闭、浓度为0.1 mol/L 柠檬酸钠修复、体积分数为5%的山羊血清封闭,然后鼠源CD3+一抗(体积比为1:200)4℃孵育过夜,HRP 标记的山羊抗小鼠I gG 室温孵育2 h,DAB 显色,镜检,观察.
1.3 数据统计
IPP(6.0)统计法氏嚢滤泡的大小和单位面积内CD3+阳性细胞的平均光密度值,数据均用平均值±标准偏差表示.所有数据采用SAS 软件进行多重比较,P≤0.05 为差异显著.
2 结果与分析
2.1 Ghrelin 对IBDV 感染雏鸡法氏囊指数的影响
法氏囊指数是法氏囊发育和功能的重要指标结果如图1 所示.
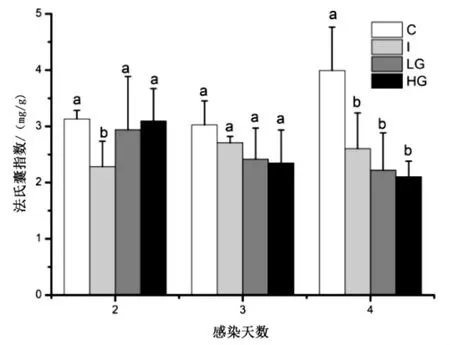
图1 Ghrelin 对雏鸡法氏囊指数的影响Fig.1 Effects of Ghrelin on Bursa of Fabricius index in chicks
由图1 可知,雏鸡IBDV 感染后法氏嚢指数普遍下调.2dpi 时,I 组法氏囊指数下降,为2.28±0.46,显著低于对照组(P <0.05),LG 和HG 组法氏囊指数与对照组相比差异不显著(P <0.05);3 dpi 时,不同处理组之间法氏囊指数没有显著差异(P<0.05);到了4 dpi 时,C 组法氏囊指数随着发育显著提高,然而I 组、LG组和HG 组法氏囊指数仍然下降,显著低于C 组(P<0.05),而感染组和添加Ghrelin 组之间法氏囊指数差异不显著(P <0.05).可见,雏鸡IBDV 感染时添加Ghrelin 对IBDV 感染雏鸡法氏嚢指数影响不显著.
2.2 Ghrelin 对IBDV 感染雏鸡法氏囊内T 淋巴细胞浸润的影响
不同处理组的法氏囊组织内T 淋巴细胞浸润情况如图2 所示,统计结果如图3 所示.整个试验期间,三个处理组法氏囊中T 淋巴细胞都不同程度的增加.2 dpi 时,HG 组法氏囊T 淋巴细胞的平均光密度值显著高于I 组与LG 组(P<0.05),但I 组和LG 组之间差异并不显著(P >0.05);3 dpi 时,HG、LG 和I 组的T 细胞的平均光密度值均低于2 dpi,但HG 组仍然显著高于LG 组和I 组(P <0.05),LG 组显著高于I组(P> 0.05);4 dpi 时,HG、LG 和I 组浸润性T 淋巴数量迅速下降,而且三者之间的差异不显著(P>0.05).因此,Ghrelin 在雏鸡IBDV 感染早期能促进T 淋巴细胞的浸润.
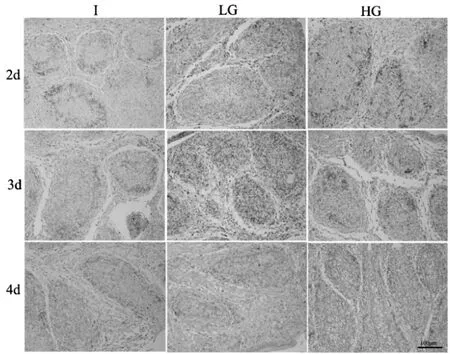
图2 不同处理组雏鸡法氏囊组织内T 淋巴细胞的浸润Fig.2 Infiltration of T lymphocytes in bursa of Fabry-Farsi of chicks in different treatment groups
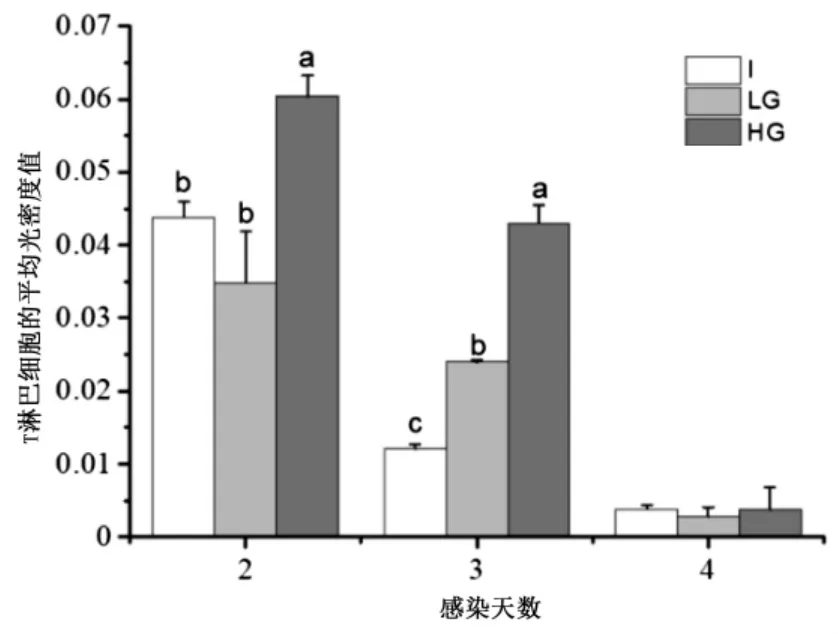
图3 不同处理组雏鸡法氏囊组织内浸润性T 淋巴细胞的平均光密度值Fig.3 Average optical density of infiltrating T lymphocytes in bursa of Fabricius of chicks in different treatment groups
2.3 Ghrelin 对IBDV 感染雏鸡法氏囊滤泡大小的影响
研究发现法氏囊滤泡大小与机体免疫活性密切相关[26],为此,通过HE 染色对不同处理组法氏囊滤泡进行了统计并进行了差异显著性分析,分析结果如图4 和图5 所示.结果表明:2 dpi 时,I 组法氏囊滤泡面积为38705.6±1466.7 μm2,与C 组相比显著下降(P<0.05),LG 组和HG 组法氏囊滤泡面积分别为45198.6±1305.3 μm2和42935.0±1909.7 μm2,显著高于I 组雏鸡法氏嚢滤泡(P<0.05);3 dpi 时,C 组法氏囊滤泡面积为61628.6±1330.6 μm2,显著高于其他三个处理组(P < 0.05),但HG组法氏囊滤泡面积显著高于I 组(P <0.05),而LG 组与I 组差异不显著(P>0.05);4 dpi 时,I 组法氏囊滤泡面积与其他三组相比仍然最小,为21440.7±1700.3 μm2,但LG 和HG 法氏囊滤泡面积显著低于C 组(P<0.05).可见,Ghrelin 添加能减轻雏鸡IBDV 感染导致的法氏嚢滤泡的损伤.

图4 不同处理组雏鸡法氏囊组织结构图示滤泡大小Fig.4 Follicular size of bursa of Fabricius of chicks in different treatment groups
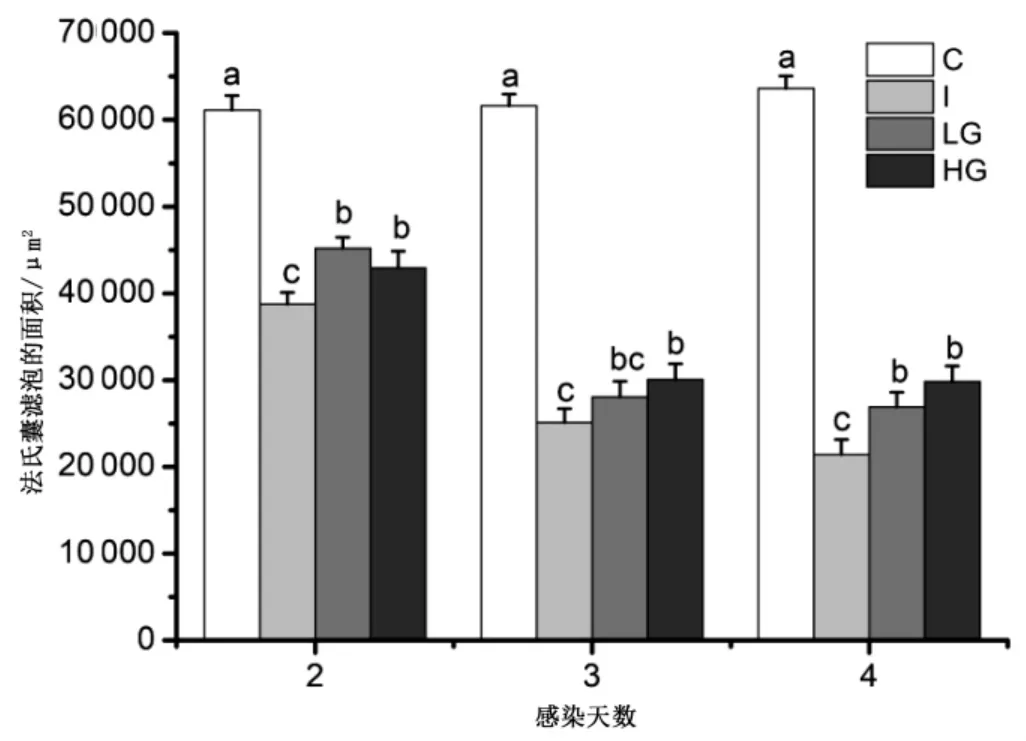
图5 不同处理组雏鸡法氏囊滤泡大小比较Fig.5 Comparison of the size of Fabricius of chicks in different treatment groups
3 结论与讨论
炎性细胞浸润是指组织细胞间质中出现炎性细胞如T 淋巴细胞、中性粒细胞和巨噬细胞的积聚现象,一般是宿主免疫反应的表现[27].本试验研究发现,三个处理组雏鸡IBDV 感染后,大量的T 细胞浸润到法氏嚢组织,其中2 dpi 时浸润的T 细胞数量最多,3 dpi 次之,4 dpi 全面减少.不同处理组之间比较结果显示,HG 组雏鸡在2 dpi 和3 dpi 时法氏囊内T 淋巴细胞数量均显著高于I 组和LG 组,LG 组雏鸡在3 dpi 时法氏囊内T 淋巴细胞数量也显著高于I 组,在4 dpi 时,三个处理组雏鸡法氏囊内T 淋巴细胞数量均迅速下降,且三者之间无显著差异.Rautenschlein 等[9]的研究认为雏鸡IBDV 感染时法氏囊内浸润的T 淋巴细胞在感染早期有利于病毒的清除,但由于T 细胞释放的细胞因子和细胞毒性的影响,浸润的T细胞在IBDV 感染晚期则具有损伤组织和延迟法氏囊修复的作用.本研究结果显示添加Ghrelin 组在IBDV感染的早期能趋化更多的T 细胞浸润,说明免疫反应强烈,这有利于IBDV 病毒的清除.Ghrelin 的半衰期为1 d,在雏鸡感染的3 dpi 时,Ghrelin 不再添加,结果发现在4 dpi 时,Ghrelin 添加组和IBDV 感染组一样,T淋巴细胞的数量迅速下降,这对减少法氏囊损伤更有利,也利于法氏囊组织的修复,因而合适的Ghrelin添加时间对法氏嚢组织的修复至关重要.
Ghrelin 是目前发现的唯一一个由外周器官分泌的肽激素,对哺乳动物具有促进摄食、调节能量代谢平衡、促进生长激素分泌与细胞增殖、参与脂类代谢和调节炎症反应等生物学功能[28].鸡的Ghrelin和哺乳动物一样也能够促进生长激素的分泌,但在摄食和脂肪代谢方面与哺乳动物截然不同[29-30],尤其对Ghrelin 在雏鸡病原感染中的功能研究报道较少.本试验中Ghrelin 促进IBDV 感染雏鸡法氏嚢T 淋巴细胞浸润,这与前人在大鼠胰腺炎疾病模型上研究的Ghrelin 能够抑制炎性细胞的浸润[31]并不一致,是否与Ghrelin 在鸡体内的功能与哺乳动物不同有关,还是与不同的病原有关需进一步研究.
IBDV 主要的靶细胞为法氏囊内IgM B 淋巴细胞,病毒在其内复制造成大量的IgM B 淋巴细胞坏死、凋亡,产生抗体的能力下降[6,32].无论是法氏囊中凋亡的B 淋巴细胞还是浸润的T 淋巴细胞产生的细胞因子均能引起法氏囊严重损伤及萎缩,说明IBDV 引起的法氏囊损伤和免疫抑制是密切相关的.然而,研究表明IBDV 造成的免疫抑制是可以减轻或逆转的,如通过食物添加精氨酸、共轭亚油酸及外源性注射B 细胞活化因子等调节和活化T、B 淋巴细胞,进而改善IBDV 诱导的免疫抑制[33-35].研究还表明免疫抑制减轻或逆转的程度与法氏囊滤泡损伤和修复程度有关,如Sharma 等[9]发现IBDV 感染后12-17 周接种破伤风类毒素产生的抗体滴度和法氏囊形态学恢复密切相关;Aihara 等[26]研究雏鸡法氏囊形态和免疫活性时发现,感染雏鸡法氏囊损伤越小,保留的原始滤泡越多,感染鸡的免疫活性越强.本研究发现,Ghrelin 添加组(LG 和HG 组)雏鸡法氏囊滤泡的面积在整个试验期间均大于IBDV 感染组(I 组),表明雏鸡IBDV 感染时添加Ghrelin 能减轻法氏嚢滤泡损伤,有助于减轻雏鸡IBDV 感染时导致的免疫抑制,提高其免疫活性.
因此,本研究通过在雏鸡IBDV 感染前后适时添加Ghrelin 能够瞬时趋化T 淋巴细胞的浸润,适时终止添加还能减轻法氏囊滤泡的损伤,这有利于原始滤泡的维持、提高雏鸡的免疫活性.

