基于增强T2*加权血管成像序列R2*图肿瘤全域纹理分析预测子宫内膜癌微卫星不稳定性
田士峰,刘爱连,2*,郭 妍,林 涛,陈丽华,王 楠,李 昕
(1.大连医科大学附属第一医院放射科,辽宁 大连 116011;2.大连市医学影像人工智能工程技术研究中心,辽宁 大连 116011;3.通用电气医疗,上海 200336)
微卫星不稳定性(microsatellite instability, MSI)指DNA复制过程中某些具有特定功能,如调控基因表达、保持基因组稳定等的小序列发生错配、插入及缺失等错误,且因错配修复系统功能存在缺陷而未得到及时修正,导致新等位基因累积[1]。MSI是基于癌症基因组图谱(The Cancer Genome Atlas, TCGA)的子宫内膜癌(endometrial carcinoma, EC)分子分型要素之一[2],亦是EC发病机制之一。明确判断EC MSI有利于筛查林奇综合征相关病例、评估程序性死亡分子1(programmed death 1, PD-1)/程序性死亡配体1(programmed death ligand 1, PD-L1)免疫治疗EC疗效及预测预后[3]。目前术后多采用免疫组织化学(简称免疫组化)方法检测EC肿瘤组织中的4种错配修复蛋白,即MLH-1、MSH-2、MSH-6和PMS-2表达情况,以确定MSI;而术前预测EC MSI为临床所期待。增强T2*加权血管成像(enhanced T2 star weighted angiography, ESWAN)序列是采用特殊重建算法的多回波3D T2*磁敏感技术,基于血氧水平依赖效应和不同组织之间的磁敏感性差异进行成像;经后处理可获得横向弛豫率图(R2*图),以定量反映组织的氧合水平[4]。利用纹理分析(texture analysis, TA)方法可系统提取肿瘤纹理特征,采用特定数学和统计学分析方法发掘肉眼无法识别的肿瘤异质性信息,并加以量化[5]。本研究评估基于术前R2*图的肿瘤全域TA预测EC MSI的价值,以期为临床实施精准个体化治疗提供参考。
1 资料与方法
1.1 一般资料 回顾性分析大连医科大学附属第一医院2017年6月—2019年12月38例经手术病理证实的女性单发EC患者术前盆腔MRI资料。纳入标准:①完善免疫组化检测项目,包括MLH-1、MSH-2、MSH-6和PMS-2指标,以其中1种或多种表达缺失为MSI、4项均表达为微卫星稳定(microsatellite stability, MSS);②无MR检查禁忌证,检查前未接受放射、化学治疗及其他治疗或穿刺活检、刮宫术等,并于其后2周内接受手术治疗;③MR图像质量良好,病灶最大径≥1.5 cm,病灶于3个层面中可见。38例中,12例为MSI(MSI组),年龄47~82岁,平均(64.1±9.8)岁;26例为MSS(MSS组),年龄35~78岁,平均(56.7±12.8)岁。检查前患者均签署知情同意书。
1.2 仪器与方法 检查前嘱患者禁食并适度饮水充盈膀胱。采用GE Signa HDxt 1.5T MR超导型扫描仪,配备体部8通道相控阵线圈,行盆腔扫描。轴位T1WI:TR/TE 680 ms/10 ms,NEX 2.0,矩阵320×192,层厚/层间距7.0 mm/2.0 mm,FOV 300 mm×300 mm,扫描时间84 s;轴位T2WI:TR/TE 5 600 ms/88 ms,NEX 3.0,矩阵228×224,层厚/层间距7.0 mm/2.0 mm,FOV 300 mm×300 mm,扫描时间161 s;ESWAN序列扫描:TR/TE 16.5 ms/2.1、5.1、8.0、10.9、13.8 ms,NEX 0.68,矩阵256×170,层厚/层间距8.0 mm/-4.0 mm,FOV 400 mm×400 mm,FA 12°,采集加速因子2,扫描时间38 s。
1.3 图像分割、纹理特征提取 将ESWAN序列原始图像导入GE AW4.6工作站,经后处理获得R2*图及其伪彩图,并以DICOM格式导入ITK-SNAP软件(www.itksnap.org);由分别具有7年及10年盆腔MRI诊断经验的主治医师各1名以盲法共同勾画病灶ROI[6],以T1WI及T2WI为参考,于R2*图上沿EC病灶边缘手动逐层勾画,包含出血、坏死及囊变区,经融合获得肿瘤全域感兴趣容积(volume of interest, VOI),见图1。之后应用人工智能A.K.软件(Artificial Intelligence Kit,GE Healthcare,China)提取VOI纹理特征,包括一阶统计、灰度共生矩阵(gray level co-occurence matrix, GLCM)、灰度游程矩阵(gray levelrun length matrix, GLRLM)及灰度区域大小矩阵(gray level sizezone matrix, GLSZM)共4类。

图1 患者女,58岁,中分化子宫内膜腺癌,MSI A.轴位T2WI(箭示病灶); B.轴位R2*伪彩图; C.轴位R2*图,红色区域为ROI
1.4 统计学分析及模型构建 采用SPSS 26.0统计分析软件。符合正态分布的计量资料采用±s表示,比较以独立样本t检验,计数资料比较采用Fisher精确检验。P<0.05为差异有统计学意义。
采用R Studio软件(版本3.3.2,http://www.Rproject.org)筛选纹理特征并构建模型,应用Spearman相关性分析对提取的全部特征进行第1次降维,选择与MSI状态相关系数>0.1的特征,同时剔除特征之间相关系数>0.9的特征;后以梯度提升决策树(gradient boosting decision tree, GBDT)进行第2次特征降维,基于最小损失函数原则筛选最优纹理特征,并构建多元logistic回归模型以预测EC MSI状态,绘制受试者工作特征(receiver operating characteristic, ROC)曲线评价模型的预测效能,并计算曲线下面积(area under the curve, AUC)、准确率、敏感度及特异度。
2 结果
2组EC患者一般资料差异均无统计学意义(P均>0.05),见表1。

表1 MSI组与MSS组EC患者一般资料比较
共提取74个纹理特征,包括18个一阶统计特征、24个GLCM特征、16个GLRLM特征和16个GLSZM特征;经Spearman分析得到30个纹理特征,再经GBDT降维筛选,最终得到6个最优纹理特征(表2),包括1个一阶统计特征、1个GLCM特征、2个GLRLM特征和2个GLSZM特征,以之构建多元logistic回归模型预测EC MSI,得到方程Y=-1.72×特征1+1.95×特征2+1.96×特征3+1.63×特征4+0.44×特征5+0.71×特征6-0.72。ROC曲线(图2)显示,logistic回归模型预测EC MSI的AUC、准确率、敏感度及特异度分别为0.95[95%CI(0.89,1.00)]、89.50%、83.30%及92.30%。
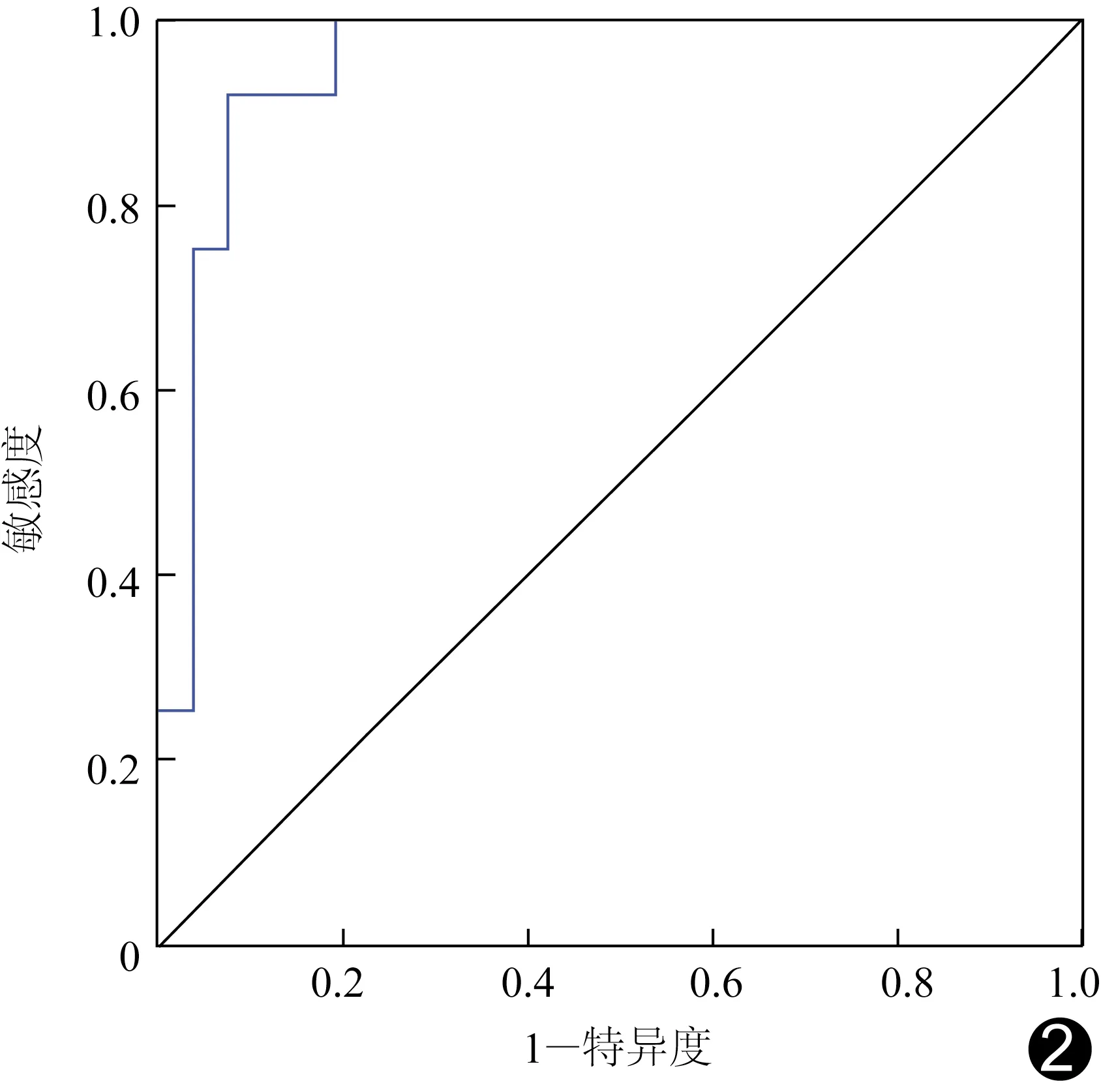
图2 回归模型预测EC MSI状态的ROC曲线

表2 经筛选最终得出的6个最优纹理特征
3 讨论
TA通过量化图像像素的灰度级变化、空间分布模式特点等,即采用特定方法提取肿瘤的纹理特征参数,以定量分析其内部异质性。目前TA相关EC研究主要集中于评估其病理特征及预后。既往研究[7-8]发现,基于MR T2WI、增强T1WI以及弥散加权成像(diffusion-weighted imaging, DWI)表观弥散系数(apparent diffusion coefficient, ADC)等图像的纹理特征参数能有效预测EC深肌层浸润、淋巴血管间隙侵犯和病理分级,但上述研究中的纹理特征仅指一阶统计特征,且均基于肿瘤最大层面、而非肿瘤全域提取特征,未能全面反映肿瘤内部异质性。YAMADA等[9]针对121例EC患者ADC图肿瘤全域VOI共提取45个纹理特征,分别应用21个与病理级别相关的纹理特征(含14个高阶特征)及11个与肿瘤复发生存率相关纹理特征(含7个高阶特征)建立随机森林模型,其预测EC高级别病理类型及无复发生存率的效能均高于单纯ADC。GHOSH等[10]观察基于弥散张量成像(diffusion tensor imaging, DTI)各向异性分数(fractional anisotropy, FA)和平均扩散率(mean diffusivity, MD)图的一阶统计特征评估EC病理特征的价值,发现根据均匀性、能量及熵等参数均可有效鉴别EC肌层侵犯程度(深、浅肌层)和病理类型(Ⅰ、Ⅱ型)。GLCM参数(能量、惯性矩、熵、相关性和逆差距)与EC细胞增殖抗原Ki-67表达存在相关性,以熵的相关性最强,提示对TA与EC免疫组化指标建立关联具有可行性[11]。
AHMED等[12]的研究结果显示,MSI EC增强T1WI肿瘤增强信号强度比率高于MSS EC。BHOSALE等[13]报道, Ⅰ期EC MS组Ⅰ与EC MSS组之间,小视野体素内不相干运动(introvoxel incoherent motion, IVIM)序列图像标准ADC、真弥散系数存在差异,但该研究样本量小(每组6例)。田士峰等[14]分析ESWAN序列多定量参数预测EC MSI的价值,结果提示EC MSI 的R2*值大于EC MSS、其T2*值则小于EC MSS,而二者幅度值及相位值差异均无统计学意义,提示R2*及T2*值诊断EC MSI的效能均偏低(AUC为0.797和0.787);但该研究仅于EC实质区勾画病灶ROI,而未包含肿瘤全域。本研究采用基于R2*图的肿瘤全域TA建立模型,于术前评估EC MSI,结果显示模型的诊断效能较高(AUC为0.952),表明所构建模型预测EC MSI具有一定价值,而肿瘤全域TA结果能更客观、真实、全面地体现肿瘤内部异质性。
EC MSI肿瘤组织内常含更多浸润淋巴细胞以及未分化复合物[15],使其单位体积内细胞数量和代谢水平均高于EC MSS,肿瘤组织耗氧增加,导致脱氧血红蛋白浓度增高和血氧饱和度降低, R2*图表现为EC MSI与EC MSS 之间图像纹理稀疏、规则及平滑均匀程度存在差异。既往研究[9]认为高阶特征较一阶特征更有利于检测肿瘤异质性。研究基于R2*肿瘤全域TA共提取74个一阶统计、GLCM、GLRLM及GLSZM纹理特征,包括56个为高阶特征;而后通过Spearman相关性分析和GBDT等方法进行特征降维,以合理降低冗余特征可能对模型造成过拟合效应,最终筛选出的6个最优纹理特征包括反映图像内体素强度分布的最大值、反映灰度空间相关特性的平方和、反映具备灰度值的像素在既定方向上连续出现频数的低灰度游程优势和游程熵、反映灰度值相同的联通区域大小的小区域低灰度优势和小区域优势[16],可全面反映MSI与MSS状态下EC的R2*图纹理的基元走向、深浅粗细度、非均匀与复杂程度、空间排列关系等多元化差异信息,所建模型预测EC MSI具有较高效能。
综上所述,基于ESWAN序列R2*图的TA对术前预测EC MSI具有一定价值,有助于临床制定个体化治疗方案。本研究的主要不足:①为单中心研究,且样本量偏小,有增加特征筛选偶然性的可能;②提取特征数偏少;③为提高VOI人工勾画的准确性,排除了体积较小的EC病灶,且界定各层面肿瘤边缘时存在主观影响。

