番茄红素对糖尿病肾病模型大鼠肾纤维化的影响*
刘艳峰
邯郸市中心医院,河北 邯郸 056001
糖尿病肾病(diabetic kidney disease,DKD)是糖尿病(diabetes mellitus,DM)患者最常见的并发症之一,是引发终末期肾病和糖尿病患者死亡的主要因素[1-2]。病理生理学研究发现,肾脏纤维化是DKD的重要病理机制,也是导致DM患者肾功能降低的主要因素之一[3-4]。因此,以抑制纤维化为治疗靶点对延缓DKD进展至关重要。番茄为药食两用植物,其主要活性成分番茄红素(lycopene,Lyc),具有良好的抗炎、抗氧化等多种生物学活性[5-7],对肝、肺纤维化具有抑制作用[8-9]。既往研究发现,Lyc能够通过抑制炎症反应和氧化应激对DM模型大鼠肾损伤有保护作用[10-11]。本研究旨在探讨Lyc对DKD模型大鼠肾脏纤维化的影响。
1 材料
1.1 动物60只清洁级雄性SD大鼠,7周龄,体质量210~240 g,购自河北医科大学实验动物学部,动物生产许可证号:SYXK(冀)2018-004,适应性饲养 7 d(室温25 ℃,相对湿度55%~65%,光照黑暗各 12 h 交替)后开展实验。本实验经医学伦理委员会审核批准,伦理批号:HDZXLL(K)字2020-012。
1.2 药物与试剂Lyc(南京泽朗生物科技有限公司,纯度≥96%,批号:ZL201900837a);二甲双胍(metformin,Met)(河北天成药业股份有限公司,批号:20200127);链脲佐菌素(美国Sigma公司,批号:024K1211);24 h尿蛋白量(urine protein,UPro)、血尿素氮(blood urea nitrogen,BUN)、肌酐(creatinine,SCr)试剂盒(深圳迈瑞生物医疗电子股份有限公司,批号:201912017、202003009、202001013);Masson染色试剂盒、ECL超敏发光试剂盒(南京建成生物工程研究所,批号:191230、190825);胶原蛋白I(Collagen I)、Collagen III、转化生长因子-β(TGF-β)、Smad2、磷酸化Smad2(p-Smad2)和β-actin抗体(北京博奥森生物科技有限公司,货号:bs-0578R、bs-0948R、bs-0086R、bs-52223R、bs-5618R、bs-0061R)。
1.3 仪器Sure Step Plus型血糖仪(美国强生公司);BS-300型全自动生化分析仪(深圳迈瑞生物医疗电子股份有限公司);CUT4062型石蜡切片机(德国SLEE公司);DYCZ-24DN型电泳仪、DYCZ-40D型转膜仪(北京六一生物科技有限公司);Chem Doc XRS型凝胶成像仪(美国Bio-Rad公司)。
2 方法
2.1 分组、动物模型制备与给药将60只SD大鼠随机选10只为正常对照组并给予常规饲料喂养;其余大鼠均给予高糖高脂饲料(常规饲料67.5%加20%蔗糖、10%猪油、2.5%胆固醇)喂养4周后禁食禁水12 h,腹腔注射浓度1%的链脲佐菌素30 mg·kg-1,72 h后检测血糖≥16.7 mmol·L-1,尿糖为+++或++++,即认定造模成功[12]。然后将模型大鼠随机分为模型组、(低、中、高剂量)Lyc组(10 mg·kg-1、20 mg·kg-1、40 mg·kg-1)组[13]和Met组(500 mg·kg-1)[14],每组10只,每日1次,连续灌胃给药8周,正常对照组和模型组灌胃同体积生理盐水,疗程8周。
2.2 检测大鼠体质量与血糖水平各组10只大鼠末次给药24 h后,分别称量体质量;由尾静脉采血,通过血糖仪测定空腹血糖水平。
2.3 检测大鼠UPro和血清BUN、SCr含量各组大鼠末次给药后,收集24 h尿液并采用磺基水杨酸法测定UPro水平;末次给药24 h后,腹腔注射水合氯醛实施麻醉,经腹主动脉取血,2 000 rpm离心 10 min,取血清,参照试剂盒说明通过全自动生化分析仪检测血清BUN、SCr含量。
2.4 观察大鼠肾脏病理学变化各组10只大鼠采集血标本后,脊椎脱臼出死并取双侧肾脏,其中左肾置于40 ng·L-1甲醛溶液中固定72 h,石蜡浸润包埋后行4 μm厚度连续切片,经二甲苯透明和梯度乙醇脱蜡后,行常规HE染色(苏木素溶液染色 5 min、1%盐酸乙醇分化30 s、0.5%伊红水溶液染色 3 min),梯度乙醇脱水和二甲苯透明后由中性树胶封固,然后通过光学显微镜观察肾脏病理性形态结构改变。
2.5 观察并计算胶原容积分数(collagen volume fraction,CVF)水平取“2.4”步骤制备的石蜡切片,经脱蜡水化后,高碘酸溶液氧化10min后PBS溶液冲洗,行Masson染色,PBS溶液冲洗苏木素染核,梯度乙醇脱水和二甲苯透明后中性树胶封片,然后通过光学显微镜观察肾脏纤维化程度(蓝色为阳性着色),通过图像分析系统检测CVF。
CVF=(胶原面积/视野总面积)×100%
2.6 Western Blot法检测大鼠肾脏相关蛋白表达取各组10只大鼠的右侧肾脏剪碎后加入4 ℃预冷裂解液,置于冰上裂解30 min,4 ℃、12 000 rpm离心20 min提取总蛋白,并通过BCA法检测总蛋白浓度,然后进行10% SDS-PAGE胶电泳行蛋白分离、湿法转PVDF膜、5%脱脂牛奶室温封闭2 h,洗膜后滴加目标蛋白、β-actin抗体4 ℃孵育12 h,洗膜后滴加二抗37 ℃孵育1 h,洗膜后滴加ELC发光剂后通过凝胶成像仪显示蛋白条带,以β-actin为内参,半定量目标蛋白表达。
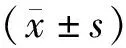
3 结果
3.1 各组大鼠体质量比较与正常对照组比较,模型组大鼠体质量显著降低(P<0.01);与模型组比较,低、中、高剂量Lyc组和Met组大鼠体质量显著升高(P<0.05;P<0.01);与Met组比较,高剂量Lyc组大鼠体质量显著升高(P<0.05)。见表1。
3.2 各组大鼠空腹血糖水平比较与正常对照组比较,模型组大鼠空腹血糖水平显著升高(P<0.01);与模型组比较,中、高剂量Lyc组和Met组大鼠空腹血糖水平显著降低(P<0.01)。见表1。
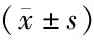
表1 各组大鼠体质量和空腹血糖水平
3.3 各组大鼠UPro和血清BUN、SCr含量比较与正常对照组比较,模型组大鼠UPro和血清BUN、SCr含量极显著升高(P<0.01);与模型组比较,中、高剂量Lyc组和Met组大鼠UPro和血清BUN、SCr水平显著降低(P<0.01);与Met组比较,高剂量Lyc组大鼠UPro和血清BUN、SCr水平显著降低(P<0.05)。见表2。
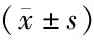
表2 各组大鼠UPro及血清BUN、SCr含量
3.4 各组大鼠肾脏病变比较正常对照组大鼠肾小管和肾小球形态结构均未见异常;模型组大鼠肾小管可见蛋白管型和细胞管型,肾间质淋巴细胞、单核细胞浸润,上皮细胞肿胀并呈现空泡变性,肾小球明显增大,可见系膜和基底膜增生、内皮细胞泡沫样变;与模型组比较,Lyc各剂量组和Met组肾小管和肾小球形态结构病变不同程度改善,且高剂量Lyc组和Met组效果优于其他组。见图1。

注:A:正常对照组;B:模型组;C:低剂量Lyc组;D:中剂量Lyc组;E:高剂量Lyc组;F:Met组
3.5 各组大鼠肾脏纤维化状况比较正常对照组大鼠肾间质可见少量胶原纤维;模型组肾小球内和肾间质可见大量胶原纤维沉积,肾小管基底膜可见胶原纤维;与模型组比较,Lyc各剂量组和Met组肾小球、肾小管及肾间质胶原纤维不同程度减少;高剂量Lyc组胶原纤维肾间质可见少量胶原纤维,效果优于其他组。与正常对照组比较,模型组大鼠肾脏CVF极显著升高(P<0.01);与模型组比较,低、中、高剂量Lyc组和Met组大鼠肾脏CVF极显著降低(P<0.01);与Met组比较,高剂量Lyc组大鼠肾脏CVF极显著降低(P<0.01)。见图2、表3。

注:A:正常对照组;B:模型组;C:低剂量Lyc组;D:中剂量Lyc组;E:高剂量Lyc组;F:Met组
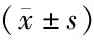
表3 各组大鼠肾脏CVF
3.6 各组大鼠肾脏Collagen I、Collagen III、TGF-β、Smad、p-Smad蛋白表达及p-Smad/Smad比值比较与正常对照组比较,模型组大鼠肾脏Collagen I、Collagen III、TGF-β、p-Smad蛋白表达上调且p-Smad/Smad水平显著升高(P<0.01);与模型组比较,中、高剂量Lyc组和Met组大鼠肾脏Collagen I、Collagen III、TGF-β、p-Smad蛋白表达下调且p-Smad/Smad水平降低(P<0.01);与Met组比较,高剂量Lyc组Collagen I、Collagen III、TGF-β、p-Smad蛋白表达下调且p-Smad/Smad水平显著降低(P<0.05;P<0.01)。见图3、表4。
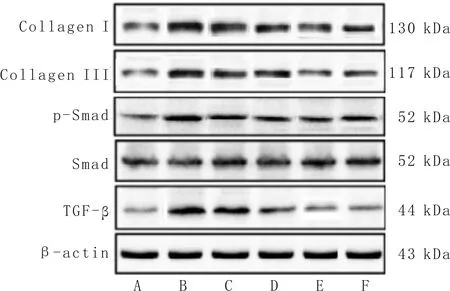
注:A:正常对照组;B:模型组;C:低剂量Lyc组;D:中剂量Lyc组;E:高剂量Lyc组;F:Met组
表4 各组大鼠肾脏Collagen I、Collagen III、TGF-β、Smad、p-Smad蛋白相对表达量及p-Smad/Smad水平比较
4 讨论
我国DM患病人数约1.4亿,其中30%~50%DM患者并发不同程度DKD,已成为威胁人们生命健康的主要慢性疾病之一[15-16]。研究发现,肾脏纤维化在DKD进展过程中发挥着重要作用,也是导致肾功能障碍和DKD患者死亡的主要原因[17-18]。因此,以抑制肾纤维化为治疗靶点抗DKD至关重要。
随着中医药发展战略的实施以及中药现代化研究的深入,中医药在DM防治方面应用逐渐广泛[19-21]。番茄为药食两用植物,其主要活性成分Lyc具有多种生物学活性。本研究发现,DKD模型大鼠肾小管可见蛋白管型和细胞管型,间质区可见炎性细胞浸润,上皮细胞肿胀并呈现空泡变性;肾小球内和肾间质可见大量胶原纤维沉积,肾小管基底膜可见胶原纤维,与郑小鹏等[22]和祁珊珊等[23]研究报道一致;给予Lyc或Met治疗8周能够明显提高DKD大鼠体质量、降低空腹血糖水平、改善肾功能指标(降低UPro和血清BUN、SCr含量),改善肾脏形态结构病变和肾脏纤维化,且高剂量Lyc(40 mg·kg-1)组优于Met组。
高血糖诱导细胞外基质过量生成是DKD肾纤维化的重要物质基础,从而改变肾脏结构并降低肾功能,Collagen I和 Collagen III是细胞外基质的主要构成成分[24-26]。研究发现,TGF-β/Smads通路在DM诱发肾纤维化过程中具有关键作用[27]。TGF-β 能够诱导Smads磷酸化(p-Smads)而被活化,刺激细胞外基质过量产生并抑制细胞外基质降解[28]。研究发现,通过药物抑制TGF-β/Smads通路能够明显降低肌成纤维细胞增殖和分化,下调Collagen I、Collagen III蛋白表达,从而缓解DKD肾纤维化[29-30]。本研究发现,给予Lyc或Met治疗8周能够明显下调DKD模型大鼠肾脏Collagen I、Collagen III、TGF-β、p-Smads蛋白表达并降低Smad磷酸化水平(p-Smad/Smad比值),并且高剂量Lyc组(40 mg·kg-1)对Collagen I、Collagen III、TGF-β、p-SMAD表达和p-Smad/Smad比值的调控作用优于Met组,本研究结果与李青云等[29]和刘宗亮等[28]研究报道一致。提示Lyc对DKD大鼠肾纤维化的抑制作用可能与调控TGF-β/Smads信号通路有关。
综上所述,Lyc对DKD大鼠肾纤维化具有抑制作用,可能与抑制TGF-β/Smad信号通路、下调Collagen I和Collagen III表达有关。但相关分子机制还需更加深入地研究。

