基于标准煎液的忘忧安神口服液量值传递相关性研究△
汪莉,贾妙婷,孙天雄,冯慧敏,李玥,何军刚,罗旭东,梁婷婷,强正泽,李成义
甘肃中医药大学,甘肃 兰州 730000
忘忧安神口服液是由甘肃中医药大学李成义教授临床经典验方开发而来的口服制剂,该方以经典名方甘麦大枣汤为基础方,由甘肃地产药材黄花菜、甘草等多味药食同源的中药组方而成,具有清心安神、化浊调脂的功效,在治疗情绪低落、失眠多梦、食欲不振等亚健康症状上具有较好的临床疗效。
2017 年10 月,国家食品药品监督管理局在《中药经典名方复方制剂标准煎液的申报资料要求(征求意见稿)》中,提出关于中药材、中药饮片与物质基准之间主要物质群量值传递研究的概念。在研究过程中,应以浸出物、含量测定、指纹图谱或特征图谱等为指标,进行中药饮片及对应实物间量值传递的分析[1]。近几年,量值传递研究方法在经典名方物质基准的研究及质量控制方面得以广泛应用[2-5],但并未与成品制剂制备过程中的技术经济指标评价相结合。研究表明,常规的提取、醇沉、浓缩、配剂等工艺过程均会导致制剂中活性成分的损失[6]。本研究遵循经典名方遵古溯源的研究思路[7],以水为溶媒,采用水提醇沉法,制备10 批忘忧安神方标准煎液及口服液。对其指纹图谱进行相似度评价、色谱峰指认及归属分析,初步确定标准煎液及口服液的出膏率、指标性成分含量及转移率的质量控制范围,研究忘忧安神口服液制备工艺过程中主要物质群量值传递相关性,探讨活性成分的损失原因及减少其损失的方法,并结合口服液制备过程中的技术经济指标,建立忘忧安神口服液制备工艺过程的评价方法,为忘忧安神口服液制备全过程的质量控制及其他复方制剂生产工艺过程的实施提供参考。
1 材料
1.1 仪器
1260 型二极管阵列检测器高效液相色谱仪(美国安捷伦科技有限公司);CAV214C 型电子分析天平(美国奥豪斯公司);TGL-20B-C型高速台式离心机(上海安亭科学仪器厂);YRE-301 型旋转蒸发仪(巩义市予华仪器有限责任公司);101 型电热鼓风干燥箱(北京科伟永兴仪器有限公司);Milli-Q Century型超纯水机(德国默克公司)。
1.2 试药
对照品栀子苷、甘草苷、槲皮苷、甘草酸铵(上海源叶生物科技有限公司,批号分别为:Y25J9C53637、Z28M10X84164、P19D10F106420、P13A9L67602)纯度均≥98%;甲醇、乙腈、磷酸均为色谱纯(天津市大茂化学试剂厂)。
处方中黄花菜购于各地药材市场,其余饮片均采购于各大零售药店。黄花菜在《中华人民共和国药典》(以下简称《中国药典》)2015 年版中未记载,经甘肃中医药大学药学院李成义教授鉴定为百合科萱草属植物黄花菜Hemerocallis citrinaBaroni的干燥花蕾;其余饮片均符合《中国药典》2015 年版规定,10 批标准煎液及10 批口服液均为实验室自制,各批标准煎液、口服液编号及其所对应栀子、甘草、合欢花饮片信息见表1。
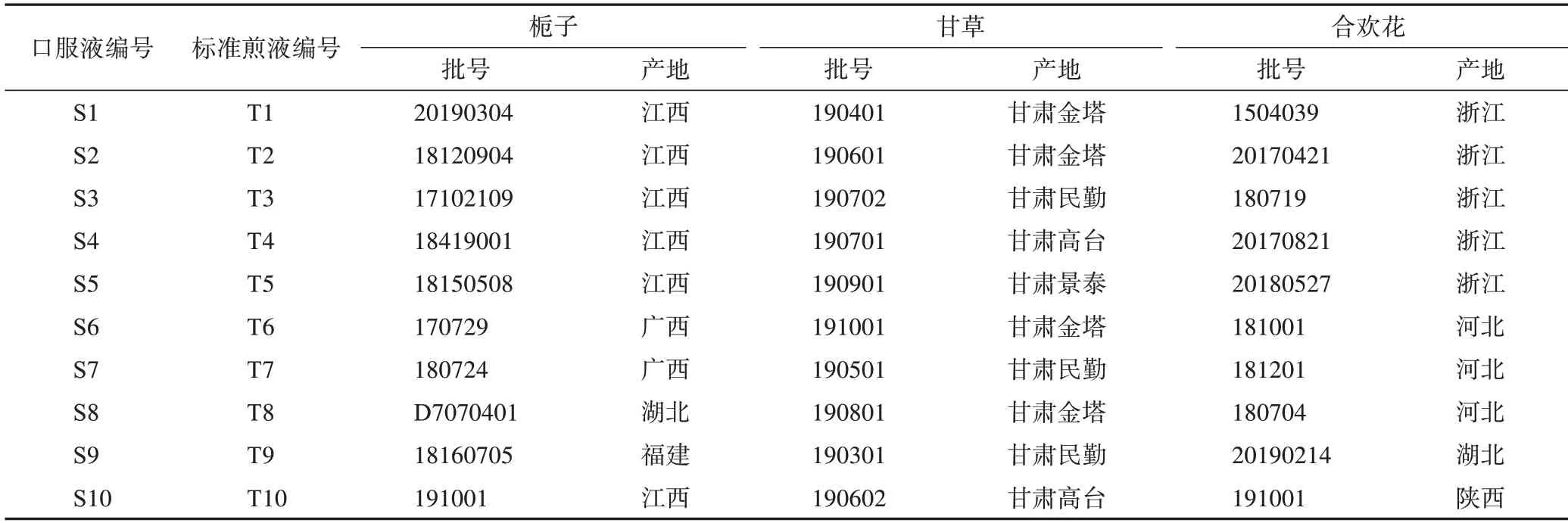
表1 忘忧安神方标准煎液、口服液及其对应栀子、甘草、合欢花饮片信息
2 方法
2.1 指纹图谱研究方法
2.1.1色谱条件 参照忘忧安神方前期研究[8]。
2.1.2供试品及对照品溶液的制备
2.1.2.1标准煎液样品制备 分别称取忘忧安神方处方饮片随机组方,按忘忧安神方前期研究的最佳提取工艺提取并制备标准煎液(0.31 g·mL-1以生药量计)T1~T10,冷藏备用。
2.1.2.2单味饮片制备 按照各单味药在全方中的配比,分别称取各单味药,按2.1.2.1项下方法制备,备用。
2.1.2.3阴性对照制备 分别称取除去各单味药的其余饮片,按2.1.2.1项下方法制备缺失各单味药的阴性对照溶液,备用。
2.1.2.4成品口服液样品制备 分别称取忘忧安神方处方饮片,10 批饮片随机组方,按口服液制备工艺制备得10批成品口服液S1~S10,精密量取成品口服液0.62 mL,加水定容至10 mL(0.31 g·mL-1以生药量计),备用。
2.1.2.5混合对照品溶液制备 分别精密称取对照品栀子苷、甘草苷、槲皮苷、甘草酸铵适量,加甲醇配制成分别含栀子苷614 μg·mL-1、甘草苷92 μg·mL-1、槲皮苷195 μg·mL-1、甘草酸铵210 μg·mL-1的混合对照品母液。吸取对照品母液1 mL,加甲醇定容至5 mL,制成分别含栀子苷122.8 μg·mL-1、甘草苷18.4 μg·mL-1、槲皮苷39 μg·mL-1、甘草酸铵46.4 μg·mL-1的混合对照品溶液,即得。
2.1.2.6供试品溶液制备 依次精密吸取2.1.2.1项下的10批标准煎液样品溶液、2.1.2.2项下的8个单味药材样品溶液,2.1.2.3项下的8 个阴性对照溶液,2.1.2.4项下的10 批成品口服液样品溶液,各2 mL,置于10 mL量瓶中,加入水定容至刻度,摇匀,5000 r·min-1离心10 min(离心半径为8 cm),取上清液,过0.45 μm 滤膜,即得标准煎液供试品溶液T1~T10、各单味药供试品溶液、缺各单味药的阴性对照溶液和成品口服液供试品溶液S1~S10。
2.1.3方法学考察
2.1.3.1精密度试验 精密吸取同一供试品溶液(S1),按2.1.1项下色谱条件连续进样6 次,记录色谱图,导入“中药色谱指纹图谱相似度评价系统”(2012年版),计算指纹图谱相似度。
2.1.3.2稳定性试验 精密吸取同一供试品溶液(S1),按2.1.1下色谱条件分别于0、2、4、8、12、24 h 进样,记录色谱图,导入“中药色谱指纹图谱相似度评价系统”(2012 年版),计算指纹图谱相似度。
2.1.3.3重复性试验 精密吸取6 份S1 的样品溶液,按2.1.2.6项下方法制备供试品溶液6份,再按2.1.1项下色谱条件进样,记录色谱图,导入“中药色谱指纹图谱相似度评价系统”(2012 年版),计算指纹图谱相似度。
2.1.4指纹图谱相似度评价、色谱峰归属及指认 分别精密吸取10 批全方标准煎液、10 批成品口服液、各单味药、各阴性样品和对照品供试品溶液,按照2.1.1项下色谱条件测定,记录图谱。测定结果以AIA 格式依次导入“中药色谱指纹图谱相似度评价系统”(2012年版)。分别以T1、S1为参照图谱,时间窗宽度为0.2 s,通过多点校正后,采用平均数相关系数法进行图谱自动匹配,根据峰匹配结果,以峰面积和保留时间为参数,分别计算出10 批标准煎液、10 批口服液及口服液与标准煎液的相似度;将各单味药、阴性对照、全方共有模式色谱峰进行匹配,同时比对各共有峰保留时间及紫外光谱图,确定各共有峰归属;对比标准煎液、口服液、混合对照品指纹图谱的出峰信息,进行色谱峰的指认。
2.2 指标成分转移率研究方法
2.2.1忘忧安神方含量测定色谱条件 参照前期文献研究忘忧安神方含量测定色谱条件[8]。
2.2.2供试品及对照品溶液制备
2.2.2.1供试品溶液制备 依次精密吸取2.1.2.1项下的10 批标准煎液样品溶液、2.1.2.4项下的10批成品口服液样品溶液各2 mL,置于10 mL 量瓶中,加入70%甲醇溶解并定容至刻度,超声处理(180 W,35 kHz)30 min,冷却至室温;70%甲醇再定容至刻度,摇匀,5000 r·min-1离心10 min(离心半径为8 cm),取上清液,过0.45 μm 滤膜,即得标准煎液含量测定供试品溶液T1~T10、成品口服液含量测定供试品溶液S1~S10。
2.2.2.2对照品溶液制备 精密量取2.1.2.5项下混合对照品母液适量,逐级稀释成质量浓度分别为30.7、61.4、12.8、245.6、491.2、614.0 μg·mL-1的栀子苷;4.6、9.2、18.4、36.8、73.6、92.0 μg·mL-1的甘草苷;11.6、23.2、46.4、92.8、185.6、232.0 μg·mL-1的甘草酸铵;9.75、19.50、39.00、78.00、156.00、195.00 μg·mL-1的槲皮苷的混合对照品溶液。
2.2.3方法学考察
2.2.3.1标准曲线的建立 取2.2.2.2项下混合对照品溶液,按2.2.1项下色谱条件进样,测定栀子苷、甘草苷、甘草酸、槲皮苷色谱峰面积,进行线性回归。
2.2.3.2精密度试验 取S1 供试品溶液,连续进样6 次,按2.2.1项下色谱条件进样检测,考察精密度。
2.2.3.3稳定性试验 取S1 供试品溶液,分别在0、4、8、12、24、36 h,按2.1.1项下色谱条件进样检测,考察稳定性。
2.2.3.4重复性试验 取S1 供试品溶液6 份,按2.2.1项下色谱条件进样检测,考察重复性。
2.2.3.5加样回收率试验 精密量取已知含量的S1 标准煎液2 mL,加入适量的各对照品溶液,按2.2.2.1项下方法制备,按2.2.1项下色谱条件进样检测,计算4种指标成分的加样回收率。
2.2.4指标成分含量测定方法 按照《中国药典》2015 年版(一部)栀子、甘草、合欢花的含量测定方法测定其对应饮片中栀子苷、甘草苷、甘草酸、槲皮苷的含量[9]。根据2.2.1项下色谱条件测定标准煎液及口服液样品中栀子苷、甘草苷、槲皮苷、甘草酸含量。
2.2.5指标成分转移率 根据2.2.4项下测定结果,计算各指标成分转移率。
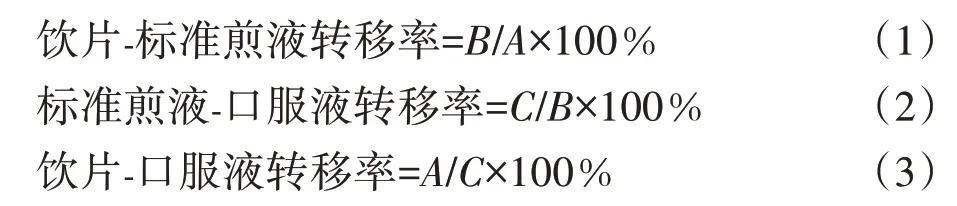
其中,A为饮片中指标成分质量分数;B为全方标准煎液中指标成分质量分数;C为全方口服液中指标成分质量分数。
2.3 出膏率及传递率研究方法
取2.1.2.1 项下的10 批标准煎液样品溶液,2.1.2.4项下的10 批成品口服液样品溶液测定出膏率。
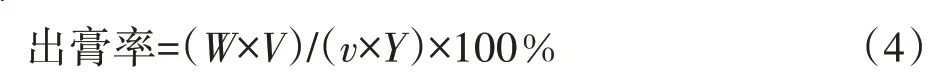
其中,Y为饮片投料量(g),V为全方标准煎液、口服液总体积,v为取样体积,W为所得干膏量;传递率为口服液出膏率与标准煎液出膏率的比值。
3 结果与讨论
3.1 指纹图谱研究
3.1.1方法学考察 精密度、稳定性、重复性试验中,得到的指纹图谱的相似度均在0.9以上,表明仪器精密度、样品在24 h内稳定性、方法重复性均良好。
3.1.2相似度评价 生成10 批标准煎液的高效液相色谱法(HPLC)指纹图谱及其共有模式图谱(R1,图1),10 批口服液的HPLC 指纹图谱及其共有模式图谱(R2,图2),进行相似度计算(表2~3)。结果显示,10 批标准煎液、10 批次口服液供试品色谱图与各自对照指纹图谱相似度分别为0.943~0.995、0.952~0.994,说明本品的各工序样品质量稳定性较好。以标准煎液的共有模式作为10批口服液S1~S10的参照图谱,10 批口服液指纹图谱与标准煎液共有模式图谱R1 相似度为0.760~0.889,两者之间的相似度差异主要由25号峰引起。经核对,口服液中25号峰为制剂成型过程中加入的防腐剂苯甲酸钠,即成品口服液中的苯甲酸钠,若在两者相似度评价时屏蔽25 号峰,则两者的相似度可达到0.9 以上,表明标准煎液主要药效物质群基本传递到了成品口服液中,成型工艺稳定可靠,可用于口服液生产。
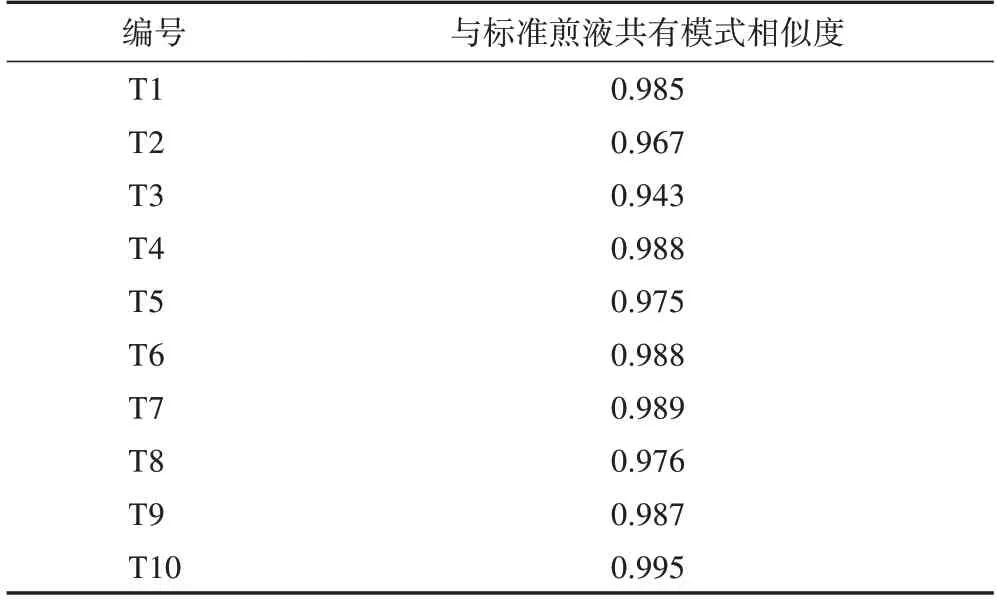
表2 10批忘忧安神标准煎液与其共有模式的相似度
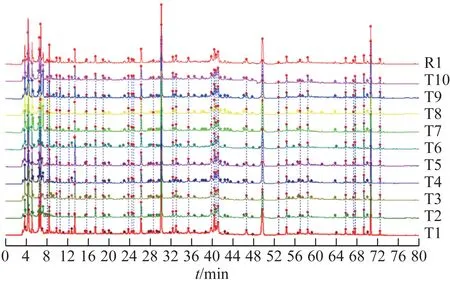
图1 10批忘忧安神方标准煎液指纹图谱及对照图谱
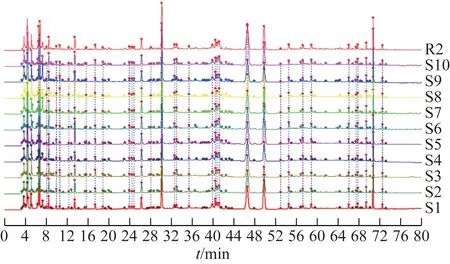
图2 10批忘忧安神口服液指纹图谱及对照图谱
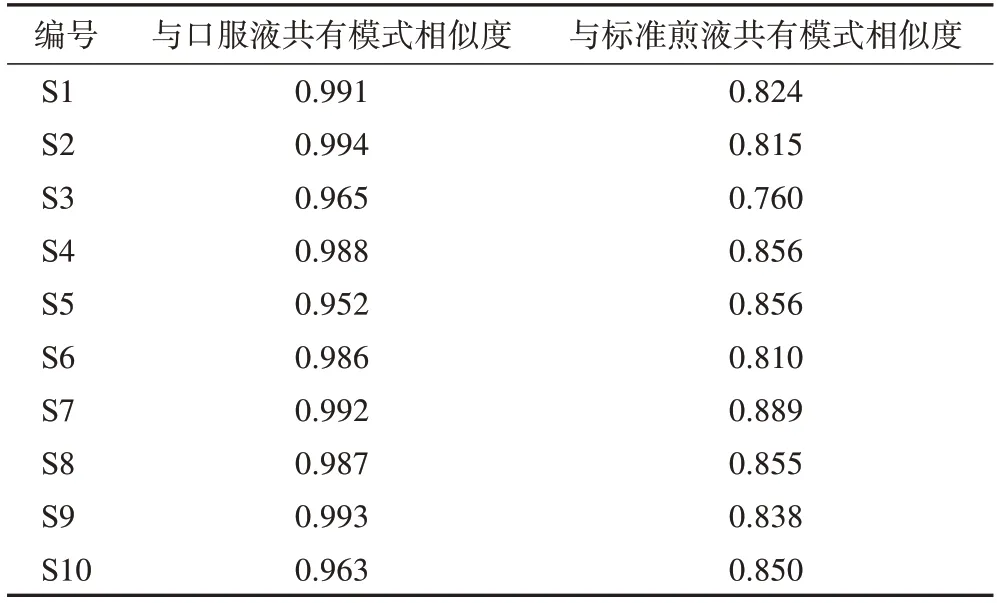
表3 10批忘忧安神口服液与其共有模式及标准煎液共有模式的相似度
3.1.3共有峰确立及指标成分标定 将标准煎液的共有模式、口服液共有模式图谱以及混合对照品图谱进行比较,见图3。通过与混合对照品图谱比对,确定17号峰对应栀子苷、24号峰对应甘草苷、26号峰为槲皮苷、35 号峰对应甘草酸。10 批标准煎液确定了36 个共有峰,10 批成品口服液确定了36 个共有峰,标准煎液中的各峰在口服液指纹图谱中均有体现,表明忘忧安神口服液成型工艺未造成标准煎液主要物质群丢失,标准煎液中各物质基本传递到口服液。同一批口服液中除25 号峰外,其他峰的峰面积整体<标准煎液,原因可能是口服液成型过程中浓缩纯化、pH 的改变等导致部分成分含量有一定损失。后期研究中可进一步对浓缩、纯化、pH 等关键工艺参数进行考察,通过优化调整工艺参数减少药效成分的损失,提高忘忧安神口服液有效成分含量与稳定性。
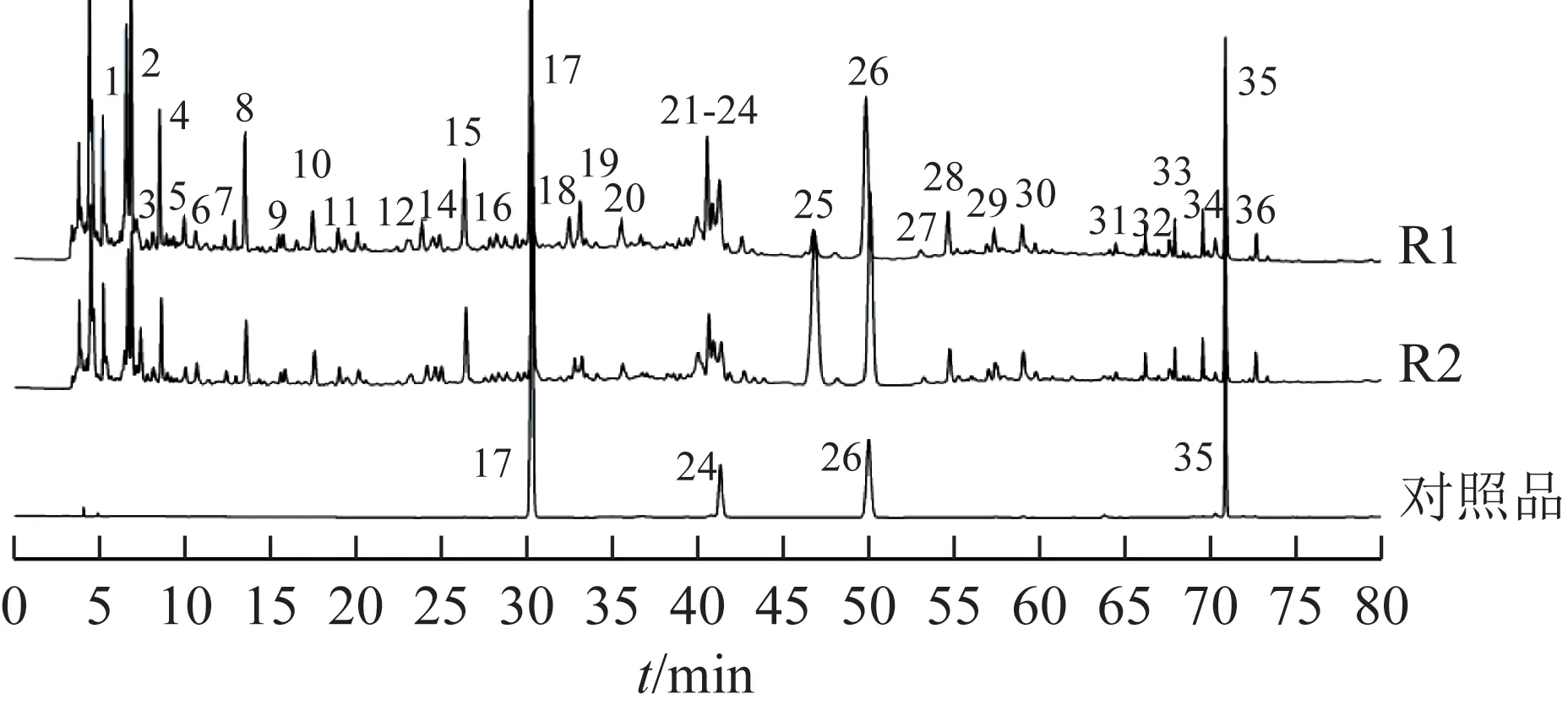
图3 忘忧安神方标准煎液、口服液与混合对照品HPLC 图
3.1.4色谱峰归属分析 各单味药对共有峰的贡献程度有所差异,其中君药黄花菜及栀子、甘草、合欢花4 味中药对共有峰贡献较大,共有峰中13、14号单独来源于黄花菜,16、23、24、30~36 号单独来源于甘草,11、15、17、28、29 号单独来源于栀子,26 号单独来源于合欢花,其他各味药虽然对共有峰贡献不大,但在标准煎液及口服液中也均有体现,提示忘忧安神口服液主要药效物质群从饮片-标准煎液-口服液能逐级完整传递。
3.2 指标成分含量及转移率
3.2.1含量测定方法学考察 方法学考察内容及结果见表4。结果显示,忘忧安神方中栀子苷、甘草苷、槲皮苷、甘草酸含量测定方法线性、仪器精密度、方法重复性、样品稳定性及方法加样回收率均良好。
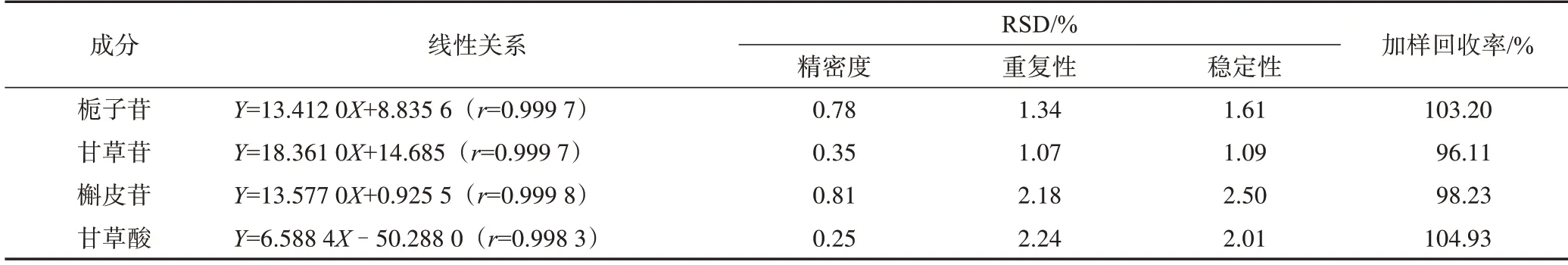
表4 忘忧安神方中指标成分含量测定方法学考察结果
3.2.2含量测定 饮片、标准煎液、口服液含量测定结果见表5~9,结果显示,不同批次栀子、合欢花饮片中栀子苷、槲皮苷平均质量分数分别为59.74、20.29 mg·g-1,RSD 分别为13.85%、25.58%,表明不同批次栀子、合欢花饮片质量存在差异;不同批次甘草饮片中甘草苷、甘草酸平均质量分数分别为7.44、32.87 mg·g-1,RSD 分别为3.82%、3.87%,表明不同批次的甘草饮片质量差异较小。10 批标准煎液中4 种指标成分的平均质量分数分别为45.90、5.16、19.01、9.96 mg·g-1,RSD 分别为14.61%、16.16%、7.90%、30.00%,10 批口服液中4 种指标成分的平均质量分数分别为38.47、3.86、14.24、9.18 mg·g-1,RSD 分别为19.41%、14.41%、10.13%、34.55%。
表5 10批栀子饮片中栀子苷含量测定结果(, n=3)mg·g-1

表5 10批栀子饮片中栀子苷含量测定结果(, n=3)mg·g-1
根据《古代经典名方复方制剂物质基准申报资料要求(征求意见稿)》,不同批次标准煎液及口服液的指标性成分含量及转移率应控制在其均值的70%~130%[10],在进行指标性成分的含量及转移率研究的过程中发现,部分批次标准煎液及成品口服液中槲皮苷的含量不在要求范围内(70%~130%),表明不同批次合欢花饮片质量差异较大,这与10 批合欢花饮片含量测定结果相符,建议在后续进行标准煎液及成品口服液的制备时,采取不同批次饮片混批投料的方式,以减小成品制剂批次间差异,确保忘忧安神口服液质量的稳定。
表6 10批甘草饮片中甘草苷、甘草酸含量测定结果(,n=3)mg·g-1
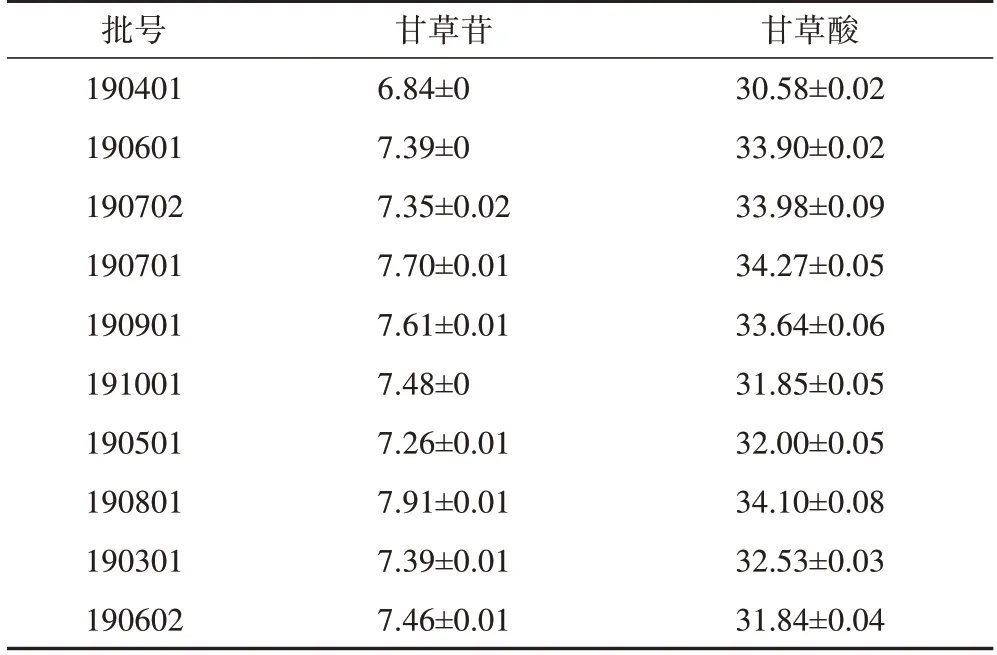
表6 10批甘草饮片中甘草苷、甘草酸含量测定结果(,n=3)mg·g-1
表7 10批合欢花饮片中槲皮苷含量测定结果(, n=3)mg·g-1

表7 10批合欢花饮片中槲皮苷含量测定结果(, n=3)mg·g-1
表8 10批忘忧安神方标准煎液4种成分含量测定结果(, n=3)mg·g-1
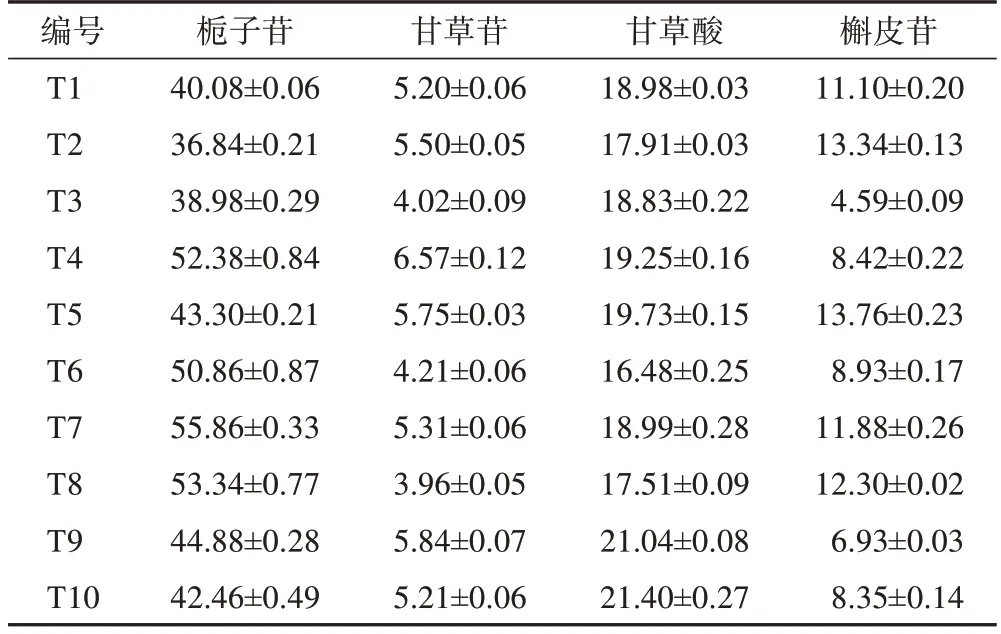
表8 10批忘忧安神方标准煎液4种成分含量测定结果(, n=3)mg·g-1
表9 10批忘忧安神口服液4种成分含量测定结果(, n=3)mg·g-1
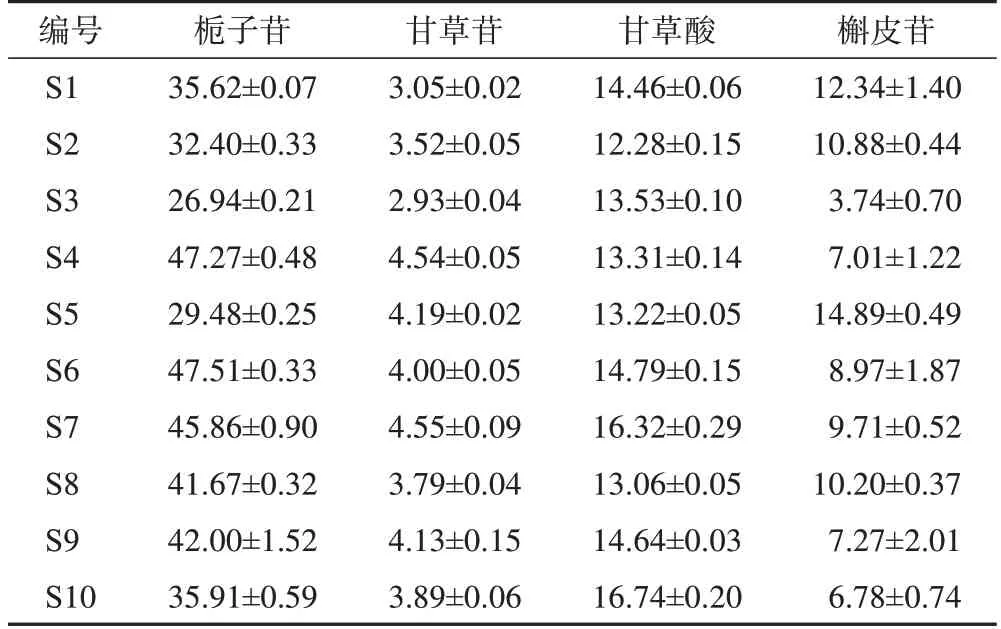
表9 10批忘忧安神口服液4种成分含量测定结果(, n=3)mg·g-1
3.2.3指标成分转移率 口服液生产过程中,饮片-标准煎液-口服液指标成分转移率结果见表10。结果显示,各生产环节间栀子苷、甘草苷、甘草酸、槲皮苷的平均转移率分别为饮片-标准煎液:77.35%、69.45%、57.95%、48.67%;标准煎液-口服液:83.60%、75.92%、75.08%、91.69%;饮片-口服液:64.30%、51.82%、43.48%、44.43%,其中,除了合欢花饮片-标准煎液槲皮苷的转移率偏低外,其他各成分在各产环节间的转移率均较高。有研究表明,槲皮苷在70%的甲醇或乙醇中具有较好的溶解性[11]。本研究为了尽可能保持传统工艺的完整性,在融合现代制备工艺特点的基础上,按照古代医籍记载方法,以水为溶媒制备标准煎液,这是导致槲皮苷从饮片至标准煎液的转移率偏低的主要原因,后期可考虑对提取工艺进一步优化,以提高槲皮苷转移率。而不同批次标准煎液及成品口服液中的栀子苷、甘草苷、甘草酸、槲皮苷的转移率均在要求范围内(70%~130%),说明实验前期标准煎液制备工艺及口服液的成型工艺可以实现栀子苷、甘草苷、甘草酸、槲皮苷含量的稳定传递。因此,暂定饮片-标准煎液4 种成分的转移率分别为61.65%~90.75%、49.99%~85.33%、51.35%~67.22%、40.26%~56.76%,标准煎液-口服液转移率分别为68.08%~93.58%、58.61%~95.81%、67.00%~89.75%、81.15%~111.20%。
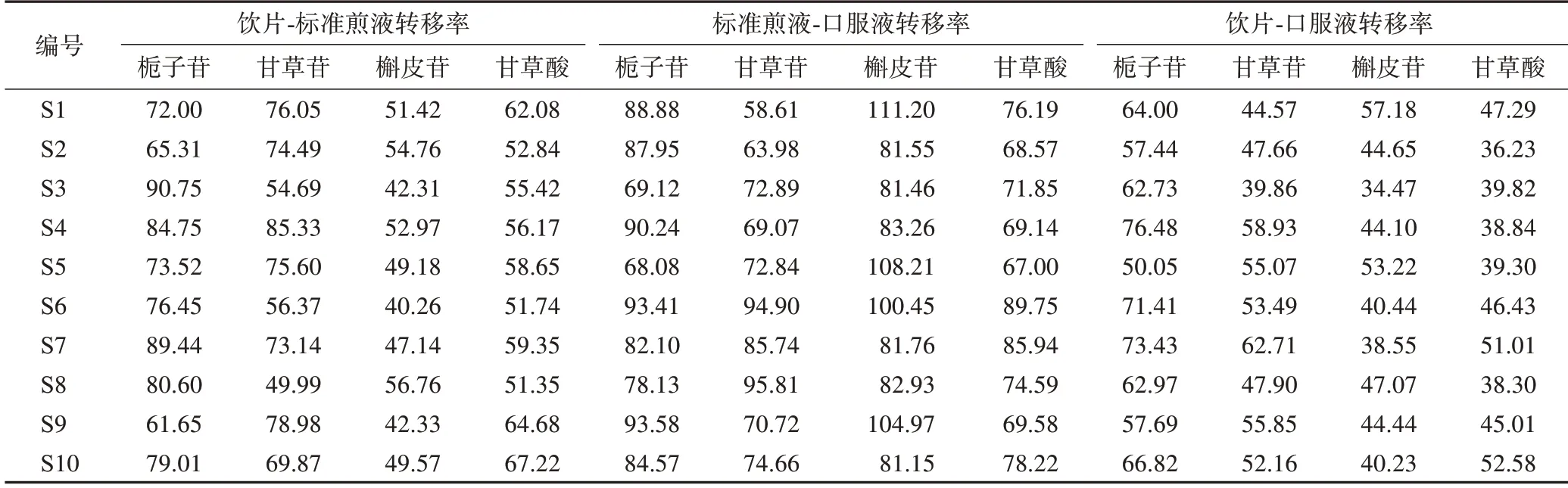
表10 饮片-标准煎液-口服液4种成分转移率%
3.3 出膏率及传递率
饮片-标准煎液-口服液出膏率及传递率结果见表11,10 批标准煎液、口服液的平均出膏率分别为31.56%、20.04%,RSD 分别为7.99%、7.94%;标准煎液-口服液出膏平均传递率为63.54%,RSD 为4.49%,均未出现离散数据(平均值的70%~130%以外)。说明忘忧安神方标准煎液及口服液制备过程的出膏率波动不大,出膏传递稳定,暂定标准煎液及口服液出膏率分别为28.79%~37.45%、18.30%~23.18%。
表11 饮片-标准煎液-口服液出膏率及传递率(, n=3)%
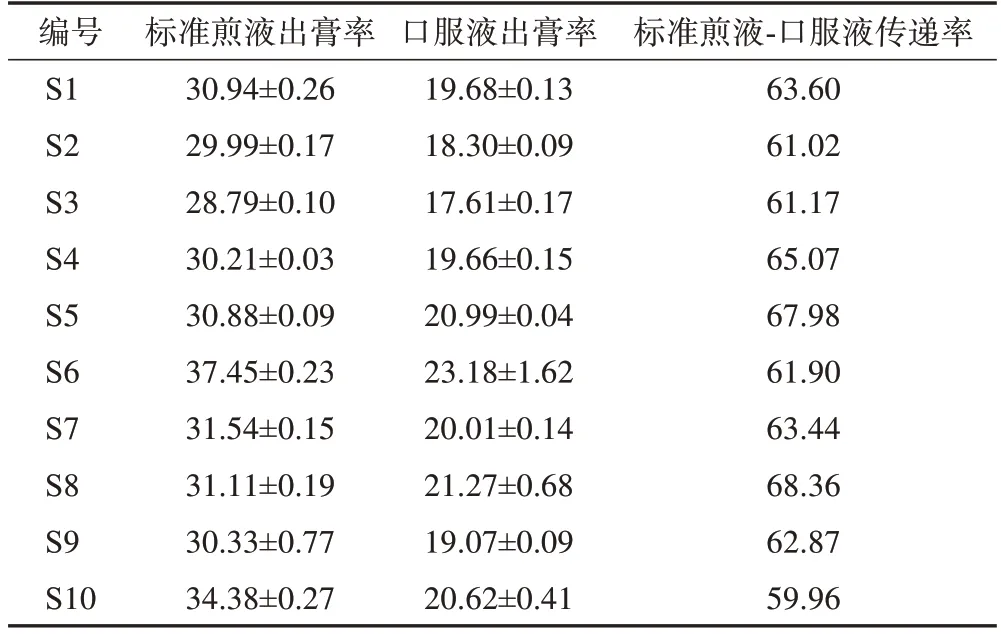
表11 饮片-标准煎液-口服液出膏率及传递率(, n=3)%
4 结论
忘忧安神口服液制剂处方由多种中药组成,化学成分复杂,要同时建立其指标成分含量测定方法及指纹图谱难度较大,为了最大程度反映其转移率高低及其药效物质群,本课题组前期研究反复考察了提取溶剂、检测波长、流动相系统,分别建立了其指标成分含量测定方法与指纹图谱研究方法,采用“出膏率+指标成分转移率+指纹图谱”与制备过程中技术经济指标相结合的模式,实现了指标成分及其他未知成分的全面控制。本研究对口服液生产的原料饮片-中间体-成品口服液的一系列生产环节进行量值传递规律分析及标准煎液和成品口服液的质量一致性评价,实时、全面地监控口服液生产过程中各成分的变化特征,明确了关键生产环节,保证了成品制剂的质量均一性及可溯源性,实现了口服液生产工艺的全过程质量控制,整体说明了忘忧安神口服液制备工艺具备较好的科学性与合理性,为口服液生产工艺过程的实施、成品口服液的质量控制及质量标准的研究提供了参考。后期研究可进一步对提取、醇沉、浓缩等影响活性成分转移率的工艺参数进行优化调整,减少活性成分的损失,提高忘忧安神口服液有效成分含量与稳定性。

