食品中金黄色葡萄球菌定量检测的不确定度评定
◎ 魏 敏,姜华军
(威海市食品药品检验检测研究院,山东 威海 264210)
金黄色葡萄球菌(Staphylococcus aureus,SA)是一种革兰氏阳性球菌,广泛分布于自然界中,人和动物是其主要携带者,通常寄生于人和动物的皮肤表面及鼻腔、咽喉等上呼吸道黏膜,也存在于空气、水、土壤等环境中[1]。金黄色葡萄球菌是一种常见的食源性致病微生物,其在适当的条件下能产生肠毒素,是引起食物中毒的主要原因[2-3]。金黄色葡萄球菌感染是世界性卫生难题,在美国等西方国家,由金黄色葡萄球菌引起的食物中毒占整个细菌性食物中毒的1/3,我国每年也有此类中毒事件发生[4]。
金黄色葡萄球菌污染的食品主要有乳制品、蛋制品及各类熟肉制品等[5]。《食品安全国家标准 预包装食品中致病菌限量》(GB 29921—2021)中规定了乳制品、肉制品等8大类食品中金黄色葡萄球菌的限量要求[6]。目前,对金黄色葡萄球菌的定量检测主要采用国家标准中的平板计数法。本文建立金黄色葡萄球菌定量检测的不确定度评定方法,分析确定影响检测结果的关键因素,并在实验过程中进行针对性的控制,提高检测结果的科学性和准确性。
1 材料与方法
1.1 材料与试剂
金黄色葡萄球菌标准菌种(CICC 21600,中国工业微生物菌种保藏管理中心);磷酸盐缓冲液、Baird-Parker琼脂、冻干血浆、脑心浸出液肉汤和血琼脂平板(北京路桥技术股份有限公司)。
1.2 仪器与设备
PRACTUM1102-1CN电子天平(德国Sartorius公司);Bagmixer 400SW拍击式均质器(法国Interscience公司);KB115培养箱(德国Binder公司);AB2-4S1生物安全柜(新加坡ESCO公司);GE60DF立式压力蒸汽灭菌器(厦门致微仪器有限公司)。
1.3 方法
依据《食品安全国家标准 食品微生物学检验 金黄色葡萄球菌检验》(GB 4789.10—2016)第二法金黄色葡萄球菌平板计数法进行检验,检验程序见图1[7]。称取25 g经检测为金黄色葡萄球菌阴性的乳粉样品,置于盛有225 mL磷酸盐缓冲液的均质袋中,加入20 μL麦氏浊度为0.5 MCF的金黄色葡萄球菌标准菌种菌悬液,用拍击式均质器拍打2 min,制成1∶10样品匀液。用1 mL无菌吸管吸取1∶10样品匀液1 mL,注入盛有9 mL磷酸盐稀释液的无菌试管中,振摇试管使其混合均匀,制成1∶100样品匀液。按上述操作步骤,制备10倍系列稀释样品匀液,每递增稀释1次,换1次1 mL无菌吸管。选择2个适宜稀释度的样品匀液,每个稀释度分别吸取样品匀液0.3 mL、0.3 mL、0.4 mL接种至3块Baird-Parker平板,涂布均匀后于(36±1)℃培养24~48 h。选取同一稀释度3个平板所有菌落数合计在20~200 CFU的平板,计数典型菌落数,并进行染色镜检、血浆凝固酶试验和溶血试验,报告结果。
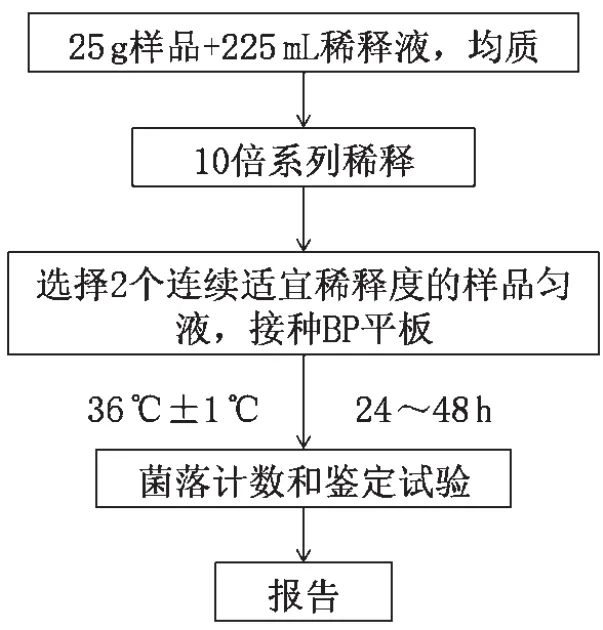
图1 金黄色葡萄球菌平板计数法 检验程序图
2 结果与分析
2.1 建立数学模型
数学模型如下:

式中:T为样品中金黄色葡萄球菌菌落数,CFU·g-1;A为某一稀释度典型菌落的总数,CFU·g-1;B为某一稀释度鉴定为阳性的菌落数,CFU·g-1;C为某一稀释度用于鉴定试验的菌落数,CFU·g-1;d为稀释因子。
2.2 不确定度分量的主要来源
通过对实际检测过程和数学模型进行分析,不确定度的主要来源有5个方面。①样品称量过程引入的不确定度。②样品定容过程引入的不确定度。③逐级稀释过程引入的不确定度。④接种Baird-Parker平板时引入的不确定度。⑤重复检测引入的不确定度。
2.3 不确定度分量的评定
2.3.1 样品称量过程引入的不确定度评定
本实验用感量为0.01 g的电子天平称取25.00 g样品,重复称量10次,样品质量均为25.00 g,因此不考虑称量重复性引入的不确定度。样品称量引入的不确定度主要有2个来源,分别是天平校准和可读性(分辨力)引入的不确定度。①校准。根据天平的检定证书和《电子天平检定规程》(JJG 1036—2008)[8],感量为0.01 g的电子天平在0~500 g最大允许误差为±0.05 g,区间半宽度为0.05 g,按矩形分布,天平校准引入的标准不确定度为②可读性。天平的分辨力为0.01 g,区间半宽度为0.005 g,按矩形分布,天平可读性引入的标准不确定度为因此,样品称量过程引入的相对标准不确定度为urel(称量)=
2.3.2 样品定容过程引入的不确定度评定
本实验用250 mL量筒量取225 mL无菌磷酸盐缓冲液加入到均质袋中,制备1∶10样品匀液,定容过程引入的不确定度包括量筒校准引入的不确定度、温度引入的不确定度。①校准。根据《常用玻璃量器检定规程》(JJG 196—2006)[9],250 mL量出式量筒在20 ℃时的容量允差为±2.0 mL,按矩形分布,校准引入的标准不确定度为②温度。《常用玻璃量器检定规程》(JJG 196—2006)规定的是量筒在20 ℃时的容量允差,实验室环境温度为(20±2)℃,偏差为±2 ℃,水的体积膨胀系数为2.1×10-4/℃,因此温度偏差产生的溶液体积变化为±(225×2×2.1×10-4)=±0.094 5 mL,按矩形分布,温度引入的标准不确定度为:
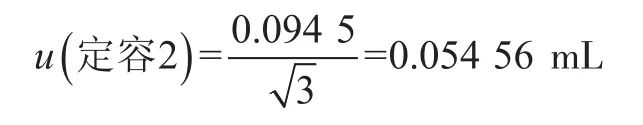
因此,样品定容过程引入的相对标准不确定度为:
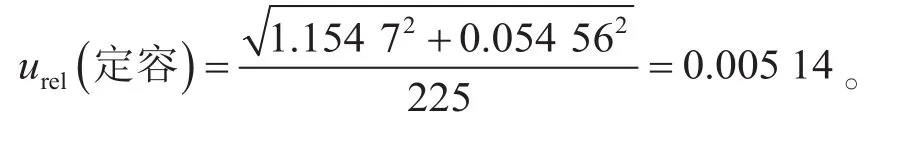
2.3.3 逐级稀释过程引入的不确定度评定
(1)吸取样品匀液时1 mL吸量管引入的不确定度。本实验逐级稀释过程采用1 mL吸量管吸取1 mL样品匀液,其引入的不确定度包括校准和温度2个方面。①校准。《常用玻璃量器检定规程》(JJG 196—2006)规定,20 ℃时1 mL流出式分度吸量管(A级)的容量允差为±0.008 mL,按矩形分布,校准引入的标准不确定度为②温度。实验室环境温度偏差产生的溶液体积变化为±(1×2×2.1×10-4)=±4.2×10-4mL,按矩形分布,温度引入的标准不确定度为因此,1 mL吸量管引入的相对标准不确定度为:
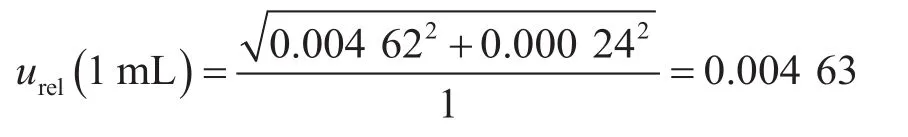
(2)吸取稀释液时10 mL吸量管引入的不确定度。本实验逐级稀释过程采用10 mL吸量管吸取9 mL磷酸盐稀释液,其引入的不确定度包括校准和温度2个方面。①校准。《常用玻璃量器检定规程》JJG 196—2006规定,20 ℃时10 mL流出式分度吸量管(A级)的容量允差为±0.05 mL,按矩形分布,校准引入的标准不确定度为②温度。实验室环境温度偏差产生的溶液体积变化为±(9×2×2.1×10-4)=±0.003 78 mL,按矩形分布,温度引入的标准不确定度为:
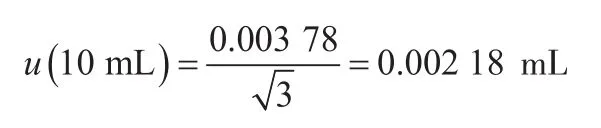
因此,10 mL吸量管引入的相对标准不确定度为:
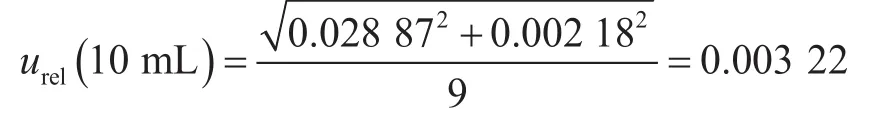
(3)逐级稀释过程的合成标准不确定度。进行1次逐级稀释使用1次1 mL和10 mL吸量管,其引入的标准不确定度为由 于10倍 系列稀释方法相同,故整个稀释过程的标准不确定度为10倍系列稀释的次数。本实验最终采用的是1∶1 000稀释度的平板进行菌落计数,因此进行了2次10倍系列稀释,q=2,逐级稀释过程引入的标准不确定度为
(4)接种Baird-Parker平板时引入的不确定度评定。接种过程使用1 mL吸量管吸取1 mL样品匀液以0.3 mL、0.3 mL、0.4 mL接种量分别加入3块Baird-Parker平板。其引入的不确定度包括校准和温度2个方面,计算方法同2.3.3中(1),则接种0.3 mL和0.4 mL样品匀液引入的相对标准不确定度分别为:

因此,接种Baird-Parker平板时引入的标准不确定度为
(5)重复检测引入的不确定度评定。在相同条件下对同一样品重复测10次,由于金黄色葡萄球菌检测结果的发散性比较大,直接按贝塞尔公式计算样本标准差不合理,因此本研究将检测结果转换为对数值后进行计算,检测结果见表1[10-12]。
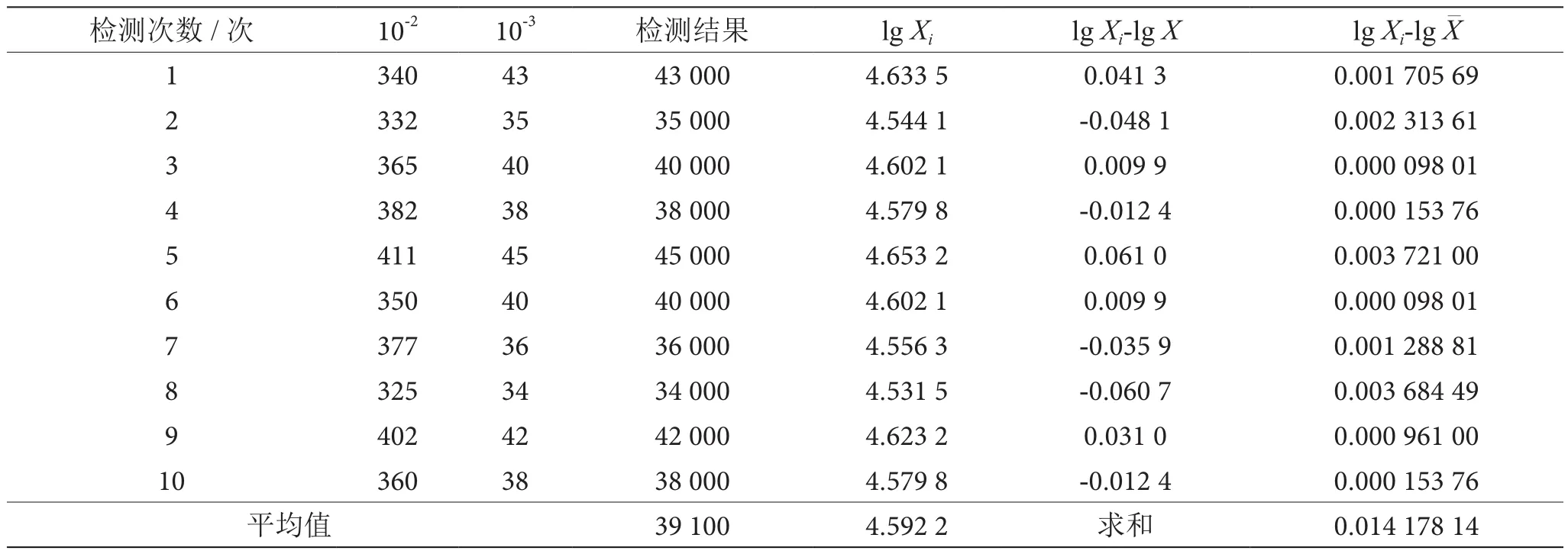
表1 乳粉中金黄色葡萄球菌定量检测结果表
采用贝塞尔公式法计算重复检测引入的标准不确定度为:
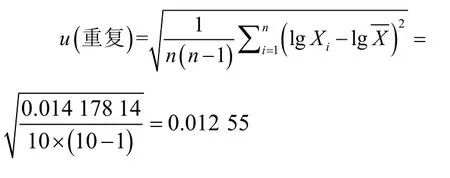
2.4 计算合成标准不确定度
以上各不确定分量是相互独立的,计算合成标准不确定度为:

2.5 计算扩展不确定度
根据《测量不确定度评定与表示》(JJF 1059.1—2012)[13],取置信概率p=95%,自由度v=10-1=9,由t分布表可得包含因子k=2.26,故扩展不确定度为U=k×uc(T)=2.26×0.029 31=0.066 2。
2.6 结果报告
样品中金黄色葡萄球菌检测结果的对数值lgX=4.592 2±0.066 2,k=2.26。取反对数后得到金黄色葡萄球菌定量检测结果的取值为33 574~45 541 CFU·g-1,修约后为34 000~46 000 CFU·g-1。
3 结论与讨论
本研究按照GB 4789.10—2016平板计数法对人工染菌的乳粉样品进行金黄色葡萄球菌的定量检测,并对检测过程中的不确定度进行分析和评定,不确定度来源主要有样品称量、样品定容、逐级稀释、接种及重复检测引入的不确定度。由于本实验采用添加阳性菌株制备人工染菌样品,鉴定为阳性的菌落数与用于鉴定实验的菌落数的比值(即B/C)均为1,因此未考虑鉴定实验引入的不确定度。根据各不确定度分量的评定结果,接种Baird-Parker平板引入的不确定度贡献最大,其次是重复检测引入的不确定度。重复性检测引入的不确定度主要受操作人员、检测环境、培养温度、培养时间、菌落计数和样品均匀性等因素的影响,属于A类不确定度,可用统计分析的方法进行评定,本研究采用了贝塞尔公式法进行评定[14]。实验室可根据测量不确定度的评定结果,从人员、仪器设备、培养基和试剂、检验方法和环境条件等方面加强控制,最大限度降低不确定度,提高检测结果的准确性和可靠性。
通过对金黄色葡萄球菌检测不确定度的评定,分析和评价影响检测结果的关键因素,可为实验室风险管理和质量控制提供指导,有效提高实验室质量管理水平。当检测结果在标准限量值附近时,结合测量不确定度判定产品是否合格更科学和准确[15]。

