姜黄素联合阿托伐他汀对溃疡性结肠炎小鼠的保护作用及机制研究
杨坤 孟捷 高霞 王婷玉 韩自荣 梁宇花


摘要 目的:研究姜黃素联合阿托伐他汀对溃疡性结肠炎小鼠的保护作用及其作用机制。方法:将小鼠随机分为对照组、模型组、姜黄素组、阿托伐他汀组和联合组,每组8只。除对照组小鼠外,其余小鼠使用5% DSS诱导溃疡性结肠炎小鼠模型。造模第1天开始灌胃给药,姜黄素组灌胃60 mg/kg姜黄素悬液,阿托伐他汀组灌胃10 mg/kg阿托伐他汀混悬液;联合组灌胃60 mg/kg姜黄素悬液和10 mg/kg阿托伐他汀混悬液,对照组和模型组小鼠灌胃生理盐水,连续给药7 d。观察并记录各组小鼠DAI评分,比较结肠长度;ELISA法检测炎症介质水平和氧化应激水平;透射电镜观察结肠组织中自噬体;WB检测自噬相关蛋白表达情况。结果:与模型组和单独用药组比较,联合组小鼠DAI评分明显降低,结肠长度明显增加;血清中TNF-α、IL-1β、IL-6含量明显降低,IL-10含量明显升高;结肠组织中,髓过氧化物酶(MPO)、丙二醛(MDA)水平明显降低,而超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GPX-Px)水平明显升高;可以观察到的自噬体的数量增加,p62蛋白表达水平明显降低,Beclin1蛋白水平和LC3Ⅱ/LC3Ⅰ明显升高,差异均有统计学意义(均P<0.05)。结论:姜黄素联合阿托伐他汀可以通过调控自噬相关蛋白表达水平,控制氧化应激水平,对溃疡性结肠炎小鼠起到治疗和保护作用。
关键词 姜黄素;阿托伐他汀;联合用药;炎症反应;氧化应激;自噬;自噬相关蛋白;溃疡性结肠炎
Protective Effects and Mechanisms of Curcumin Combined with Atorvastatin on Ulcerative Colitis in Mice
YANG Kun1,2,MENG Jie1,GAO Xia1,WANG Tingyu1,HAN Zirong1,LIANG Yuhua1
(1 Department of Spleen,Stomach,Hepatobiliary,Oriental Hospital,Beijing University of Chinese Medicine,Beijing 100078,China; 2 Beijing University of Chinese Medicine,Beijing 100029,China)
Abstract Objective:To study the protective effects of curcumin combined with atorvastatin on ulcerative colitis(UC) in mice and its underlying mechanisms.Methods:The mice were randomly divided into a control group,a model group,a curcumin group,an atorvastatin group and a combination group,with eight mice in each group.Except for the control mice,the other mice used the 5% DSS-induced ulcerative colitis mouse model.On the first day of modeling,rats were intragastrically administered with curcumin 60 mg/kg suspension and atorvastatin 10 mg/kg suspension,respectively.The rats in the combination group were intragastrically administered with 60 mg/kg curcumin suspension and 10 mg/kg atorvastatin suspension,and the mice in the control group and model group were intragastrically administered with normal saline once daily,1 mL each time,for 7 consecutive days.The DAI score of each group was observed and recorded,and the colon length was compared.The levels of inflammatory factors and oxidative stress were detected by ELISA.The autophagosomes in colonic tissues were observed by transmission electron microscopy.The expression of autophagy-related proteins was detected by WB experiment.Results:Compared with the model group and the medication group alone,the DAI score of the mice in the combination group was significantly reduced,and the colon length was significantly increased.The contents of serum TNF-α,IL-1β and IL-6 were significantly reduced,while the content of IL-10 was significantly increased.The levels of MPO and MDA in the colon tissue were significantly decreased,while the levels of SOD and GSH-Px were significantly increased.The number of autophagosomes increased,the expression level of p62 protein was significantly reduced,and the protein levels of Beclin1 and LC3Ⅱ/LC3Ⅰ were significantly increased(Ps<0.05).Conclusion:Curcumin combined with atorvastatin can control the level of oxidative stress by regulating the expression of autophagy-related proteins,so as to have a therapeutic and protective effect on ulcerative colitis mice.
Keywords Curcumin; Atorvastatin; Combination therapy; Inflammatory reactions; Oxidative stress; Autophagy; Autophagy-related protein; Ulcerative colitis
中图分类号:R284;R573.1文献标识码:Adoi:10.3969/j.issn.1673-7202.2022.02.007
溃疡性结肠炎(Ulcerative Colitis,UC)是目前常见的一种炎症性肠病,具有病程长,反复发作,且长期患病易导致结肠癌的特点。该病发病机制目前尚不明确,有研究发现溃疡性结肠炎的病情发展与炎症反应和氧化应激水平紊乱有关[1]。姜黄素源于姜科药用植物姜黄的地下根茎中,现代药理学研究表明,姜黄素具有良好的抗炎、抗氧化、抗肿瘤的药理活性[2]。阿托伐他汀是一种羟甲基戊二酰辅酶A(HMG-CoA)还原酶抑制剂,为心血管疾病常用药,还发现其具有抗炎等作用[3]。本研究主要通过观察姜黄素联合阿托伐他汀对溃疡性结肠炎小鼠的自噬和氧化应激的调控作用,探讨姜黄素联合阿托伐他汀对溃疡性结肠炎小鼠的保护作用机制,为姜黄素联合阿托伐他汀用于溃疡性结肠炎的治疗奠定理论基础。
1 材料与方法
1.1 材料
1.1.1 动物 选取SPF级,8周龄C57BL小鼠的40只,健康雄性,体质量18~22 g,购于中国医学科学院医学实验动物研究所,生产许可证号:SCXK(京)2019-0014。保持动物室内湿度和温度恒定,12 h光照/黑暗交替,小鼠可自由进食饮水,适应性饲养1周。
1.1.2 药物 葡聚糖硫酸钠(Dextran Sulfate Sodium,DSS)(MP Biomedicals公司,美国,批号:0216011080);姜黄素(Sigma-Aldrich公司,美国,货号:C1386);阿托伐他汀钙片(辉瑞制药有限公司,国药准字H20051408)。
1.1.3 试剂与仪器 小鼠肿瘤坏死因子-α(TNF-α)、小鼠白细胞介素10(IL-10)、小鼠白细胞介素-6(IL-6)、小鼠白细胞介素-1β(IL-1β),酶联免疫试剂盒(北京索莱宝科技有限公司,货号:SEKM-0034、SEKM-0010、SEKM-0007、SEKM-0002);LC3A/B抗体(Abcam公司,美国,货号:ab128025);p62(Abcam公司,美国,货号:ab207305);Beclin1(Abcam公司,美国,货号:ab210498);HRP标记的羊抗兔IgG抗体(Abcam公司,美国,货号:ab6721);小鼠髓过氧化物酶(MPO)、小鼠谷胱甘肽过氧化酶(GSH-Px)和小鼠超氧化物歧化酶(SOD)ELISA试劑盒(武汉华美生物工程有限公司,货号:CSB-E08723m、CSB-E13068m、CSB-E08556m);小鼠丙二醛(MDA)ELISA试剂盒(上海江莱生物科技有限公司,货号:1530033666)。透射电镜(日立公司,日本,型号:H-7650);高速冷冻离心机(Thermo公司,美国,型号:Multifuge X1R);凝胶成像分析系统(BIO-RAD公司,美国,型号:Image Lab);高速组织匀浆机(IKA公司,德国,型号:T10);石蜡切片机(上海莱卡仪器有限公司,型号:RM2016);多功能酶标仪(BioTek公司,美国,型号:ELX800)。
1.2 方法
1.2.1 分组与模型制备 对小鼠进行随机编号,并使用随机数字表法将40只小鼠随机分为对照组、模型组、姜黄素组、阿托伐他汀组和联合组,每组8只。对照组小鼠每日正常饮用灭菌蒸馏水,其他组小鼠均每日饮用5% DSS溶液造模。
1.2.2 给药方法 对照组和模型组小鼠每日灌胃1 mL生理盐水;姜黄素组小鼠每日灌胃给药60 mg/kg姜黄素悬液1 mL,阿托伐他汀组每日灌胃给药10 mg/kg阿托伐他汀混悬液1 mL;联合组每日灌胃60 mg/kg姜黄素悬液和10 mg/kg阿托伐他汀混悬液共1 mL,共7 d[4]。
1.2.3 检测指标与方法
1.2.3.1 疾病活动指数(DAI)评分 每日称量小鼠体质量,观察其大便稠度和便血情况,并按以下评分标准进行DAI评分:体质量没有下降记0分,体质量下降1%~5%记1分,体质量下降5%~10%记2分,体质量下降10%~15%记3分,体质量下降超过15%记4分;粪便稠度正常记0分,稀便记2分,腹泻记4分;粪便正常不见血记0分,隐血记1分,血便记2分,直肠出血记4分[5]。
1.2.3.2 结肠长度比较 取小鼠结肠至肛门直肠段,测量并记录自然长度,进行相关统计分析[6]。
1.2.3.3 血清炎症介质比较 给药结束后取小鼠静脉血于无菌离心管中,室温静置30 min凝固,9 000×g离心10 min,取上层血清,按照检测小鼠血清样本中4种细胞因子的浓度ELISA试剂盒提供的实验程序。
1.2.3.4 透射电镜观察各组结肠组织中自噬体 取小鼠结肠组织,使用2.5%戊二醛和2%锇酸固定,丙酮梯度脱水,包埋。将包埋组织进行超薄切片,对超薄切片使用醋酸铀和枸橼酸铅双重染色,洗去多余染液并干燥,使用透射电镜观察各组结肠黏膜细胞自噬情况[7]。
1.2.3.5 WB检测自噬相关蛋白表达情况 称取结肠组织,在冰上用预冷的RIPA裂解缓冲液研磨匀浆。将匀浆10 000×g离心20 min,收集上清液,测定蛋白浓度。每组均按100 μg的蛋白量进行上样,然后通过SDS-PAGE凝胶电泳分离总蛋白,并转移至聚偏二氟乙烯(PVDF)膜上。室温下封闭2 h,加入一抗(LC3A/B(1∶1 000)、P62(1∶1 000)、Beclin1(1∶2 000),4 ℃孵育过夜;TBST洗膜3次,加入HRP标记的二抗稀释液(1∶5 000),室温孵育1 h。ECL试剂盒显影,应用凝胶成像分析系统计算目标蛋白的相对表达量[8]。
1.2.3.6 ELISA法检测结肠组织氧化应激水平 将小鼠结肠组织使用预冷的生理盐水冲洗干净,匀浆,9 000×g离心10 min,取上清液,使用相应ELISA试剂盒测定结肠组织SOD、MDA、MPO、GSH-Px含量[9]。
1.3 统计学方法 采用SPSS 26.0统计软件进行数据分析,数据采用均数±标准差(±s)表示,对每组数据进行正态分布检验和方差齐性检验:符合正态分布的,采用单因素方差分析,方差齐性采用LSD检验,若方差不齐性则采用Dunnett T3法检验,对于不符合正态分布的,采用秩和检验。2组分析采用独立样本t检验。以P<0.05为差异有统计学意义。
2 结果
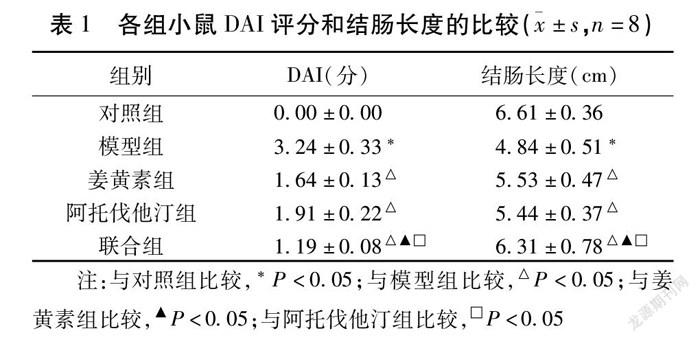
2.1 各组小鼠DAI评分和结肠长度的比较 与对照组比较,模型组大鼠DAI评分明显升高,结肠长度明显降低(P<0.05)。姜黄素组和阿托伐他汀组DAI评分比模型组明显降低,结肠长度较模型组明显增加(P<0.05)。与模型组、姜黄素组和阿托伐他汀组比较,联合组小鼠DAI评分较上述3组均明显降低,结肠长度均明显升高(P<0.05)。见表1。
2.2 各组血清炎症介质比较 模型炎症介质组小鼠血清炎症介质TNF-α、IL-1β和IL-6含量较对照组明显升高(P<0.05),抗炎因子IL-10含量较对照组明显降低(P<0.05)。与模型组比较,姜黄素组和阿托伐他汀组TNF-α、IL-1β和IL-6含量明显降低(P<0.05),IL-10含量明显升高(P<0.05)。联合组TNF-α、IL-1β和IL-6含量不仅明显低于模型组,与姜黄素组和阿托伐他汀组比较也明显降低(P<0.05);IL-10含量也明显高于模型组、姜黄素组和阿托伐他汀组(P<0.05)。见表2。
2.3 各组小鼠结直肠组织中自噬体比较 TEM结果显示,对照组结肠组织中存在大量的自噬体,而模型组几乎观察不到可见的自噬空泡。姜黄素组、阿托伐他汀组和联合组均可以观察到自噬体,且联合组自噬体数量较姜黄素组和阿托伐他汀组更多。见图1。
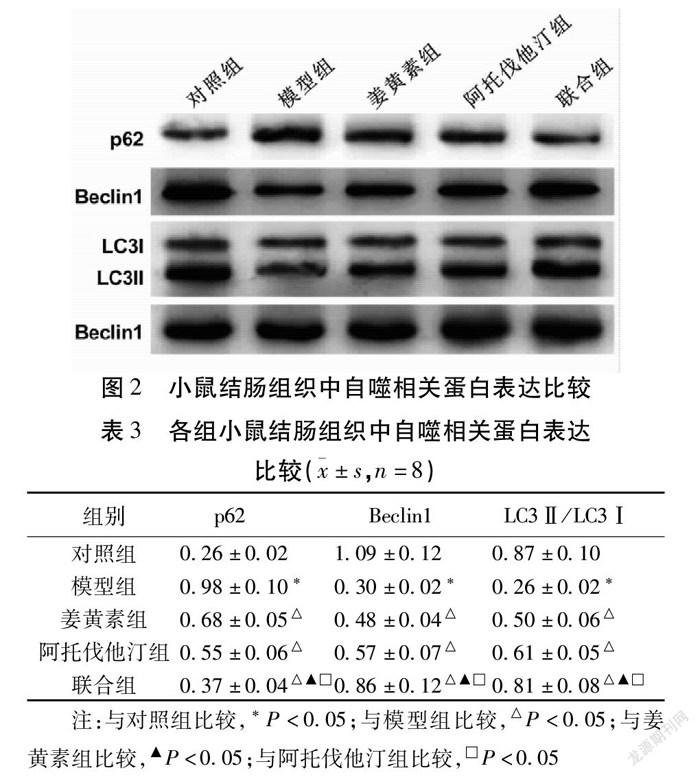
2.4 各组结肠组织中自噬相关蛋白表达比较 模型组小鼠p62蛋白表达水平较对照组明显升高,而Beclin1蛋白表达水平和LC3Ⅱ/LC3Ⅰ较对照组明显降低(P<0.05)。与模型组比较,姜黄素组p62蛋白表达明显降低,Beclin1蛋白表达明显升高,LC3Ⅱ蛋白和LC3Ⅰ蛋白的比值明显升高(P<0.05)。阿托伐他汀组与模型组比较各蛋白表达水平也具有明显变化,且与姜黄素组变化情况一致,差异有统计学意义(P<0.05)。在联合组小鼠结肠组织中,p62蛋白表达水平较模型组、姜黄素组和阿托伐他汀组均明显降低,Beclin1蛋白水平和LC3Ⅱ/LC3Ⅰ均較上述3组明显升高(P<0.05)。见图2,表3。
2.5 各组小鼠结肠组织中MPO、SOD、MDA和GSH-Px含量比较 模型组小鼠结肠组织中MPO和MDA含量比较对照组明显升高(P<0.05),而SOD和GSH-Px含量比较对照组明显降低(P<0.05)。与模型组比较,姜黄素组和阿托伐他汀组MPO和MDA含量均明显降低,而SOD和GSH-Px含量均明显升高(P<0.05)。与模型组、姜黄素组和阿托伐他汀组比较,联合组MPO和MDA含量明显降低,SOD和GSH-Px含量明显升高(P<0.05)。见表4。
3 讨论
UC是一种肠道炎症性疾病,典型症状包括血性腹泻,腹痛等,目前认为UC发病机制与遗传、免疫反应障碍和环境因素等有关,该病易反复发作且很难彻底根治,对患者生命质量造成很大影响。姜黄素是从姜黄的根茎中提取出来的一种天然药物,具有很高的安全性,是一种药用植物和食品添加剂,且姜黄素具有良好抗炎、抗肿瘤、抗氧化等药理作用,近年来越来越广泛应用于炎症相关性疾病的治疗中[10-11]。在Hanai等[12]关于姜黄素对UC临床疗效的研究中发现姜黄素能够缓解静止期UC患者复发,且无明显毒性,具有良好的治疗前景。阿托伐他汀是3-羟基-3-甲基戊二酰辅酶A(HMG-CoA)还原酶抑制剂,有研究发现,阿托伐他汀通过降低炎症介质的表达水平,减轻氧化应激反应,对溃疡性结肠炎小鼠结肠组织和血管内皮起到保护作用[13-14]。由本研究的DAI评分和结肠长度结果可以看出,姜黄素和阿托伐他汀均能减轻溃疡性结肠炎的程度,并对小鼠结肠组织起到保护作用。
近年来研究发现,中西药联合用药在临床实验中效果显著,其中姜黄素因其主要作用研究充分,安全性高,且在疾病谱中兼具多环节、多靶点调控相关致病因子,在中西医结合应用中的前景更加广泛。朱立伟[15]的研究中发现姜黄素联合美沙拉嗪治疗轻、中度溃疡性结肠炎时,能够产生更好的临床疗效且不增加不良反应的发生。然而,由于姜黄素水溶性低,口服给药生物利用度差,使其在临床应用中受到了极大的限制[16]。随着近年来脂质体、纳米技术等药物递送途径的研究以及姜黄素化学衍生物的合成,姜黄素的生物利用度得到明显改善,为姜黄素的临床使用提供了新的前景[17]。然而,也有研究发现姜黄素具有潜在的不良反应[18]。
研究发现,炎症反应和氧化应激是UC发生和发展的重要因素,在炎症区域,由于炎症介质的增多和抗炎因子的减少,会刺激机体产生和释放大量ROS,而可清除自由基的SOD、GSH-Px等酶活性降低,使ROS不断积累,从而引起周围组织的损伤,这是UC的一种潜在致病因素[19]。因此,抑制氧化应激和炎症介质的过表达,可作为治疗UC的方案。本研究结果显示,姜黄素组、阿托伐他汀组和联合组均能够使炎症介质TNF-α、IL-1β与IL-6含量明显降低,并明显提高抗炎因子IL-10的含量,抑制机体的炎症反应;同时降低MPO和MDA含量,提高SOD和GSH-Px水平,提高机体对氧自由基的清除能力;且联合组对于UC小鼠的炎症介质和氧化应激水平的影响与单独用药组比较也具有显著性差异,说明姜黄素联合阿托伐他汀对UC小鼠的保护作用更好,这与相关研究结果相似[20]。
有研究发现,TNF-α不仅与细胞增殖相关,还能诱导自噬过程[21]。自噬(Autophagy)是真核细胞在应激情况下所产生的一种非损伤性应答,通过溶酶体降解亚细胞结构,从而维持细胞内环境的稳态平衡[22]。自噬过程是由一系列自噬相关蛋白介导完成的,其中几个关键蛋白,如LC3Ⅱ作为自噬体膜上的标记蛋白,参与了自噬体的形成,与自噬体的数量正相关;Beclin1蛋白是启动自噬的关键性蛋白,能够调节自噬体膜合成和物质转运;p62能够通过与被泛素化的自噬底物蛋白作用,介导线粒体聚合并降解,与自噬水平负相关[23],均是可以反映自噬水平高低的重要指标。本研究结果显示,正常组小鼠结肠组织中自噬体含量丰富,而模型组小鼠结肠组织中几乎见不到自噬体,这说明自噬体的减少与溃疡性结肠炎的发展具有一定的关系。姜黄素组、阿托伐他汀组和联合组可以增加小鼠结肠组织中的自噬体数量,并使p62蛋白表达明显降低,Beclin1蛋白表达明显升高,LC3Ⅱ/LC3Ⅰ水平明显升高,在邓慧君等[24]的研究中也得到了相似的结论。本研究结果表明联合组对自噬体数量的增加和自噬相关蛋白表达水平的作用较单独用药组更为明显。可以说,姜黄素联合阿托伐他汀可更好地抑制自噬体的减少,增强自噬作用,从而对UC小鼠的结肠组织起到保护作用。
综上所述,姜黄素联合阿托伐他汀可以通过调控溃疡性结肠炎小鼠自噬相关蛋白的表达而增强自噬,同时控制氧化应激和炎症介质水平,对溃疡性结肠炎起到治疗作用。本研究首次采用姜黄素联合阿托伐他汀对溃疡性结肠炎小鼠的作用进行研究,为溃疡性结肠炎的治疗提供了实验依据。后续可对姜黄素和阿托伐他汀联合作用下对于炎症反应和氧化应激反应的作用机制进行研究,另外,对于姜黄素使用的安全剂量以及不同剂型的潜在毒性作用等方面也需要进行详细研究,为联合用药的临床应用提供可靠的实验依据。
参考文献
[1]崔畅婉,孙峥嵘.溃疡性结肠炎发病机制研究进展[J].现代免疫学,2019,39(1):77-81.
[2]陈骁,陈长曦,高瞻,等.姜黄素通过激活NRF2-DDAH-ADMA-NO途径抑制内皮间质化改善心脏纤维化[J/OL].中国中药杂志:1-10[2021-10-22].https://doi.org/10.19540/j.cnki.cjcmm.20211019.701.
[3]罗海,张婷,王振国.荷丹片联合阿托伐他汀对血脂异常患者血清同型半胱氨酸和炎症因子水平及血管内皮舒张功能的影响[J].中国医药,2020,15(10):1518-1522.
[4]陈光华,陈教华,张磊昌.姜黄素通过IL-6/STAT3信号通路调控Th17/Treg平衡治疗溃疡性结肠炎[J].中国病理生理杂志,2019,35(11):2092-2097,2102.
[5]李玉欣,赵鲁卿,张声生,等.清热化湿祛瘀方对溃疡性结肠炎小鼠结肠黏膜氧化应激和细胞凋亡的影响[J].中华中医药杂志,2021,36(3):1727-1730.
[6]吴娜,万治平,曾娟,等.黄芩汤对溃疡性结肠炎小鼠氧化应激及铁死亡相关指标GSH-Px4,P53,SLC7A11的影响[J].中国实验方剂学杂志,2021,27(8):17-24.
[7]Wang B,Gong Z,Zhan J,et al.Xianglian Pill Suppresses Inflammation and Protects Intestinal Epithelial Barrier by Promoting Autophagy in DSS Induced Ulcerative Colitis Mice[J].Front Pharmacol,2020,11:594847.
[8]关琦,张化莲,张珊珊,等.竹节参总皂苷对妊娠期高血压胎盘滋养细胞氧化应激损伤与过度自噬的影响[J].中草药,2021,52(14):4255-4261.
[9]全帅,吕开原,李新宇,等.低聚葡萄籽原花青素对葡聚糖硫酸钠诱导的小鼠溃疡性结肠炎的影响及作用机制[J].中草药,2020,51(1):149-156.
[10]叶世泰,王树超,王鑫,等.姜黄素对缺血性脑卒中大鼠小胶质细胞增殖的影响[J].中国医药,2021,16(3):381-384.
[11]王丽萍,刘彦琦,崔洁,等.基于miR-198调控PI3K-Akt信号通路探讨姜黄素治疗急性胰腺炎的机制[J].中国中药杂志,2020,45(15):3707-3712.
[12]Hanai H,Iida T,Takeuchi K,et al.Curcumin maintenance therapy for ulcerative colitis:randomized,multicenter,double-blind,placebo-controlled trial[J].Clin Gastroenterol Hepatol,2006,4(12):1502-1506.
[13]張艳丽,陈还珍,刘帅,等.阿托伐他汀对溃疡性结肠炎小鼠炎症因子和血管内皮的影响[J].中西医结合心脑血管病杂志,2016,14(6):597-599.
[14]刘帅.阿托伐他汀溃疡性结肠炎小鼠氧化应激及血管内皮功能的影响[D].太原:山西医科大学,2015.
[15]朱立伟.姜黄素联合美沙拉嗪治疗轻—中度溃疡性结肠炎疗效的临床评价[D].广州:南方医科大学,2019.
[16]Yang C,Su X,Liu A,et al.Advances in clinical study of curcumin[J].Curr Pharm Des,2013,19(11):1966-1973.
[17]周思颖,张思杰,徐寒子,等.姜黄素的古今运用[J].中国中西医结合杂志,2019,39(5):635-640.
[18]周阿容,葛胜晗,孔子浩,等.姜黄素的功能特性及其毒理学研究进展[J].食品研究与开发,2019,40(16):219-224.
[19]郑知强.氧化苦参碱介导细胞自噬减轻溃疡性结肠炎小鼠结肠黏膜氧化性损伤的作用机制研究[J].中国现代应用药学,2019,36(16):2014-2019.
[20]包小敏.姜黄素协同阿托伐他汀稳定易损斑块的作用与机制研究[D].泸州:西南医科大学,2018.
[21]魏科,陈勇超,周家豪,等.茯苓多糖辅助抗肺癌及免疫调节作用研究[J].中华中医药杂志,2020,35(10):4937-4940.
[22]常雪,陈晓婧,张旭东,等.中医药调控细胞自噬防治消化系统疾病研究现状[J].世界中医药,2021,16(3):522-526.
[23]陆麒瑾,李佳钰,蔡义思,等.当归拈痛汤对风湿热痹型佐剂性关节炎大鼠自噬蛋白LC3,Beclin 1,P62表达的影响[J/OL].中国实验方剂学杂志:1-11[2021-12-24].https://doi.org/10.13422/j.cnki.syfjx.20211842.
[24]邓慧君,顾取良,陈佳园,等.自噬相关因子在DSS诱导的溃疡性结肠炎中的作用[J].广东药科大学学报,2018,34(2):233-238.
(2021-11-25收稿 本文编辑:杨觉雄)

