配合物科学研究辅助《配位化学》教学方法探索
王 彦,祝红锦,张云云,尹贝贝,袁欢欢,魏诗璇,余 海,武峻峰
(安庆师范大学 化学化工学院,光电磁功能配合物和纳米配合物安徽省重点实验室,安徽 安庆 246133)
配位化学是基于无机化学的一门新兴学科,其内容涉及物理化学、分析化学、有机化学等各个学科,是一门发展迅速、备受关注的交叉学科[1-2]。其研究对象为含有孤对电子的配位原子所在的配体与具有空轨道的中心金属结合形成的配合物,主要研究配合物中配体与金属的配位方式、结构单元的堆积特征、整体配合物的一维、二维乃至三维的构筑机理,同时探究与结构相对应的不同属性和应用程序(包括光、电、磁、吸附等)[3-4]。而本科阶段的配位化学课程主要涉及基础理论和部分性质的介绍,诸如配合物的组成与命名、配合物的化学键理论、配合物的结构、配合物的热力学与动力学稳定性、配合物的制备方法等。一方面,配位化学的课程内容相对抽象、枯燥;另一方面,配位化学教学多为填鸭式教学,教学效果较差,在缺乏具体研究实例的情况下,学生往往难以理解某些知识和概念,如配位数与配位几何构型、晶体场理论、配合物的制备等。近年来,国内的配位化学研究突飞猛进,取得了丰硕成果,部分研究已处于国际领先水平[5-6]。在这样的大环境下,教师应将配位化学的科研实践教学与课堂教学相结合,改变传统课堂教学方式,积极开展教学改革,让学生在实践中理解、掌握并运用配位化学的概念与方法[7]。
结合教学实践,在教学中尝试引入科研元素,将文献调研、实验设计与结果分析作为课堂教学的补充。以有机配体4-(1-氢-四氮唑-5-基)吡啶和锌的配合物为例,教师从文献查阅、实验方案、配合物的合成、结构分析和表征等出发,激发学生学习兴趣、加深学生对配位化学知识的理解、锻炼实践动手能力与数据分析能力,构建化学学科的教-学-研一体化的知识体系,满足学生学习需求,提升课程教学质量。
1 科研设计的前期准备
科学研究是一项与时俱进的工作,知识更新周期短,只有了解学科发展的前沿,才能够更加有效地和书本知识相结合并指导学生学习。在课程实践的前期,教师将配位化学文献查阅引入课堂,帮助学生初步了解配位化学科研具体的研究对象和内容。通过文献调研扩展学科视野,做好“科研预习”。学生在美国化学会、英国化学会、Elsiver、Springer等多个化学数据库中输入配位化学关键词,诸如“coordina‐tion complex”、“metal-organic framework”、“coordination polymer”等进行检索,筛选出近三年文献适当地阅读和整理。通过阅读,可以使同学们了解到配位化学最新的研究热点是什么、具体研究内容有哪些、结合当前的学习可以做些什么样的力所能及的科学实验。在课程中,通过老师的引导和文献阅读,学生可以了解到目前配位化学科学研究主要内容为结构研究与性能应用两个方面。其中结构研究是一切性能研究的基础,性能离不开结构,这帮助同学们更加清晰地理解课程中的主线,即“结构决定性能,性能反映结构”。通过文献整理,同学们也可以了解到配合物实验的基本流程:单晶制备、单晶结构测定与表征、性能的测试与分析。文献查阅过程的教学引入,拉近了课堂与科研的距离,缩小了理论与现实的差距,帮助学生树立了科研的概念,使得后续的科研教学能够做到有的放矢。
2 实验方案的设计
为了更好地将科研引入课堂,我们在教学实践中通过具体配合物的研究(从合成到结构性质表征、分析)来实现教科研融合的教学改革。一般来说,配合物的基本合成方法有挥发法、分层法、溶剂热法等。挥发法和分层法周期较长,受外界环境因素影响较大,制备过程缺乏稳定性,不适用于课堂教学,因此,我们在教学设计中选择周期短且可控性较好的溶剂热法来进行课堂教学的配合物制备。
2.1 配合物[ZnII(L)2(H2O)4]·2H2O的合成
将4-氰基吡啶(15.6 mg,0.15 mmol)、叠氮化钠(9.8 mg,0.15 mmol)、醋酸锌溶液(0.5 M,200μL)于5 mL蒸馏水中充分混合,滴加1滴DMF∶H2O=1∶6的混合溶液,将上述溶液于室温下搅拌10分钟,接着转移至20 mL反应釜中密封,于90°C反应3天。然后冷却至室温,得到无色透明块状晶体。将晶体用蒸馏水小心洗涤3次,测得产率约为60%。元素分析(C12H20N10O6Zn1)的理论值(%):C 30.94、H 4.29、N 30.08;实际值(%):C 30.86、H 4.40、N 30.14。红外(KBr压片,cm-1):3 200(s,br)、1 630(s)、1 560(m)、1 430(s)、1 220(m)、1 160(w)、1 070(w)、1 050(w)、1 020(m)、837(m)、755(m)、717(s)、534(m)、461(m)。
2.2 配合物的结构表征
配合物的结构是配位化学研究中最重要的基础内容,理清配体和金属的配位方式以及结构单元的堆积模式是配位化学研究的核心任务。近现代分析技术的发展为此提供了便捷的途径,同时结构表征的测试分析过程也为配位化学实践教学提供了广阔的拓展空间。在实践过程中,教师通过对近现代分析测试手段(X射线单晶衍射、红外光谱、热重分析)的引入和介绍,帮助同学们了解配合物的结构信息。
配合物的X射线单晶衍射。在目前的配位化学研究中,X射线单晶衍射技术是一项可以帮助研究者准确快速地确定配合物的绝对构型,在分子水平上展示结构特征的重要技术。实践教学中,教师通过向学生引入相应的晶体学作图软件(Diamond、Mercury、Shelxtl等),将传统被动的课堂填鸭式教学转变为主动的人机交互式教学,改变传统的教学手段、拓展传统教学内容,从而提高学生学习兴趣与积极性、切实提升学生专业素质。比如,在教学中,于293 K温度下使用Bruker Smart APEX CCD单晶衍射仪收集配合物[ZnII(L)2(H2O)4]·2H2O单晶的衍射数据并利用OLEX2软件解析,指导学生使用Diamond展示配合物的结构信息。将配合物晶体学信息.cif文件导入Diamond软件,利用“添加原子”按钮找出中心原子,再连续点击“填充配位环境”按钮直至得到完整的配合物结构单元,如图1所示,通过这一实践教学过程和最终的结构图示,可以让学生直观地感受到分子水平上配合物的结构精妙之处,培养学生对空间结构的认知和学习兴趣。
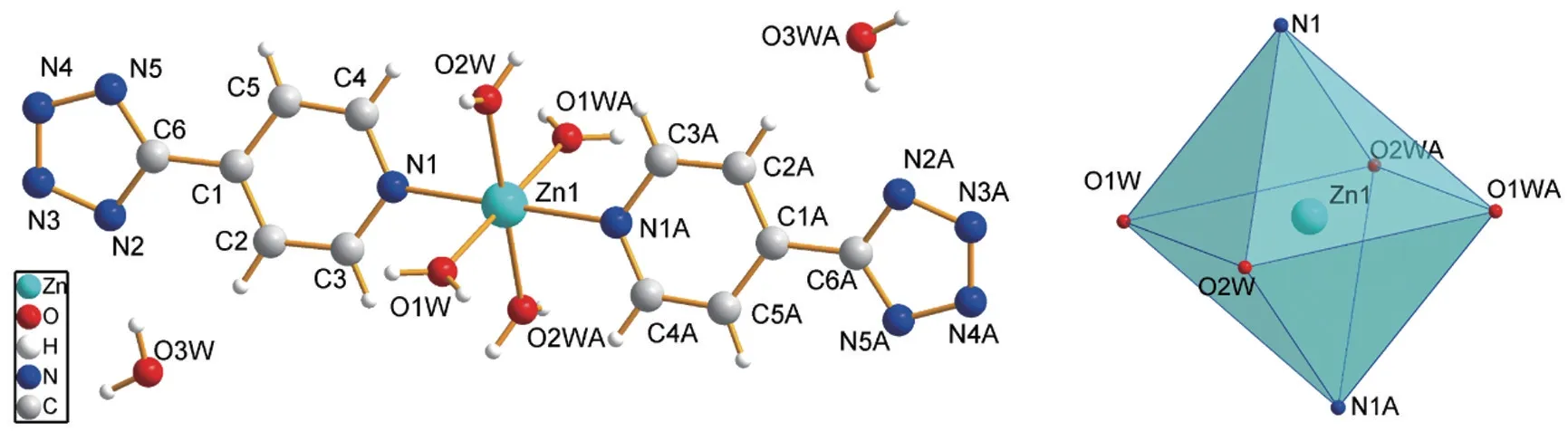
图1 配合物[ZnII(L)2(H2O)4]·2H2O的配位环境图
配合物的元素分析和热重分析。配合物的元素分析测试是验证晶体结构准确性的一种手段。C、H、N元素分析采用Perkin-Elmer 240C元素分析仪进行测试,实验得到的三种元素含量与单晶结构分析获得的元素组成所计算的理论值基本一致,说明单晶结构解析的正确性和样品的准确性。热重分析测试在N2氛围下进行,测量仪器为Mettler-Toledo(TGA/DSC1)热重分析仪,加热速率为10°C/min,温度范围为30°C~800°C。热重分析能够给出测量样品在加热过程中质量等性质的变化,从而获得配合物中配位键强度、热稳定性等信息,能够使学生对抽象空洞的配位键、稳定性等概念有更加直观的认知。
3 结果与讨论
3.1 配合物的制备方法
配合物是由有机配体和金属盐在自组装的条件下通过配位键组合而成的复杂化合物,概念上比较抽象,学生们往往会对此产生距离感,认为研究对象在云端,学习效果浮于纸上。通过对制备方法的学习,可以减少学生对配合物的神秘感。常见的配合物制备方法有挥发法、分层法、蒸汽扩散法,此外还有近些年来发展非常迅速的溶剂热法。溶剂热法是将配体和金属盐等原料分散在相应的溶剂中,置于密闭的高压反应釜并加热,在加热过程中体系会产生高温高压,原料的溶解度和反应性质均会与常规条件下产生较大的差异,有助于制备在常规方法下不易结晶的样品。通过具体化的实践合成,揭示配合物研究初期的合成过程,揭开科学研究的神秘面纱,帮助学生更加直观而具体地学习课程。
3.2 配合物[ZnII(L)2(H2O)4]·2H2O的结构分析
配合物组成中最主要的两部分就是有机配体和中心金属(原子或离子)。单晶结构分析表明该配合物属于三斜晶系,空间群为P-1。从Diamond软件分析得到的配位环境图(图1)可以看出,在配合物制备过程中,原料4-氰基吡啶和叠氮酸钠在路易斯酸ZnII存在的情况下发生原位反应,生成了新的有机配体4-(1-氢-四氮唑-5-基)吡啶,这一原位反应也与相关文献的报道一致[8]。配合物的金属中心ZnII为六配位,其配位模式为ZnO4N2,配位原子分别为2个L配体的吡啶N原子和4个配位水分子的氧原子,形成的是一个八面体的配位几何构型,其中O1W、O2W、O1WA、O2WA构成了八面体的赤道平面,而轴向的位置则由两个吡啶的N原子N1、N1A占据(图1)。
根据晶体结构,学生可以更加直观具体地理解配位化学中的部分基本概念:配合物的组成、配合物的内界与外界、中心金属的配位数与配位构型、空间群和对称操作,以及化学键理论。同时,可以学习到配合物由金属中心和配体两部分组成,其中金属离子具有空轨道,而配位原子可以提供配位孤对电子,二者以配位键结合成对应的配合物以接受来自于配体提供的配位电子,其中含孤对电子的O、N是配位化学研究中最典型的配位原子。在配合物结构单元中,A为一种对称操作,结构中原子的坐标可根据解析出的基本原子位置由对称操作不断地生成而获取结构信息。从图1可以看出,结构单元中存在2个4-(1-氢-四氮唑-5-基)吡啶配体(四氮唑基团去质子化,吡啶基团参与Zn的配位)、4个配位水分子和2个游离水分子。因此,配合物的分子式应为[ZnII(L)2(H2O)4]·2H2O(图2),其中,ZnII离子和2个配体,以及4个配位水分子共同组成配合物的内界,而游离水分子则为配合物的外界。
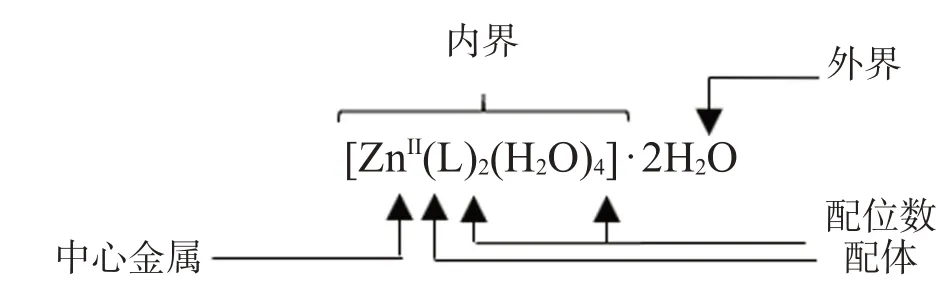
图2 配合物的分子式
课程教学通过配合物的化学键理论来分析并验证配合物的结构:由配合物的配位环境图(图1)可以看出,ZnII离子是配位数为6的八面体构型,作为具有d10电子构型的ZnII离子,其内层3d轨道处于全满的状态,因此ZnII离子采取的杂化轨道类型为sp3d2,为外轨型配合物;根据配位化学理论的姜-泰勒效应理论,d10组态的基态ZnII离子不存在电子的平行再分配,即无简并态,所以不会发生姜-泰勒畸变,这与配合物中ZnII的配位几何构型几乎为一个正八面体是相吻合的,而配合物中Zn-N键长(2.131Å)比Zn-O键长(2.114,2.128Å)略长则是由于核电荷数的影响使得N半径略大于O半径所造成的,以上结果均与配合物的化学键理论相吻合[9]。这一分析可以加深学生对于化学键理论的认识和掌握。
3.3 配合物的元素分析、热重分析和红外分析
通过Perkin-Elmer 240C元素分析仪进行测试,样品中C、H、N元素含量测试结果分别为30.86%、4.40%和30.14%。而根据单晶结构测试得到的配合物分子式C12H20N10O6Zn1计算的理论含量值分别为30.94%、4.29%和30.08%,实测值和理论值基本一致,说明配合物的单晶结构解析是正确的。
热重测试可以帮助同学们分析配合物的键强度以及热稳定性等信息。从图3的热重分析曲线可以看出,配合物样品的失重主要分为3个阶段:(1)40°C~92°C,失重7.56%,对应于2个游离水分子的失去(理论值7.72%);(2)92°C~130°C,失重15.48%,对应于4个配位水分子的失去(理论值15.46%);(3)从220°C开始,配合物开始急剧失重,对应着有机配体开始分解与失去。同学们从热重测试结果可以获得以下认知:(1)配合物中配位水和游离水与框架的键合差异,配位水与配合物框架之间通过配位键结合,要强于游离水与框架之间的作用,因此配合物受热分解是先从外界游离水分子开始,而内界的配位水分子的脱水则需要更高的温度;(2)两个阶段水分子的脱去实测值与理论值均吻合,可以进一步验证单晶结构解析的正确性。
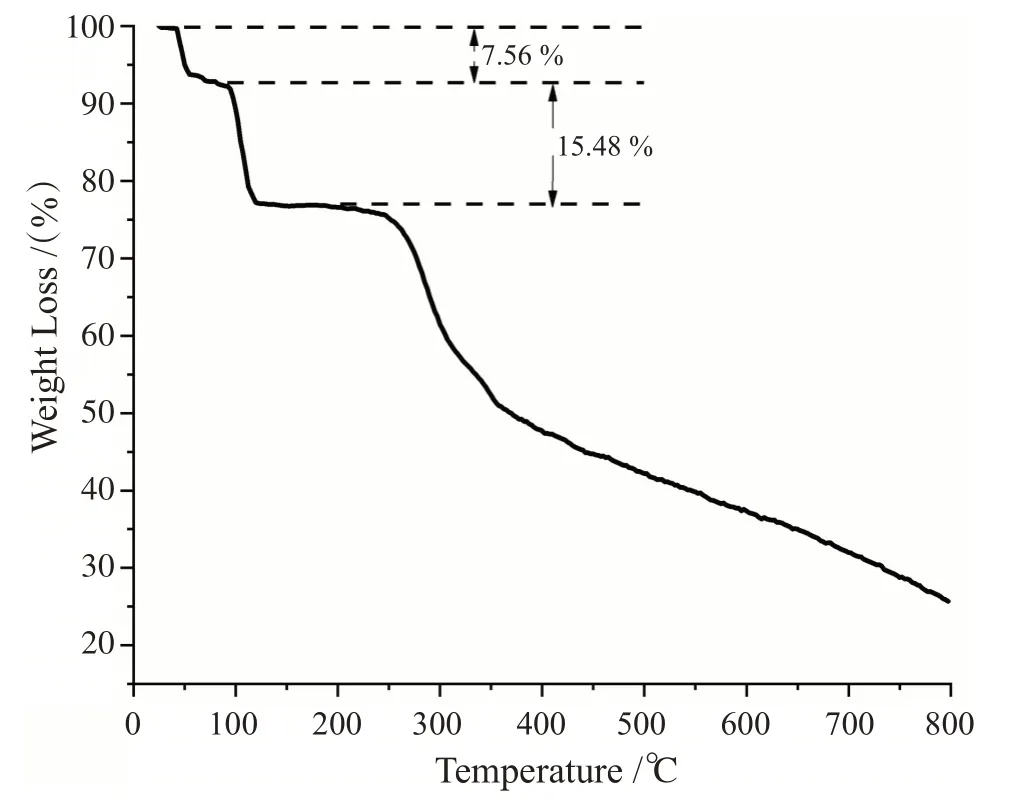
图3 配合物[ZnII(L)2(H2O)4]·2H2O的热重分析曲线
红外光谱作为一种特征性强的分子吸收光谱,可以帮助我们判断和验证样品中存在的功能基团,实现对配合物组成的定性分析。学生可以根据配合物红外谱图分析中学到的谱学知识,分析吸收峰官能团归属,锻炼实际应用能力。分析图4可知,谱图中3 200 cm-1附近宽峰对应为配合物中水分子的O-H伸缩振动,1 630 cm-1强吸收峰为吡啶基团特征吸收峰,而1 530 cm-1为四唑基团特征吸收峰,其他吸收峰也与吡啶或四唑基团相应吸收峰吻合[10-11]。红外谱图的结果也进一步验证了晶体解析的结果。
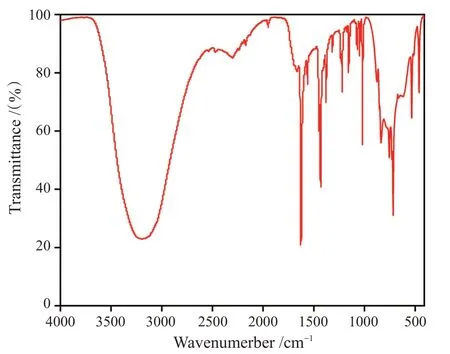
图4 配合物的红外光谱
4 结语
教师可以通过将科学研究引入到配位化学的课程教学过程中,利用文献检索引入学科前沿,设计科学实验方案。课程中利用叠氮化钠、4-氰基吡啶与锌盐为原料在溶剂热条件下原位合成了吡啶基四氮唑锌配合物,并分析了配合物结构、热重以及红外光谱。教科研结合将配合物的制备、单晶结构、性质分析串联,帮助同学们了解配合物的组成、化学键理论、配合物光谱及稳定性等多个课程知识点,真正做到课程内容学以致用、活学活用,拓宽了学生的学科视野。理论指导实践,实践检验理论。从文献调研到实验设计、从结构分析到谱图验证,整个教学科研融合的过程极大地巩固了学生的书本知识,也更加丰富了学生的课外学习。教学与科研的结合提高了学生的主动性和课程教学效果,截止目前,本校化学类学生已发表多篇配位化学研究成果[12-14],极大地提高了课程教学质量,拔高了本专业本科培养水平。

