琥珀酰化调控大豆分离蛋白电荷密度对其构象及乳化性的影响
刘冠男,胡 淼,杜晓倩,谢凤英,齐宝坤,*,李 杨,2,*
(1.东北农业大学食品学院,黑龙江 哈尔滨 150030;2.黑龙江省绿色食品科学研究院,黑龙江 哈尔滨 150000)
大豆分离蛋白(soybean protein isolate,SPI)是植物蛋白质的重要来源,可提供包括赖氨酸在内的多种必需氨基酸,具有较高的营养价值。SPI可以经碱溶酸沉法提取,主要成分是储藏蛋白,即7S和11S球蛋白,占总蛋白的65%~80%[1]。由于SPI具有营养丰富、价格低廉、加工性能好等优点,因此广泛用于各类食品中,主要包括“人造肉”[2]、发酵类食品[3]、凝胶类食品[4]等,具有相当高的消费者接受度。由于SPI致密的球状结构、低分子柔性以及其在油水界面吸附性不良而导致乳化性等功能性质不理想[1]。因此,许多方法被用来改变SPI的结构、构象以及聚集状态以提高其功能性。
蛋白质化学修饰具有效率高、可控性强的特点,可以改善蛋白质的理化性质和功能性质,与物理修饰和酶修饰相比,更易于大规模生产[5]。琥珀酰化是常见修饰蛋白质的手段,通过用琥珀酰基修饰蛋白质的氨基(赖氨酸、精氨酸)、羟基和巯基改变蛋白质的带电状态,调控蛋白质表面电荷密度[6-7]。Mirmoghtadaie等[8]研究表明,酰化降低了燕麦蛋白的持水能力,提高了燕麦蛋白的乳化性和溶解性。Shilpashree等[9]报道了琥珀酰化后酪蛋白酸钠的溶解度、黏度和乳化性均能得到改善。Wan Yangling等[10]研究指出琥珀酰化可以提高大豆蛋白的热稳定性,抑制蛋白在高温下的热聚集。由此可见,酰化改性可以提高蛋白溶解性、乳化性、起泡性、热稳定性等功能性质。蛋白质构象的改变与功能性质的改善息息相关[11]。然而,相关研究仅停留于琥珀酰化改性对蛋白功能性质的影响,关于琥珀酰化调控SPI表面电荷密度对其构象影响的研究鲜有报道,且酰化SPI调控电荷密度使其构象改变与乳化性改善的关系还有待进一步探索。
本实验通过研究琥珀酰化调控SPI电荷密度对其构象以及乳化性的影响,探究酰化蛋白构象变化和乳化性改善之间的关系。利用不同浓度的琥珀酸酐对SPI改性,采用电位、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis, SDS-PAGE)、扫描电子显微镜、荧光光谱、紫外光谱、傅里叶变换红外光谱等方法表征酰化蛋白构象与乳化性之间的关系。本实验旨在为琥珀酰化改性在蛋白修饰方面的应用提供理论参考,并为高功能性大豆蛋白产品的开发提供新的技术手段。
1 材料与方法
1.1 材料与试剂
大豆(东农-42) 东北农业大学大豆研究所;琥珀酸酐(丁二酸酐,色谱纯≥99%);透析袋(截流分子质量7 kDa);茚三酮 上海源叶生物科技有限公司;1-苯胺基-8-萘磺酸盐(1-anilino-8-naphthalene sulfonate,ANS) 美国Sigma公司;盐酸、氢氧化钠、正己烷、磷酸二氢钠、磷酸氢二钠(均为分析纯) 北京新光化工试剂厂。
1.2 仪器与设备
AL204型分析天平 梅勒特-托利多仪器(上海)有限公司;JJ-1增力电动搅拌器 江苏金城国胜仪 器厂;Allegra64R台式高速冷冻离心机 美国贝克曼 公司;PHS-3C型实验室pH计 中国上海雷磁公司;mini-PROTEAN Tetra电泳仪 美国Bio-Rad-Laboratories公司;Zetasize nanozs 90型粒度电位仪 英国马尔文仪器有限公司;SU801场发射扫描电子显微镜、RF-6000荧光分光光度计 日本Hitachi公司;UV-2600型紫外-可见分光光度计、IRTracer-100傅里叶变换红外光谱仪 日本岛津公司。
1.3 方法
1.3.1 SPI的制备
采用碱溶酸沉的方法[12]。选择新鲜无虫蛀、无霉烂、无破损的大豆破碎磨粉,过60 目筛,并用正己烷脱脂。将脱脂大豆粉分散于去离子水中并使之充分溶解,料液比为1∶10(g/mL),并用2 mol/L的NaOH溶液调节pH 8.0,室温下搅拌2 h,4 ℃、9 000×g离心30 min,收集上清液,用2 mol/L的HCl溶液调节pH 4.5,静置1 h,4 ℃、6 500×g离心30 min,收集沉淀。用去离子水将沉淀水洗3 次后调pH 7.0,去除不溶物,将蛋白溶液冷冻干燥得到SPI。
1.3.2 琥珀酰化改性SPI
参考Wan Yangling等[10]的方法并稍作修改。准确称取一定量的SPI溶于去离子水中配制成2.5 g/100 mL SPI悬浮液,在室温下搅拌2 h使其充分溶解,用2 mol/L的NaOH溶液调pH 8.0。将琥珀酸酐缓慢加入到SPI溶液中,酸酐与SPI的质量比分别为0.02∶1、0.05∶1、0.10∶1、0.15∶1,获得4个不同酰化程度的SPI样品。在加入琥珀酸酐的过程中,用2 mol/L的NaOH溶液使整个反应体系pH值稳定在8.0±0.2。当pH值稳定于8.0时,将溶液在室温下再搅拌1 h,然后将所得液体放入4 ℃冰箱透析24 h去除未反应的小分子琥珀酸酐和盐,冷冻干燥后得到4种不同酰化度的SPI粉末,分别将其命名为SSPI-1、SSPI-2、SSPI-3、SSPI-4。
1.3.3 酰化度的测定
根据Pan Yi等[13]的方法稍作修改。分别将1 g/100 mL的蛋白溶液和2 g/100 mL的茚三酮溶液各1 mL混合,将混合液在沸水浴中加热10 min,然后快速冷却至室温。向冷却的混合液中加入5 mL去离子水。随后在570 nm波长处测定溶液的吸光度。根据式(1)计算SPI的 酰化度:

式中:A0与A1分别为酰化和未酰化蛋白的吸 光度。
1.3.4 Zeta电位测定
用1 mol/L的HCl和NaOH溶液将SPI/SSPI溶液(10 mg/mL)调整至pH 3~7,利用Zetasize nanozs 90型粒度电位仪测定不同pH值条件下不同样品的Zeta电位,测定温度25 ℃、平衡时间2 min。
1.3.5 SPI/SSPI的微观结构观察
使用SU8010场发射扫描电子显微镜对SPI/SSPI的表面形貌进行观察。将样品均匀平摊在贴有导电胶的样品台上,喷金处理,观察成像时加速电压5 kV,观测倍数为1 000。
1.3.6 SDS-PAGE分析
参考Qi Baokun等[14]的方法对SPI/SSPI进行电泳实验。分别配制12%分离胶以及5%浓缩胶,将6 mg/mL的SPI/SSPI与上样缓冲液混合均匀后煮沸90 s,冷却至室温上样。开始电泳时电压为80 V,待样品进入分离胶后改为120 V;电泳结束后,取出胶片加入染色液染色30 min,之后再用脱色液脱色后进行分析。
1.3.7 内源荧光光谱分析
采用RF-6000荧光分光光度计测定SPI/SSPI的内源性荧光。将SPI和SSPI溶解在10 mmol/L的磷酸盐缓冲溶液(pH 7.0),样品质量浓度为0.1 mg/mL,设定激发波长为280 nm,激发和发射狭缝宽度均为5 nm,扫描范围290~400 nm。
1.3.8 紫外光谱分析
采用UV-2600型紫外分光光度计对SPI/SSPI进行紫外吸收光谱采集。将SPI和SSPI溶解在10 mmol/L 的磷酸盐缓冲溶液(pH 7.0),样品质量浓度为 0.1 mg/mL,测定速率为中速,分辨率为0.5 nm,测定波长范围200~400 nm。
1.3.9 红外光谱分析
采用IRTracer-100型傅里叶变换红外光谱在室温下记录SPI/SSPI的红外光谱。将样品与溴化钾混合,然后压片。扫描范围为400~4 000 cm-1,扫描次数为64 次,分辨率为4 cm-1。
1.3.10 表面疏水性测定
参考夏爽[15]的方法并作适当修改。使用10 mmol/L、pH 7.0的磷酸盐缓冲溶液配制不同质量浓度梯度SPI/SSPI溶液(0.02、0.04、0.06、0.08、0.1 mg/mL)各4 mL,然后加入100 μL ANS溶液(8 mmol/L,pH 7.0),充分混合,并在黑暗条件下反应15 min。使用荧光分光光度计测定其荧光强度,激发波长为390 nm,发射波长为470 nm,狭缝宽度均为5 nm,样品的相对荧光强度值为样品的荧光强度值与未加ANS溶液的样品的荧光强度值之差。以样品蛋白质量浓度为横坐标,样品的荧光强度值为纵坐标,计算所得曲线的初始斜率即为蛋白质的表面疏水性指数(H0)。
1.3.11 分子柔性的测定
参考Pan Yi等[16]的方法并作适当修改。将SPI和SSPI溶解在10 mmol/L的磷酸盐缓冲溶液(pH 7.0)中,配制1 mg/mL胰凝乳蛋白酶液,酶液溶于0.05 mol/L,pH 8.0的Tris-HCl缓冲液中。3 mL样品与200 μL酶液混合,在38 ℃反应10 min,然后加入3 mL质量浓度为4 g/100 mL的三氯乙酸溶液终止反应,沉淀未消化的蛋白,4 ℃、4 000×g离心30 min,然后用紫外分光光度计在280 nm波长处测定其吸光度表示分子柔性。
1.3.12 乳化活性及乳化稳定性测定
参考Li Ting等[17]的方法并作适当修改。配制5 mg/mL 的SPI/SSPI溶液,加入玉米油,油水比为1∶9,用高速剪切均质机在12 000 r/min均质1 min形成乳状液,立即从距离乳状液底部0.5 cm处取50 μL新鲜乳状液分散于5 mL 0.1%的SDS溶液中,振荡均匀后在500 nm波长处测定吸光度,记作A0,以相同的方法取均质10 min后的乳状液重复上述步骤,其吸光度记作A10。乳化活性指数(emulsifying activity index,EAI)和乳化稳定性指数(emulsifying stability index,ESI)由式(2)、(3)计算:
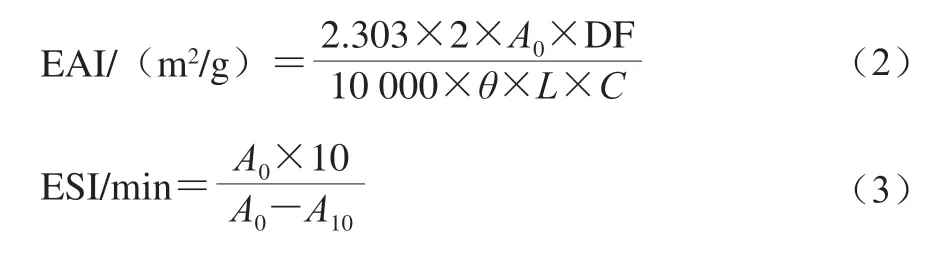
式中:A0与A10分别为乳状液在第0分钟和第10分钟的吸光度;DF为稀释倍数(100);θ为油相体积分数0.2;L为比色皿厚度1 cm;C为蛋白质质量浓度(5 mg/mL)。
1.4 数据分析
每个实验重复3 次,结果表示为±s。图表制作采用OriginPro 8.5软件,使用SPSS 23.0进行ANOVA差异显著性分析和方差分析(P<0.05,差异显著)。
2 结果与分析
2.1 酰化程度及电位变化
酰化反应的原理是酰化试剂(琥珀酸酐、乙酸酐等)与蛋白质分子的游离氨基、羟基或巯基之间的亲核取代反应(图1)[6-7]。由于赖氨酸pKa值低且位阻较弱,因此酰化反应主要发生在赖氨酸ε-氨基的位置[18],氨基的酰化度表示为N-酰化度。当大多数氨基被琥珀酰化后,脂族羟基和巯基也开始被琥珀酰化。

图1 SPI与琥珀酸酐亲核取代反应基理Fig. 1 Nucleophilic substitution mechanism between SPI and succinic anhydride
不同酸酐-SPI质量比的SPI酰化程度变化如图2A所示,N-酰化度随酸酐-SPI质量比的增加而增加,酸酐-SPI质量比为0.05∶1时,N-酰化度达77.82%。当比值进一步提高时,酰化反应的速率明显下降。这一现象与Wan Yangling等[10]的发现一致,这可能是由于SPI的琥珀酰化作用从表面逐步发生到内部,琥珀酸酐首先与蛋白质表面的氨基反应,反应速率快,当酸酐的量进一步增加时,蛋白质天然结构发生明显改变,导致琥珀酸酐与蛋白质内部的氨基反应,反应速率下降。反应速率的转折发生在酸酐-SPI的质量比等于0.05∶1时,此时N-酰化度达77.82%,因此推测约75%的赖氨酸残基在SPI表面或附近,这部分基团优先被酰化,SPI结构发生变化,从而导致掩埋的氨基暴露和酰化。
琥珀酰基基团的引入会导致SPI等电点改变。SPI和SSPI在不同pH值条件下表面电荷的测定结果如图2B所示。随着pH值的提高,SPI和SSPI的Zeta电位呈下降趋势。SPI属于两性电解质,因此具有一定的pH值依赖性。当pH值低于等电点时,基团质子化,氨基基团使SPI带正电。当pH值高于等电点时,基团去质子化,由于羧基基团存在,SPI带有负电荷[19]。随着SPI琥珀酰化程度的增加,SPI的等电点呈下降趋势,由4.30依次下降到3.56、3.47、3.17、3.12,主要是由于琥珀酰基基团的引入使得带正电荷的氨基基团转变为带负电荷的琥珀酰基基团,增加了蛋白质表面负电荷密度,使得等电点移向更低的pH值,这与Wan Yangling[10]和Liu Guangyu[20]等的研究结果一致,从而证实了可通过引入琥珀酰基基团增强SPI的电负性。
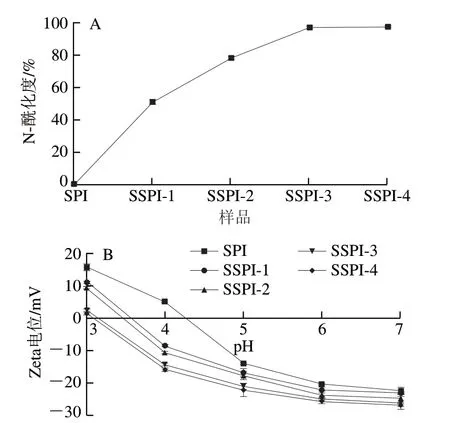
图2 不同酸酐-SPI比值的SPI酰化程度(A)及SPI/SSPI的 Zeta电位随pH值变化情况(B)Fig. 2 Degree of SPI succinylation as a function of acid anhydride to SPI ratio and zeta potential of SPI/SSPI as a function of pH
2.2 SPI/SSPI的微观结构
蛋白结构与功能特性密切相关,研究其微观结构能更好地理解和阐明功能特性改善的原因。从图3可以看出,SPI呈现光滑致密的无规则片状结构[21],SSPI仍呈现出无规则片状结构,但其光滑的表面出现一些小孔穴,这是因为琥珀酸酐与SPI发生反应改变了SPI的微观结构。随着N-酰化度的提高,小孔穴的数量越来越多,这表明琥珀酸酐首先与蛋白质表面的赖氨酸残基发生反应。SSPI-3和SSPI-4表面小孔穴数量相差无几,进一步证明了SPI琥珀酰化作用是从SPI的表面到内部逐步进行,与2.1节结果一致。

图3 SPI/SSPI的微观结构(×1 000)Fig. 3 Microstructure of SPI/SSPI (× 1 000)
2.3 SDS-PAGE分析
图4显示,相比较于SPI,SSPI的7Sα、α′和β亚基条带略微上移并稍有变浅,SSPI-1和SSPI-2的泳道在75 kDa和100 kDa之间出现新的条带,SSPI-3和SSPI-4的泳道在100 kDa出现新的条带,这些现象说明琥珀酰基基团的加入改变了SPI的分子质量,使得SPI中某些亚基分子质量增加。Haug等[22]的研究也表明,琥珀酰化后溶菌酶(一种仅含有一条肽链的蛋白质)的分子质量增加。SPI的11S中酸性多肽的条带随着酰化程度的增加向上偏移,11S碱性多肽的条带消失,而且在低于20 kDa的分子质量区域,相比较于SPI,SSPI的条带变浅,变浅程度与酰化程度呈正比,且SSPI-3和SSPI-4弥散至25 kDa处,这可能是由于琥珀酰化反应使得SPI某些结构被分离[10]。
2.4 内源荧光光谱
如图5所示,SSPI的荧光强度均高于SPI,这是由于SSPI携带更多负电荷,分子间排斥力增强,分子结构舒展使更多色氨酸暴露出来[23]。但随着酰化度的增加,SSPI的荧光强度逐渐下降,可能是由于随着酰化度的增加,链状琥珀酰基基团逐渐增多,使得蛋白空间位阻增加,形成一个密闭蛋白链空间,导致部分色氨酸残基被包裹在内。除荧光强度变化外,峰位置的变化也值得关注。随着酰化度的增加,蛋白的λmax从330 nm逐渐增加到337 nm,产生红移,表明琥珀酰化破坏了SPI分子内的疏水相互作用,且蛋白所在环境的极性增加,蛋白质的肽链伸展程度增加。这可能是因为酰化后蛋白质变性引起的分子展开和构象变化,导致掩埋在蛋白质内部的色氨酸残基暴露于更加亲水以及极性更大的环境中。SSPI-3与SSPI-4的荧光强度曲线相差不大,曲线稳定,这与2.1节中酰化程度的结果相吻合。即在酸酐-SPI质量比大约为0.05∶1时,酰化反应出现一个转折点,而当比值进一步提高时,N-酰化度几乎没有变化。但仍观察到荧光强度发生了细微的变化,其可能的原因是在这一阶段,酰化反应已经进入蛋白内部,琥珀酸酐与脂族羟基和巯基发生反应。

图5 SPI/SSPI的内源荧光光谱Fig. 5 Intrinsic fluorescence spectra of SPI/SSPI
2.5 紫外-可见光吸收光谱
图6显示,SPI与SSPI的紫外光谱峰值均在260~280 nm之间。蛋白的紫外吸收光谱在250~260 nm附近产生的吸收谱带主要是由苯丙氨酸残基贡献,在260~290 nm内的吸收由酪氨酸残基所引起,而292 nm附近的吸收则由色氨酸残基贡献[24]。因此认为本研究的紫外光谱变化主要由酪氨酸引起,其次是色氨酸。SSPI的紫外吸收强度相比较于SPI均下降,并且酰化程度的变化与紫外光谱强度的变化呈负相关。实验推测,随着酰化度的提高,琥珀酰基基团越来越多,使得蛋白空间位阻增加,形成一个密闭的蛋白链空间,酪氨酸残基逐渐被包裹在蛋白质链的内部。除荧光强度变化外,峰位置也发生了变化,由266 nm红移到275 nm,这一现象表明SPI的三级结构由于琥珀酰基基团的加入发生改变,影响了蛋白质分子存在的微环境。
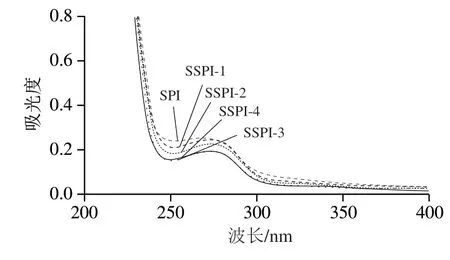
图6 SPI/SSPI的紫外光谱Fig. 6 UV absorption spectra of SPI/SSPI
2.6 傅里叶变换红外光谱测定结果
傅里叶变换红外光谱是研究蛋白质化学组成和构象结构的一种方法[25]。如图7所示,3 400 cm-1左右的宽峰是O—H与N—H伸缩振动重叠而成的多重吸收峰。随着酰化程度的提高,宽带逐渐消失,这是由于游离氨基与琥珀酰基基团反应后其中N—H键变为C—N键所致的。SSPI处于3 200~2 500 cm-1处的峰与SPI相比峰宽而散,一方面说明—COOH的存在,且随着酰化程度的增加,—COOH的含量越来越多;另一方面也说明分子内氢键相互作用得到增强,这是由于O的电负性大于N,更容易形成氢键[26]。SSPI酰胺I带与酰胺II带的波形相比SPI没有发生变化,强度变化也不明显。SSPI图谱在酰胺III带1 300 cm-1处区域强度增加,这是由于酰化后 C—N键拉伸和N—H键变形导致。
图7 SPI/SSPI的红外光谱Fig. 7 Infrared spectra of SPI/SSPI
2.7 表面疏水性及分子柔性测定结果
采用ANS和蛋白质表面疏水区域的结合所引起的荧光增强评估蛋白质的表面疏水性。它可以反映蛋白质的构象变化,且与蛋白质的功能性质密切相关[27]。SSPI的表面疏水性变化如图8所示。随着酰化程度的增加,SPI的表面疏水性显著下降。这一结果与燕麦蛋白[28]和芸豆蛋白[29]的研究结果相似。表面疏水性的降低可能有两个原因引起,一方面,酰化引起SPI三级结构的改变,导致表面疏水区域的比例降低;另一方面,琥珀酰化导致电荷密度和电负性的增加,这可以通过酰化后SPI的Zeta电位的降低证明(图2),蛋白质的高负电荷分布或强电负性会引起静电排斥,这可能会抑制ANS接近并与裸露的疏水区域结合,从而导致表面疏水性降低[28-29]。
蛋白质的分子柔性被定义为蛋白质中各个结构区域的相对运动或多肽链中氨基酸残基的重排速率[30]。蛋白质的分子柔性在蛋白表面性质中起着十分重要的作用[31]。 SSPI的分子柔性的变化如图8所示。相较于SPI,随着酰化程度的增加,蛋白质的分子柔性呈现先增加后降低的趋势。这一结果表明,随着琥珀酰化反应进行,酰化程度提高,导致SPI结构展开,蛋白质分子柔性与酰化程度呈正比。但是,当琥珀酸酐与蛋白比值达到0.15∶1,蛋白质的分子柔性略有下降,这可能是琥珀酰基基团在水溶液中存在形态是链状结构,与蛋白质结合后,因为长链的存在而导致SPI产生一定的空间位阻,分子柔性降低。
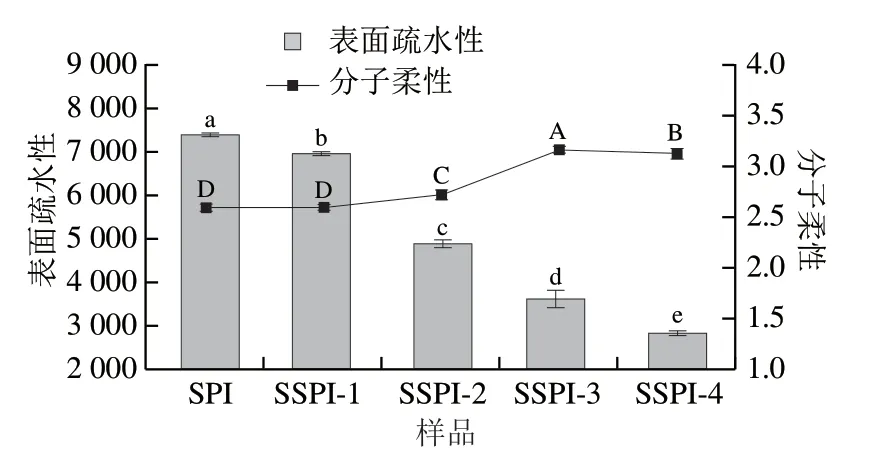
图8 SPI/SSPI的分子柔性和表面疏水性Fig. 8 Molecular flexibility and surface hydrophobicity of SPI/SSPI
2.8 乳化活性与乳化稳定性测定结果
SPI成分主要包括7S与11S两种球状蛋白,因为低分子柔性以及其在油水界面吸附性不良而导致乳化性不理想[1]。EAI和ESI分别代表蛋白质在油/水界面形成和稳定乳液的能力[32]。
琥珀酰化改性SPI会改变蛋白质分子的空间构象。如图9所示,琥珀酰化可以显著提高SPI的EAI以及ESI,且EAI和ESI的变化趋势一致,SPI酰化程度与EAI/ESI的变化呈正比。在SPI中加入琥珀酰基基团改变了蛋白质的构象和界面行为,导致SPI结构展开(2.4节和2.5节),因此SPI乳化性提高。Lawal等[33]指出,添加琥珀酸酐增加了油滴周围界面膜电离层的电势,从而提高了EAI和ESI。当酸酐与SPI比例达到0.15∶1时,EAI和ESI略有下降,但是仍比未改性的SPI高。这一现象可能是由于大量琥珀酰基基团链状结构的存在导致分子柔性略微降低,影响EAI和ESI,这与上述2.7节分子柔性的结果吻合。

图9 SPI/SSPI的乳化活性和乳化稳定性Fig. 9 EAI and ESI of SPI/SSPI
3 结 论
本研究探究琥珀酰化调控SPI电荷密度对其构象和乳化性的影响,明确了酰化蛋白构象变化和乳化性改善之间的关系。琥珀酸酐主要与SPI的氨基反应,SPI的琥珀酰化作用从表面逐步发生到内部。随着酰化程度的增加,SPI的等电点向酸性移动,负电荷密度也明显增加;改性SSPI结构展开,色氨酸残基暴露,酪氨酸残基被包裹,SSPI处于更加亲水的环境中,SPI游离氨基与琥珀酰基基团反应使得其中N—H键变为C—N键,导致酰胺III带改变;酰化修饰降低了SPI的表面疏水性,增加SPI的分子柔性,并且由于结构展开导致其乳化活性和乳化稳定性都得到明显改善。该研究结论为琥珀酰化改性在蛋白化学修饰方面的应用提供理论参考,并且拓宽了SPI在食品工业中作为乳化剂和功能活性物质载体的应用范围。

