广西香蕉根系内生真菌的群落组成与多样性
陈艳露 谢玲 刘斌 曾凤花 廖仕同 张艳
摘 要:本研究对广西香蕉主产区的香蕉根系样本进行内生真菌分离,采用形态学与ITS序列分析相结合的方法进行菌株鉴定,开展其物种组成与多样性分析,对了解广西香蕉与其根部内生真菌间的关系以及探索其内生真菌功能具有重要意义。从168个香蕉根段中共分离获得352株内生真菌,分别归属于5纲17目34科43属62个分类单元,不同分类单元的代表菌株中,有41株菌株能够产生分生孢子(66.13%)。其中,优势纲为粪壳菌纲(Sordariomycetes)和散囊菌纲(Eurotiomycetes),相对频率(RF)分别为66.19%和20.45%;优势目为肉座菌目(Hypocreales)、散囊菌目(Eurotiales)和格孢腔菌目(Pleosporales),相对频率分别为55.4%、17.61%和9.66%;优势属为镰刀菌属()、青霉属()、木霉属()、未鉴定属3、帚枝霉属()、未鉴定属2、弯孢属()和突脐蠕孢属(),相对频率分别为32.39%、15.06%、13.35%、5.11%、3.98%、3.41%、3.13%和2.84%,后5个属的相对频率未超过10%,其优势不明显。多样性指数和均匀度系数结果表明,南宁地区坛洛镇TL2样地和锣圩镇LX样地的香蕉根系内生真菌种群多样性较丰富,群落分布较均匀。相似度系数分析显示,钦州地区大成镇2个样地(DC1、DC2)间香蕉根系内生真菌种群组成相似度最高(=0.67)。不同采樣点的地理环境和气候条件给香蕉提供了不同的生境,是影响香蕉根系内生真菌种类组成及多样性差异的主要因素之一。
关键词:内生真菌;形态特征;系统发育分析;多样性指数
中图分类号:S668.1 文献标识码:A
Community Composition and Diversity of Endophytic Fungi in Banana Root in Guangxi
CHEN Yanlu XIE Ling LIU Bin ZENG Fenghua LIAO Shitong ZHANG Yan
1. Institute of Applied Microbiology, College of Agriculture, Guangxi University, Nanning, Guangxi 530004, China; 2. Institute of Plant Protection Research, Guangxi Academy of Agricultural Sciences / Guangxi Key Laboratory of Biology for Crop Diseases and Insect Pests, Nanning, Guangxi 530007, China
Endophytic fungi were isolated from banana roots in main banana producing areas of Guangxi using the routine tissue isolation method. The endophytic fungi strains were identified based on morphology combined with phylogenetic analysis of ITS sequence. The analysis of composition and diversity of endophytic fungi associated with banana roots in Guangxi is of great significance in studying symbiotic relationship between banana and endophytic fungi and exploring function development of endophytic fungi in banana roots. A total of 352 isolates of culturable endophytic fungi were obtained from 168 tissues of banana roots collected from 7 sampling sites, and they were classified as 62 taxa. The identifiable taxa belonged to 3 phylums (Ascomycota, Basidiomycota and Zygomycota) with 5 classes, represented by 17 orders with 43 genera. Observation of colony morphology and diameter of 62 representative fungi showed that most of them grew rapidly on CMMY medium in a week while some of them grew slowly. The color of the fungi colonies was different. Light-colored fungi colonies were generally white, light yellow or pink while dark colonies were generally brown, gray, gray-black or black. The colonies of a few strains were slightly purple or red. The colonies of some strains appeared to be light-colored in the early stage of growth and became dark gradually, which might be caused by the production of a large number of conidia or chlamydospores. In addition, a tiny minority of strains produced yellow or red pigments on CMMY medium. 41 representative fungi showed reproductive structures (66.13%). Among the endophytic fungi, the dominant classes were Sordariomycetes and Eurotiomycetes and the relative frequency (RF) was 66.19% and 20.45% respectively. The dominant orders were Hypocreales (RF=55.4%), Eurotiales (RF= 17.61%) and Pleosporales (RF=9.66%) with the dominant genera (RF=32.39%), (RF=15.06%), (RF=13.35%), unidentifiable genus 3 (RF=5.11%),(RF=3.98%), unidentifiable genus 2 (RF=3.41%), (RF=3.13%) and(RF=2.84%). Many endophytic fungi isolated from the banana roots in the study were common plant pathogenic fungi, such as , , , etc. The change law of Shannon-Wiener, Simpson’ Diversity and Evenness indicated that the endophytic fungi communities in Tanluo Town (TL2) and Luoxu Town (LX) of Nanning City were abundant and well-proportioned. The endophytic fungal communities from two locations of Dacheng Town (DC1 and DC2) of Qinzhou City showed the maximum similarity coefficients (Sorenson’s similarit coefficiens, =0.67). Habitats with different geographical conditions and climates are the main factors influencing the community composition and diversity of endophytic fungi in the roots of banana.
endophytic fungi; morphological characteristics; phylogenetic analysis; diversity index
10.3969/j.issn.1000-2561.2022.02.020
植物内生真菌(endophytic fungi)指那些其生活史的特定阶段或全部阶段寄生在植物组织内,而不对植物产生有害症状的一类真菌。许多证据表明,内生真菌与植物的结合对植物的适应性很重要,内生真菌定殖对植物的免疫系统、病害抑制、营养获取和对非生物胁迫的耐受性等方面都起着积极的影响。一些植物内生真菌的活性代谢产物不仅可以促进其宿主的生长、提高宿主抵抗病虫侵害的能力,对人类病原体还具有一定抑菌活性。
香蕉(spp.)归属于芭蕉科(Musaceae)芭蕉属(),为多年生大型草本单子叶植物,多生长于温暖潮湿的热带地区,是世界重要的热带和亚热带水果。有研究表明,一些分离自香蕉健康植株的内生真菌不仅可以促进植物根系定殖和植株的生长,还具有一定生防潜力,如抑制病原真菌菌丝生长、对植物病原线虫具有杀虫活性等。国内外对香蕉内生真菌种群多样性的研究较少,已有研究从香蕉的假茎、球茎、叶片、根系等组织中分离获得多种不同类群的内生真菌,发现香蕉体内具有种类丰富多样的内生真菌。根系是植物与微生物相互作用的重要场所,蕴含着大量内生真菌。香蕉的根系较为发达,可深入土壤生长,不同土层的根系内很可能含有丰富多样的内生真菌。广西是我国香蕉的主产区,香蕉产业是广西特色农业经济发展的支柱产业,然而目前对广西香蕉的研究多集中在枯萎病的相关研究,未见对其内生真菌的相关研究报道。为了发掘广西香蕉内生真菌的资源,本研究采用纯培养法分离获得广西香蕉根系内生真菌,通过形态学观察及分子系统学方法确定内生真菌的分类地位,了解其主要类群与物种多样性,不仅丰富了植物内生真菌资源库,也为开发利用内生真菌潜在的生态功能提供理论基础。
材料与方法
材料
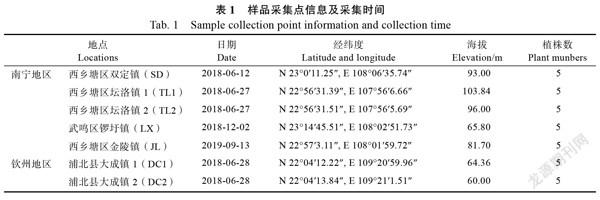
植物材料:分别于2018、2019年从广西香蕉主产区南宁和钦州采集香蕉‘威廉斯’品种根系样本,采样地及采样日期等信息见表1。每个样地按五点采样法采集香蕉健康植株根样,混合后放入自封袋,置于冰盒保存,带回实验室后放入4℃冰箱。
培养基:内生真菌菌株分离使用1/2玉米粉培养基(1/2CM):玉米粉琼脂8.5 g,琼脂粉7.5 g,蒸馏水1000 mL。菌株纯化使用玉米粉麦芽汁培养基(CMMY):麦芽汁琼脂10 g,玉米粉琼脂8.5 g,酵母提取物2 g,琼脂粉7.5 g,蒸馏水1000 mL。燕麦培养基(OA):MgSO·7HO 1.0 g,KHPO 1.5 g,NaNO 1.0 g,燕麦粉10 g,琼脂粉11 g,蒸镏水1000 mL。水琼脂培养基(WA):琼脂15 g,蒸馏水1000 mL。
方法
1.2.1 内生真菌的分离纯化与保存 用自来水将
香蕉根样冲洗干净后,在超净工作台将根样剪为1 cm左右的根段,随机选取24个根段,以75%酒精进行表面消毒40 s,用无菌水漂洗3次,再用0.1%升汞表面消毒4~5 min,无菌水漂洗3次后用无菌滤纸吸干根段表面的水分,随后将根段放置于1/2CM培养基上,每皿放置3个根段,每个样本5皿,同时吸取最后一次漂洗的无菌水100 µL涂布于CMMY培养基以验证消毒效果。置于25℃下培养,每天观察,待有菌丝从根段长出后及时转接至CMMY培养基上。纯化后的内生真菌菌株均保存于广西大学农学院应用微生物研究所和广西农业科学院植物保护研究所。
1.2.2 内生真菌形态观察 分离获得的内生真菌菌株经纯化后,接种于CMMY培养基,观察和记录菌株菌落的生长速度以及菌落的形态特征,包括菌落质地、颜色、有无色素产生等。真菌产孢结构观察:将菌株培养在OA培养基上,在菌落边缘45°插入灭菌盖玻片,28℃下培养至菌丝长到盖玻片上,取出盖玻片在光学显微镜下观察菌丝形态及产孢结构(包括分生孢子梗和分生孢子的形态、大小和颜色)等。对产孢量少或不产孢的菌株,可切取0.5 cm×0.5 cm的OA培养基方块,上下各夹一片无菌盖玻片,共置于WA培养基上,将菌株接种于OA培养基方块上,于28℃下培養10~14 d后放入4℃冰箱低温刺激产孢。取出盖玻片进行形态观察时,可根据观察需要使用乳酸酚棉兰染色后进行显微观察。
1.2.3 内生真菌的ITS序列分析 根据菌落形态等特征将分离的内生真菌菌株归类为71种不同的形态型,每种形态型选取1株代表菌株进行测序。挑取适量真菌菌丝体,按照真菌基因组DNA提取试剂盒(索莱宝,中国)的方法提取真菌DNA。rRNA基因的ITS1-5.8S-ITS4-28S部分区域PCR扩增使用引物为ITS1(5‒TCCGTAGGTGAACCTGCGG‒3)和ITS4(5‒TCCTCCGCTTATTGATATGC‒3)。PCR反应体系为:2×Easy PCR SuperMix 25 µL,正反引物各1 µL,模板DNA 1 µL,超纯水定容至50 µL。PCR反应参数:94℃预变性5 min,94℃变性1 min,53℃退火1 min,72℃延伸1 min,35个循环,最后72℃延伸10 min。
PCR扩增产物的纯化和测序工作由华大基因科技服务有限公司完成。测序获得的序列通过NCBI的BLAST检索系统进行同源序列比对,下载相似序列或参考相应文献下载构建系统发育树所需的序列,使用MEGA 6.0软件进行序列比对,基于Kimura双参数模型构建Neighbor-joining系统发育树,经Bootstrap 1000次循环检验系统树的可靠性。
数据处理
相对频率(relative frequency, RF)是指样本中分离到的某种真菌的菌株数占分离到的总菌株数的百分比。优势菌可通过Camargo指数(Camargo’s index)来确定。Camargo’s index=1/,其中代表物种丰富度,指样品中内生真菌的分类单元。如果RF>1/,则该分类单元可以确定为优势菌。物种丰富度(species richness, )、香农-维纳指数(Shannon-Wiener index, )、辛普森指数(Simpson index, )、均匀度指数(Evenness index, )和相似性系数(Sorenson’s similarit coefficiens, )计算公式如下:
=/ln
= 2/(+)
上述公式中,p为属相对频率,指样本中分离到的某属内生真菌的菌株数占分离到的总菌株数的百分比。代表2个样本共有真菌属数量,和分别代表2个样本中各自分离到的真菌属数量。
结果与分析
内生真菌分离结果
不同样地香蕉根系内生真菌的分离结果如表2。从168个香蕉根段分离的内生真菌菌株经过分离纯化后共获得352株内生真菌,其中,南宁地区222株,钦州地区130株。不同样地分离获得的内生真菌菌株数量存在差异,其中,金陵镇样地香蕉根部分离到的最多,共获得72株内生真菌,其次为大成镇2,获得69株内生真菌;坛洛镇2的香蕉根样分离到的内生真菌数量最少,为25株。金陵镇和坛洛镇2样地分离获得内生真菌菌株数差别较大的原因可能是2个样地香蕉根样采集的时间、季节不同(前者于2019年9月13日采集,后者于2018年6月27日采集),或是2个样地香蕉的种植年限及栽培管理措施不同。此外,内生真菌分离具有随机性也可能是不同样地根样中所获内生真菌数量不同的原因。
内生真菌的鉴定
根据菌株形态学特征(包括菌落形态、质地、颜色、有无色素产生等)将分离到的352株内生真菌划分为71个不同的形态型,每个形态型各选择1株代表菌株进行ITS序列测定,测得序列分别在GenBank数据库中进行比对分析,尽量选用已发表文章的序列或真菌鉴定权威机构的序列进行分子系统学分析,结合菌株形态特征,352株菌株共划分为62个分类单元,它们归属于5纲17目34科43属。每个分类单元选择一株代表菌株作进一步的形态特征观察和系统发育树的构建。
2.2.1 菌株形态学特征 将62株代表菌株接种至CMMY培养基上培养1周后,观察记录菌株的菌落形态和直径,发现大部分菌株生长速度较快,少数菌株长速较慢,其中有10株菌株长速很快,培养3~5 d即可长满90 mm培养皿,因此本研究单独记录这些菌株接种2 d后的菌落直径(表3)。这些代表菌株菌落颜色各异,浅色系的菌落一般呈白色、浅黄色或粉色等,深色的菌落一般为褐色、灰色、灰黑色至黑色,少数菌株菌落略呈紫色或红色。部分菌株在生长初期为浅色,后期菌落颜色逐渐变深,这可能是因为产生了大量分生孢子或厚垣孢子所致。此外,还有个别菌株可产生黄色或红色色素。观察发现这些代表菌株中有41株菌株能够产生分生孢子(66.13%),因此对这些产孢菌株的形态特征作进一步的观察和拍照,部分产孢内生真菌菌落和产孢结构如图1所示。
2.2.2 菌株基于ITS序列的系统发育学分析 对不同形态型的菌株进行ITS序列测定后在GenBank数据库进行比对分析,尽量选用已发表文章的序列或权威机构的序列与本研究中62株代表菌株的ITS序列进行系统发育树的构建。系统发育树中(图2),目標菌株的序列分别与不同属/种真菌的序列聚在独立的分支上。由于一些属真菌的种间差异性较小,在ITS序列构建的系统树中也未能明显分开,因此一些代表菌株未能鉴定到种。3个未鉴定属(包括5个代表菌株)的ITS序列在GenBank数据库中比对,与其相似性较高的均为未知分类地位的菌株序列,而且这些代表菌株均未产孢,难以通过形态学方法鉴定,因此将它们归为未鉴定菌株。
内生真菌的种类组成
7个样地分离获得的352株内生真菌归属于5纲17目34科43属62个分类单元,其中有3个未鉴定属(表4)。从表中可知,2株菌株属于担子菌门(Basidiomycota)伞菌纲(Agaricomycetes, 0.57%),2株菌株属于毛霉菌门(Mucoromycota)毛霉菌纲(Mucoromycetes, 0.57%),32株菌株属于子囊菌门(Ascomycota)座囊菌纲(Dothideomycetes, 12.22%),72株菌株属于子囊菌门散囊菌纲(Eurotiomycetes, 20.45%),233株菌株属于子囊
菌门粪壳菌纲(Sordariomycetes, 66.19%)。
相对频率(RF)反映了样本真菌群落中某类真菌的优势度。所有分离菌株中,优势纲为粪壳菌纲(Sordariomycetes, RF=66.19%)和散囊菌纲(Eurotiomycetes, RF=20.45%)。优势目为肉座菌目(Hypocreales, RF=55.4%)、散囊菌目(Eurotiales, RF=17.61%)和格孢腔菌目(Pleosporales, RF=9.66%)。优势属为镰刀菌属(, RF= 32.39%)、青霉属(, RF=15.06%)、木霉属(, RF=13.35%)、未鉴定属3(RF= 5.11%)、帚枝霉属(, RF=3.98%)、未鉴定属2(RF=3.41%)、弯孢属(, RF= 3.13%)和突脐蠕孢属(, RF=2.84%),但后5个属的相对频率未超过10%,其优势不明显。
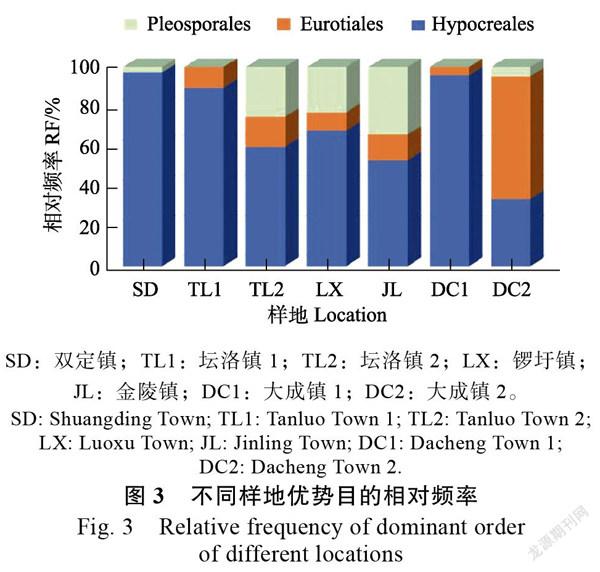
不同地理位置香蕉根系内生真菌群落的优势类群在目和属水平上有差异。如图3所示,内生真菌优势目中,所有样地的共有优势目为肉座菌目(Hypocreales),坛洛镇2、锣圩镇、金陵镇和大成镇2这4个样地的优势目有3个,双定镇、坛洛镇1和大成镇1这3个样地的优势目有2个。除了大成镇2的最优势目为散囊菌目(Eurotiales),其余样地的最优势目均为肉座菌目(Hypocreales)。所有样地均没有特有优势目。
如图4所示,在内生真菌优势属中,所有样地的共有优势属为镰刀菌属()和木霉属();大成镇1样地香蕉根系内生真菌的最优势属为木霉属,大成镇2的最优势属为青霉属(),其余5个样地的最优势属均为镰刀菌属。锣圩镇特有优势属为(),
金陵镇特有优势属为曲霉属(),其余5个样地均没有特有优势属。
内生真菌的多样性和相似性分析
2.4.1 内生真菌的α-多样性 α-多样性可用来分析内生真菌群落的物种多样性,香农-维纳指数()与物种丰富度()的关系最密切,而辛普森指数()则与物种丰富度关系较远,对物种均匀度()的敏感性高于香农-维纳指数()。地理位置对香蕉根系内生真菌群落多样性的影响见表5,结果表明,这些样地香蕉根系内定殖有丰富多样的内生真菌。其中,坛洛镇2的香农-维纳指数()最高,其次为锣圩镇。金陵镇的辛普森指数()最高,其次为坛洛镇的2个样地。所有样地中,金陵镇和大成镇2样地的香农-维纳指数()较低,分别为2.15和1.94;双定镇和大成镇2样地的辛普森指数()较低,分别为0.67和0.6。均勻度指数()用于分析内生真菌群落分布的均匀程度。坛洛镇2的均匀度指数最高,说明该样地中香蕉根系内生真菌群落的分布最均匀,其次为锣圩镇,均匀度指数为1.22;而金陵镇的均匀度指数最低,说明该样地的香蕉根系内生真菌群落分布的均匀程度最低。香农-维纳指数()、辛普森指数()和均匀度指数()在7个样地间的变化规律不完
全一致。综合来看,坛洛镇2和锣圩镇样地香蕉根系的内生真菌种群多样性较丰富,群落分布较均匀。
2.4.2 内生真菌的相似性 由表6看出,7个不同样地香蕉根系内生真菌的相似性存在差异,钦州地区2个样地(大成镇1、大成镇2)的相似性系数最大,为0.67,说明这2个样地香蕉根系内生真菌种类组成最为相似;其次是金陵镇和锣圩
镇,相似性系数为0.59。坛洛镇1和金陵镇的香蕉根系内生真菌相似性最低,相似性系数仅为0.19,说明这2个样地香蕉根系内生真菌种类组成差异较大,其次为双定镇和金陵镇,这2个样地间的相似性系数为0.21。
讨论
真菌菌株形态特征结合ITS序列分析方法已经被广泛应用于内生真菌的鉴定及多样性研究中。本研究通过采用形态特征观察和ITS序列分析相结合的方法,对获得的352株内生真菌进行鉴定,结果表明广西香蕉根系内生真菌具有丰富的物种多样性。这些内生真菌大部分为子囊菌,少部分属于接合菌和担子菌,这与其他学者对香蕉内生真菌的研究结果一致。国内外学者对香蕉植株各部位内生真菌种群的研究结果表明,香蕉根系内生真菌常见类群主要有:曲霉属()、枝孢属()、弯孢属()、镰刀菌属()、、青霉属()以及一些无孢菌类真菌;叶部内生真菌常见类群主要有:炭疽菌属()、弯孢属、盘长孢属()、球座菌属()、、黑孢属()、青霉属、拟盘多毛孢属()、拟茎点霉属()、、轮枝菌属()、以及无孢菌类真菌,此外,假茎中常见类群有:、镰刀菌属、黑孢属、、木霉属(),球茎中常见类群有镰刀菌属、、葡萄穗霉属(),叶轴中镰刀菌属较为常见。本研究中香蕉根系内优势属为弯孢属、突脐蠕孢属()、镰刀菌属、青霉属、帚枝霉属()、木霉属和2个未鉴定属,这一结果与前人的研究结果相似。弯孢属、突脐蠕孢属、镰刀菌属、青霉属和木霉属真菌产孢量大,适应性强,这类真菌在自然界广泛存在,能在多种生境、多种类型的植物组织中定殖,也因此常常在植物内生真菌中占据优势地位。本研究所有样地香蕉根系内生真菌的共有优势属为镰刀菌属和木霉属,这也说明了这2个属真菌广泛存在于植物组织内。
有研究表明,、链格孢属()、枝孢属、、炭疽菌属、间座壳属()、镰刀菌属、毛霉属()和茎点霉属()等常为植物根系内生真菌的主要类群,但本研究仅分离到这些属真菌的少量菌株,并未作为香蕉根系内生真菌的主要类群存在,可见地域环境和宿主种类等因素的差异性对植物内生真菌种群多样性的影响较大。本研究分离到的内生真菌中有不少菌株为常见的植物病原真菌,如镰刀菌属、炭疽菌属、枝孢属等。镰刀菌属真菌经常作为植物病原菌存在,但也有不少报道证明该属真菌作为植物内生菌时,一般情况下不会引起其宿主产生病害症状,甚至具有促生、抗病虫等正面作用。一些研究表明,植物健康组织中定殖着大量常见病原真菌,如拟茎点霉属、链格孢菌()、博宁炭疽菌()、小孢拟盘多毛孢()等,这些真菌在内生阶段不会对其宿主产生明显的负面作用,但在环境条件或植物生理条件改变,如植株衰退时,这些内生的潜在病原菌可能会产生致病性。
本研究中,不同地理位置的香蕉根系内生真菌群落种类、组成和分布有所差异。有研究表明,内生真菌的种类、分布与多样性受到多种因素影响,如气温、光照等环境因素、植物种类等。对植物根系内生真菌而言,土壤类型,土壤因子(如土壤pH等)对其定殖率、种类组成及种群多样性的影响也比较明显。本研究对香蕉根样的采集时间不同,部分样本是在夏季采集(双定镇、坛洛镇1、坛洛镇2、大成镇1、大成镇2),而一部分样本是在秋冬季节采集(锣圩镇、金陵镇),当时的环境因素如温度、湿度、降雨量等对内生真菌种类组成也有一定影响。梁雪娟等的研究表明,在秋季杜仲中分离得到的内生真菌种类和数量较多,但在本研究中,由于不同季节所采集的样本数量有限,也未针对不同采集时间进行内生真菌的研究和比较,因此,样本采集时间对香蕉内生真菌种群组成及分布的影响还有待进一步研究。α-多样性指数和均匀度结果表明,广西香蕉根系定殖有丰富多样的内生真菌。不同样地香蕉根系内生真菌的种类和组成有所不同,其中钦州地区大成镇2个样地的相似性系数最大(0.67),说明这2个样地之间的香蕉根系内生真菌组成最为相似,产生该结果的原因可能是这2个样地的采集时间相近,且样地间距离较近,其平均温度、日照、降雨量等气候环境较为相似。不同采样点的地理环境和气候给香蕉提供了不同的生境条件,是影响香蕉根系内生真菌种类组成及多样性差异的主要因素之一。
62株代表菌株中有41株菌株产孢,可进行产孢结构的观察,其余22株不产孢的菌株通过低温刺激和黑光灯间歇照射培养后仍未能产孢。产孢菌株中由于部分属内种间亲缘关系较近,种间的形态特性差异较小,不产孢菌株也未观察到可作为真菌鉴定依据的产孢结构特征,而且仅菌株ITS序列分析结果也无法明确区分属内不同物种之间的差异,因此部分菌株仍未能确定到种,这对真菌鉴定工作造成一定困难。对不产孢菌株今后可采用菌丝损伤、更换培养基、添加鸭跖草汁、紫外线照射等方法进行诱导产孢,对未鉴定菌株还可采用多序列分析方法进一步完成真菌鉴定工作。
参考文献
- HIRUMA K, GERLACH N, SACRISTAN S, NAKANO R T, HACQUARD S, KRACHER B, NEUMANN U, RAMIREZ D, BUCHER M, O’CONNELL R J, SCHULZ-LEFERT P. Root endophyte confers plant fitness benefits that are phosphate status dependent[J]. Cell, 2016, 165(2): 464-474.
- HAMAYUN M, HUSSAIN A, KHAN S A, KIM H Y, KHAN A L, WAQAS M, IRSHAD M, IQBAL A, REHMAN G, JAN S, LEE I J. Gibberellins producing endophytic fungus AGH786 rescues growth of salt affected soybean[J]. Frontiers in Microbiology, 2017, 8: 686.
- 姚裕群. 越南槐内生真菌多样性、抑菌活性及其次生代谢产物研究[D]. 南宁: 广西大学, 2017.YAO Y Q. The diversity, antimicrobial activity and secondary metabolites of endophytic fungi in Gagnep[D]. Nanning: Guangxi University, 2017. (in Chinese)
- REHBERG N, AKONE H S, IOERGER T R, ERLENKAMP G, DALETOS G, GOHLKE H, PROKSCH P, KALSCHEUER R. Chlorflavonin targets acetohydroxyacid synthase catalytic subunit IlvB1 for synergistic killing of [J]. ACS Infectious Diseases, 2018, 4(2): 123-134.
- GUZZON F, MÜLLER J V. Current availability of seed material of enset (, Musaceae) and its Sub-Saharan wild relatives[J]. Genetic Resources and Crop Evolution, 2016, 63(2): 185-191.
- SULISTYANINGSIH L D. The diversity of wild banana species (genus ) in Java[J]. Makara Journal of Science, 2016, 20(1): 40-48.
- BECHEM E E T, WAPOUO S F, LOUBANA P M. Nematicidal properties of endophytic fungi isolated from some species in Cameroon, for the management of and [J]. Journal of Advances in Biology & Biotechnology, 2018, 19(4): 1-19.
- BROWN K B, HYDE K D, GUEST D I. Preliminary studies on endophytic fungal communities of species complex in Hong Kong and Australia[J]. Fungal Diversity, 1998, 1: 27-51.
- PHOTITA W, LUMYONG S, LUMYONG P, HYDE K D. Endophytic fungi of wild banana () at doi Suthep Pui National Park, Thailand[J]. Mycological Research, 2001, 105: 1508-1513.
- CAO L X, YOU J L, ZHOU S N. Endophytic fungi from leaves and roots in South China[J]. World Journal of Microbiology and Biotechnology, 2002, 18: 169-171.
- 曹理想, 田新莉, 周世宁. 香蕉内生真菌、放线菌类群分析[J]. 中山大学学报(自然科学版), 2003, 42(2): 70-73.CAO L X, TIAN X L, ZHOU S N. Isolation of endophytic fungi and actinomycetes from banana () plants[J]. Acta Scientiarum Naturalium Universitatis Sunyatseni, 2003, 42(2): 70-73. (in Chinese)
- 李梅婷. 香蕉根际及内生真菌和放线菌与香蕉病害的相关性[D]. 福州: 福建农林大学, 2007.LI M T. Relationship of rhizosphere and endophytic fungi and actinomyces of spp. with banana diseases[D]. Fuzhou: Fujian Agriculture and Forestry University, 2007. (in Chinese)
- ZAKARIA L, JAMIL M I M, ANUAR I S M. Molecular characterisation of endophytic fungi from roots of wild banana ()[J]. Tropical Life Sciences Research, 2016, 27(1): 153-162.
- ZAKARIA L, AZIZ W. Molecular identification of endophytic fungi from banana leaves ( spp.)[J]. Tropical Life Sciences Research, 2018, 29: 201-211.
- HENAO S Z, VÁSQUEZ M C H, HOYOS L F P, TORRES J D S, HOYOS-CARVAJAL L M. Fungal endophytes in bananas cv Manzano affected by [J]. African Journal of Agricultural Research, 2019, 14(7): 430-438.
- 黄穗萍, 莫贱友, 郭堂勋, 李其利, 潘朝勃. 广西香蕉枯萎病4号生理小种发生情况及香蕉品种抗性鉴定[J]. 南方农业学报, 2013, 44(5): 769-772.HUANG S P, MO J Y, GUO T X, LI Q L, PAN Z B. Occurrence of f. sp. tropical race 4 and resistance identification of banana varieties in Guangxi[J]. Journal of Southern Agriculture, 2013, 44(5): 769-772. (in Chinese)
- NARISAWA K, KAWAMATA H, CURRAH R S, HASHIBA T. Suppression of wilt in eggplant by some fungal root endophytes[J]. European Journal of Plant Pathology, 2002, 108: 103-109.
- 柴新义, 钟媛媛. 青檀果内生真菌菌群的组成及多样性[J]. 应用生态学报, 2017, 28(2): 636-642.CAI X Y, ZHONG Y Y. Community composition and diversity of endophytic fungi from the fruits of [J]. Chinese Journal of Applied Ecology, 2017, 28(2): 636-642. (in Chinese)
- JIN H, YAN ZQ, LIU Q, YANG X Y, CHEN J X, QIN B. Diversity and dynamics of fungal endophytes in leaves, stems and roots of L. in northwestern China[J]. Antonie van Leeuwenhoek, 2013, 104: 949-963.
- YOU Y H, PARK J M, PARK J H, KIM J G. Diversity of endophytic fungi associated with the roots of four aquatic plants inhabiting two wetlands in Korea[J]. Mycobiology, 2015, 43: 3, 231-238.
- LI P Q, WU Z, LIU T, WANG Y N. Biodiversity, phylogeny, and antifungal functions of endophytic fungi associated with [J]. International Journal of Molecular Sciences, 2016, 17(9): 1541.
- DEEPTHIA A S, RAY J G. Endophytic diversity of hanging velamen roots in the epiphytic orchid [J]. Plant Ecology & Diversity, 2018, 11: 5-6, 649-661.
- 邓 勤. 角果木及其内生真菌多样性与代谢产物研究[D]. 海口: 海南大学, 2018.DENG Q. The study of diversity analysis and bioactive constituents from and it’s endophytic[D]. Haikou: Hainan University, 2018. (in Chinese)
- MARYANI N, LOMBARD L, POERBA Y S, SUBANDIYAH S, CROUS P W, KEMA G H J. Phylogeny and genetic diversity of the banana wilt pathogen f. sp. in the Indonesian centre of origin[J]. Studies in Mycology, 2019, 92: 155-194.
- MEDEIROS ARAÚJO M B, MOREIRA G M, NASCIMENTO L V, NOGUEIRA G D A, NASCIMENTO S R D C, PFENNING L H, AMBRÓSIO M M D Q. rot of melon is caused by several species[J]. Plant Pathology, 2020, 70(3): 712-721.
- PAPARU P, DUBOIS T, COYNE D, VILJOEN A. Effect of endophyte inoculation on the activities of phenylpropanoid pathway enzymes and numbers in susceptible and tolerant East African Highland bananas[J]. Nematology, 2010, 12(3): 469-480.
- WAWERU B, TUROOP L, KAHANGI E, COYNE D, DUBOIS T. Non-pathogenic endophytes provide field control of nematodes, improving yield of banana ( sp.)[J]. Biological Control, 2014, 74: 82-88.
- 臧 威, 孙 翔, 孙剑秋, 于文喜, 王雪松, 尹军霞, 宋瑞清. 南方红豆杉内生真菌的多样性与群落结构[J]. 应用生态学报, 2014, 25(7): 2071-2078.ZANG W, SUN X, SUN J Q, YU W X, WANG X S, YIN J X, SONG R Q. Diversity and community structure of endophytic fungi from var. [J]. Chinese Journal of Applied Ecology, 2014, 25(7): 2071-2078. (in Chinese)
- 张少鹏, 胥 婷, 杨丽强, 宋 宇, 李新宇, 张惠文. 不同草原类型针茅根部内生真菌群落结构[J]. 应用生态学报, 2014, 25(12): 3475-3482.ZHANG S P, XU T, YANG L Q, SONG Y, LI X Y, ZHANG H W. Endophytic fungal communities of sp. roots in different types of steppes in northern[J]. Chinese Journal of Applied Ecology, 2014, 25(12): 3475-3482. (in Chinese)
- SADEGHI F, SAMSAMPOUR D, SEYAHOOEI M A, BAGHERI A, SOLTANI J. Diversity and spatiotemporal distribution of fungal endophytes associated with cv. [J]. Current Microbiology, 2019, 76: 279-289.
- DASILA K, PANDEY A, SAMANT S S, PANDE V. Endophytes associated with Himalayan silver birch ( D. Don) roots in relation to season and soil parameters[J]. Applied Soil Ecology, 2020, 149: 103513.
- 梁雪娟, 张水寒, 张 平, 彭 菲, 柯 健, 糜亚男. 不同产地杜仲皮内生真菌种群结构的比较分析[J]. 中国中药杂志, 2014, 39(2): 204-208.LIANG X J, ZHANG S H, ZHANG P, PENG F, KE J, MI Y N. Comparative study on distribution of endophytic fungi in from different habitats[J]. Chinese Journal of Traditional Chinese Medicine, 2014, 39(2): 204-208. (in Chinese)
- GONZALEZ V, LUISA TELLO M. The endophytic mycota associated with in central Spain[J]. Fungal diversity, 2011, 47(1): 29-42.
- 刘丽丽, 朱杰华, 崔亚婧, 杨志辉,徐 进,路文雅. 培养条件对茄链格孢产孢的影响[J]. 菌物学报, 2014, 33(3): 659-667.LIU L L, ZHU J H, CUI Y J, YANG Z H, XU J, LU W Y. Effects of culture conditions on sporulation of [J]. Mycosystema, 2014, 33(3): 659-667. (in Chinese)
- 梁玎玎, 张艳丽, 谷祖敏. 草茎点霉SYAU-06菌株诱导产孢方法研究[J]. 农药, 2020, 59(3): 219-222.LIANG D D, ZHANG Y L, GU Z M. Study on sporulation conditions of SYAU-06 strain[J]. Agrochemicals, 2020, 59(3): 219-222. (in Chinese)
-
收稿日期 2021-07-06;修回日期 2021-10-23
基金项目 广西研究生教育创新计划资助项目(No. YCBZ2018015);广西自然科学基金项目(No. 2019GXNSFAA185051);广
西农业科学院科技发展基金项目(桂农科2019M18)
作者简介 陈艳露(1987—),女,博士研究生,研究方向:真菌分类学。*同等贡献作者:谢 玲(1977—),女,研究员,研
究方向:植物内生真菌资源及其开发利用。**通信作者(Corresponding author):刘 斌(LIU Bin),E-mail:
liubin@gxu.edu.cn。

