葛根芩连汤对糖尿病肾病大鼠肾组织的保护作用
郭志伯,马李娜,刘丹阳
糖尿病肾病(diabetic nephropathy,DN)是由II型糖尿病引起的一种慢性多功能退行性并发症,约有30%的糖尿病患者发展为DN[1]。DN是导致末期肾衰竭及死亡的主要原因,严重影响世界人口的健康水平,给社会造成沉重的经济负担[2]。其特点是肾脏的形态、超微结构和功能变化,蛋白尿,细胞外基质蛋白的过度沉积等[3]。DN发病机制复杂,严重影响糖尿病患者的预后和生存,研究显示,DN患者的病死率比单纯糖尿病患者的病死率高3~12 倍,而且DN的发展增加了心血管发病率和病死率的风险[4-6]。目前,迫切需要新的疗法来减轻糖尿病并发症的风险。
葛根芩连汤(Gegen Qinlian decoction,GQD)是一种中药方剂,以葛根为主,并辅以黄连、黄芩和甘草组成,具有疏风解表、燥湿止利之功效。研究发现,GQD可以有效的用于糖尿病及其并发症的预防和治疗[7-9]。目前临床上对于DN治疗尚无特效的措施,虽然临床上常用的西药种类繁多,但是其使用对肝肾功能损害较大,因此,GQD 等中药在DN 的治疗上具有较大潜力。由于GQD 成分复杂,其机制尚不清楚,本研究旨在探讨GQD 对DN 大鼠肾组织的保护作用及其作用机制。
1 材料和方法
1.1 实验动物 无特定病原体级SD 大鼠,雌雄各半,体质量200 g 左右,30 只,8 周,购自中国军事医学科学院实验动物中心,生产许可证号:SCXK(军)2007-004。饲养于河北医科大学动物实验室,12 h/12 h 明暗交替,温度22 ℃±2 ℃,湿度50%±5%。自由进水饮食。实验过程符合河北医科大学实验动物伦理委员会规定。
1.2 试剂和仪器 链脲佐菌素(streptozotocin, STZ,Sigma 公司,美国),体重计(美国GE 公司),骨形成蛋白(bone morphogenetic protein 2,BMP-2)、磷酸甘油醛脱氢酶(glyceraldehyde 3-phosphate dehydro‐genase,GAPDH)、SMAD 家族成员1(SMAD family member 1,Smad1)、Smad4 兔抗大鼠多克隆抗体、辣根过氧化物酶(horseradish peroxidase,HRP)标记山羊抗兔免疫球蛋白G(英国Abcam 公司),BCA 蛋白定量(Bicinchoninic Acid Assay,BCA)试剂盒、原位末端转移酶标记技术(terminal deoxynucleotidyl transferase-mediated dUTP-biotin nick end labeling assay,TUNEL)凋亡试剂盒、实时荧光定量聚合酶链式反应(quantificational real-time polymerase chain reaction,qRT-PCR)试剂盒(上海碧云天生物技术有限公司),Trizol(Invitrogen 公司,美国),Western blot电泳仪(BIO-RAD 公司,美国),7500-Fast 实时PCR系统(Applied Biosystems,美国),葛根、炙甘草、黄连、黄芩(北京同仁堂药店),相关引物由上海生工(中国)合成。
1.3 糖尿病肾病大鼠模型制备 GQD 按《伤寒论》步骤制备:取葛根250 g,黄芩150 g,黄连150 g,炙甘草100 g,用10倍质量的水分别对各中药进行20 min浸泡。先煎葛根,水沸后煎煮20 min,加入其余已浸泡的药汤继续煎至40 min,过滤后,残渣中加8倍量的水,煎煮30 min,把2 次滤过的汤剂混合,调整全方生药量2 g/mL,浓缩水煎液后备用。30 只SD大鼠随机分为3组,每组10只。对照组以生理盐水l灌胃,余20 只采用高脂饲料喂养+STZ 腹腔注射制作DN大鼠模型,造模大鼠均高脂饲料喂养,按文献方法腹腔注射STZ,每周1次,连续3周,造模完成后72 h 后,经尾静脉采血测血糖,血糖16.7 mmol/L 为糖尿病模型复制成功。1 周后留取大鼠即刻尿,测尿微量白蛋白及尿肌酐,模型组的尿微量白蛋白/尿肌酐显著高于正常对照组,即为DN大鼠造模成功。20 只均造模成功。GQD 组:按生药量10 g/kg GQD灌胃,1次/日,模型(DN)组同法灌胃相同体积的生理盐水,3组均持续灌胃12周。
1.4 血糖、血清胰岛素、血肌酐和尿素氮及24 h 尿蛋白的水平 各组处理结束后,行主动脉取血,部分滴至血糖试纸测量血糖浓度,取部分血浆,利用ELISA 试剂盒操作说明测定各组血浆胰岛素水平。另取部分血液,离心半径10 cm,4 000 r/min离心3 min。取血清,使用肌酐测试试剂盒(苦味酸不除蛋白法)测定血清肌酐水平;使用尿素氮试剂盒(尿酶法)测定血清尿素氮的水平。收集各组大鼠24 h 尿液,混匀,用移液枪各取尿量5 mL,离心半径10 cm ,5 000 r/min 离心3 min。吸取上清液,放入全自动生化仪,检测各组大鼠24 h的尿蛋白水平。
1.5 炎症因子测定 大鼠禁食12 h,颈总动脉取血,离心半径10 cm,4 000 r/min离心10 min。后取上清即得血清,采用ELISA 试剂盒检测血清白细胞介素-6(interleukin,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)炎症因子的水平,操作严格按照试剂盒说明进行。
1.6 大鼠脏器指数测定 实验结束后,对各组大鼠均进行3 次体质量测定,并称重。后对以上各组大鼠腹腔麻醉,取左肾组织,置于培养皿中,并进行称重。同时计算脏器指数,脏器指数= 肾脏重量/大鼠体质量×100%。
1.7 肾脏组织细胞凋亡检测 实验结束后,每组随机选取3 只大鼠肾组织,制作石蜡切片,应用末端脱氧核苷酸转移酶介导dUTP 缺口末端标记法(TUNEL)检测细胞凋亡。实验结束后,破片经甲醛固定,磷酸缓冲液清洗3 次,室温下依次进行1%Tritonx-100 通透,TdT 酶反应液反应、显色,在显微镜下观察,并统计TUNEL+细胞数。
1.8 qRT-PCR 检测相关基因mRNA 水平变化 实验结束后,每组随机选取3只大鼠的肾组织。立即加入Trizol 试剂(Invitrogen)提取总RNA,用NanoDrop ND-2000检测总RNA的质量和浓度。利用逆转录酶合成cDNA,逆转录的反应条件为:25 ℃10 min,48 ℃30 min,95 ℃5 min。利用SYBR Green PCR试剂盒检测相关mRNA的表达水平,通过7500-Fast实时PCR系统上机检测。反应条件:95 ℃5 min,95 ℃10 s,60 ℃30 s,进行40个循环。利用2-ΔΔCt法计算进行结果分析。所用引物序列见表1。

表1 QPCR的引物序列
1.9 肾组织相关蛋白水平测定 每组随机选取3只大鼠肾脏组织,磷酸缓冲液清洗组织后加入裂解液,组织匀浆、超声裂解离心后获得蛋白样本。采用BCA 法测量蛋白浓度,将所有样本的蛋白定容至等浓度。进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳,电泳后将凝胶中的蛋白转入聚偏二氟乙烯膜,加入Abcam 公司兔抗鼠一抗PI3K(1:2 000)、p-PI3K(1:2 000)、AKT(1:3 000)、p-AKT抗体(1:3 000),4 ℃孵育聚偏二氟乙烯膜过夜,随后使用HRP 标记的山羊抗兔二抗(WLA023a;1:1 000)常温孵育1 h,用ECL Plus Western 印迹检测试剂进行显色。
1.10 统计学处理 应用SPSS24.0软件,变量资料采用均数±标准差()表示,两两比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠血糖、血清胰岛素、血肌酐和尿素氮及24 h 尿蛋白的水平变化 与对照组比较,DN 组大鼠血糖、血肌酐和尿素氮及24 h尿蛋白的水平明显升高(t= 64.08, 30.14, 24.12, 19.36; 均P<0.05),血清胰岛素水平降低(t=23.95,P<0.01),GQD 处理组大鼠血糖、血肌酐和尿素氮及24 h尿蛋白显著降低(t= 52.26, 18.00, 20.56, 13.94; 均P< 0.05),血清胰岛素水平升高(t=15.83,P<0.01),表2、图1。
表2 各组大鼠血糖、血清胰岛素、血肌酐和尿素氮及24 h尿蛋白的水平比较(±s)

表2 各组大鼠血糖、血清胰岛素、血肌酐和尿素氮及24 h尿蛋白的水平比较(±s)
与对照组比较,*P<0.05;与DN组比较,#P<0.05
分组对照组DN组GQD组例数10 10 10血清胰岛素(mU/L)23.05±1.06 11.61±1.08*18.81±0.95#血糖水平3.54±0.05 25.51±1.08*6.62±0.37#血肌酐(μmol/L)24.86±1.26 43.15±1.45*32.98±1.04#尿素氮(mmol/L)11.17±0.60 20.45±1.06*12.87±0.49#24 h尿蛋白(μg/d)21.92±1.09 32.40±1.32*25.26±0.94#

图1 各组大鼠血清胰岛素、血糖、血肌酐和尿素氮及24 h尿蛋白的水平比较
2.2 各组大鼠脏器指数变化 通过测量各组大鼠的体质量和肾脏重量变化可知,与对照组比较,DN组大鼠体质量下降,肾脏重量增加,脏器指数升高(t=15.90,P<0.05);与DN 组比较,GQD 组大鼠体质量增加,肾脏重量减小,脏器指数下降(t=11.09,P<0.05),表3、图2。
表3 各组大鼠脏器指数(±s)
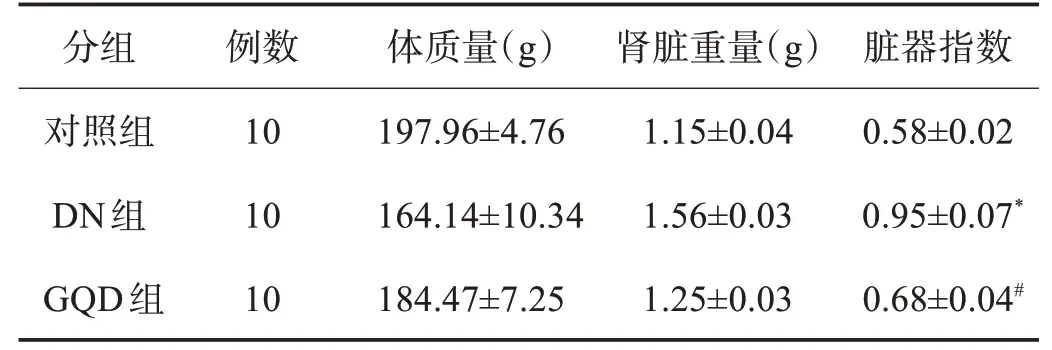
表3 各组大鼠脏器指数(±s)
与对照组比较,*P<0.05;与DN组比较,#P<0.05
分组对照组DN组GQD组例数10 10 10体质量(g)197.96±4.76 164.14±10.34 184.47±7.25肾脏重量(g)1.15±0.04 1.56±0.03 1.25±0.03脏器指数0.58±0.02 0.95±0.07*0.68±0.04#

图2 各组大鼠脏器指数比较
2.3 各组大鼠血清炎症因子变化 ELISA 结果显示,与对照组比较,DN 组大鼠血清炎症因子IL-6、TNF-α水平均明显升高(t=36.55,31.90;均P<0.05);与DN 组比较,GQD 组大鼠血清炎症因子IL-6、TNF-α 水平明显降低(t=33.42, 26.48; 均P< 0.05),表4、图3。
表4 各组大鼠血清炎症因子水平比较(±s)

表4 各组大鼠血清炎症因子水平比较(±s)
与对照组比较,*P<0.05;与DN组比较,#P<0.05
分组对照组DN组GQD组例数10 10 10 IL-6(pg/mL)1.11±0.08 5.55±0.37*1.41±0.11#TNF-α(pg/mL)0.43±0.03 4.54±0.40*0.95±0.13#

图3 各组大鼠血清炎症因子水平比较
2.4 各组大鼠肾组织细胞凋亡水平变化 TUNEL结果显示,与对照组比较,DN组大鼠细胞凋亡水平升高(t=17.10,P<0.05);与DN 组比较,GQD 组大鼠细胞凋亡水平明显降低(t=6.67,P<0.05),表5、图4。
表5 各组大鼠肾脏组织细胞凋亡水平变化比较(±s)

表5 各组大鼠肾脏组织细胞凋亡水平变化比较(±s)
与对照组比较,*P<0.05;与DN组比较,#P<0.05
分组对照组DN组GQD组例数3 3 3细胞凋亡率4.72±0.62 29.65±2.45*14.46±3.09#

图4 各组大鼠肾脏组织细胞凋亡水平变化比较(×200)
2.5 各组大鼠PI3K、AKT mRNA 和蛋白磷酸化水平变化 qRT-PCR 及蛋白印记结果显示,与对照组比较,DN 组大鼠PI3K、AKT mRNA 水平表达降低,蛋白磷酸化水平降低(t=15.79, 16.88, 19.44, 13.86;P<0.05);与DN 组比较,GQD 组大鼠PI3K、AKT mRNA 水平表达升高,蛋白磷酸化水平升高(t=7.76,5.67,9.52,5.88;P<0.05),表6、图5。

图5 各组大鼠肾脏组织PI3K、AKT及其蛋白磷酸化表达变化比较
表6 各组大鼠肾脏组织PI3K、AKT mRNA及其蛋白磷酸化表达变化比较(±s)

表6 各组大鼠肾脏组织PI3K、AKT mRNA及其蛋白磷酸化表达变化比较(±s)
与对照组比较,*P<0.05;与DN组比较,#P<0.05
分组对照组DN组GQD组例数3 3 3 mRNA PI3K 1.74±0.13 0.45±0.05*1.29±0.18#AKT 1.04±0.06 0.29±0.05*0.63±0.09#蛋白磷酸化水平p-PI3K 0.96±0.07 0.12±0.03*0.77±0.12#p-AKT 0.39±0.04 0.07±0.02*0.22±0.09#
3 讨论
DN 属于临床上常见疾病,属于糖尿病诱发的肾脏微血管并发症,其特征是蛋白尿和肾功能的逐渐丧失,是末期肾病的主要原因[10-11]。全世界糖尿病的患病率已经达到流行程度。目前,糖尿病已经影响到全球8%以上的人口(近3.5 亿人),预计到2035 年将增加到5.5 亿人以上[12],据统计,超过40%的糖尿病患者会患上慢性肾病[13]。DN 具体发病机制复杂,缺乏特异性治疗方法。迫切需要发现特异性有效药物应用于DN的临床治疗。
GQD是一种著名的中草药配方,在中国使用已经近2 000年,被广泛应用于治疗胃肠道疾病,特别是传染性腹泻[14]。GQD 除了改善腹泻小鼠的身体状况外,还表现出显著的抗炎活性,抑制炎症因子的释放,有助于肠道黏膜炎性损伤的恢复[15]。最近的研究证实,GQD被广泛的应用于II型糖尿病的治疗[16-17]。DN是由糖尿病引起的严重并发症,炎症因子IL-6是临床上应用广泛的促炎因子,其升高往往反应机体炎症反应的产生,TNF-α 是机体重要的免疫调节因子,在DN 患者血清中IL-6 和TNF-α 水平显著升高[18-19]。本研究中,DN大鼠血清IL-6、TNF-α炎症因子的急剧升高,说明本实验大鼠模型制备成功。GQD处理能降低DN模型组大鼠肾组织处炎症因子IL-6和TNF-α的释放,提示GQD处理可以缓解DN 大鼠炎症损伤。基于PI3K/AKT 信号通路对于调控炎症反应具有重要作用[20]。研究显示,DN模型存在信号通路状态的紊乱,如高啸等人[21]的研究表明HMGB1-RAGE/TLRs-NF-κB 相关蛋白在DN小鼠中表达升高。本研究检测了PI3K/AKT信号通路的状态,结果显示,DN大鼠肾组织PI3K、AKT 磷酸化水平下降,GQD 处理能提高PI3K/AKT 蛋白磷酸化的水平。提示GQD 可增强PI3K/AKT 的水平。除此之外,还检测了血糖、血肌酐、尿素氮和24 h尿蛋白得含量,血肌酐可以用来判断肾功能损伤程度,其他3 项指标也有助于辅助综合分析肾脏的损伤,结果显示,GQD 处理后,以上指标均显著降低,说明GQD能显著改善DN大鼠的肾脏损伤。
本研究采用高脂饲养+STZ 腹腔注射制备DN大鼠模型,此方法方便简单,可行性较强。实验结果表明,GQD 处理能够抑制DN 大鼠的炎症水平,抑制肾脏细胞凋亡水平,改善DN 大鼠的肾脏损伤,机制研究发现,GQD 可能通过PI3K/AKT 信号通路发挥作用。

