不同信号肽对嵌合抗原受体T细胞杀伤作用的影响研究
李 帆,张琴星,童祥文,田高辉,顾力行,徐 瑶
武汉科技大学生命科学与健康学院 生物医学研究院,湖北 武汉430081
1975年,洛克菲勒大学细胞生物学教授Bloble等[1]在一项研究中发现新合成的蛋白质具有内源性信号,即信号肽(signal peptide,SP),最后通过实验验证,他提出了“信号假说”,用以解答蛋白质合成后的去向问题。SP是一段存在于前体蛋白N-端的短肽链,能够调节前体蛋白的折叠和转移。研究[2-5]表明,在原核系统中,SP附着后,外源基因能够在原核表达系统中成功表达并分泌,如芽孢杆菌、乳酸杆菌、L型细菌、大肠杆菌等。除此之外,SP还广泛应用于真核表达系统,如昆虫杆状病毒表达系统和毕赤酵母表达系统[6-9]。由此可见,SP在蛋白质的分泌过程中扮演着极其重要的角色,通过分子生物学技术,优化SP序列对于提高外源蛋白的分泌量及活性具有重要的实际意义。
嵌合抗原受体T淋巴细胞(chimeric antigen receptor T lymphocyte,CAR-T)技术是通过分子生物学和基因工程改造技术,将靶向特异性抗原的单链抗体的轻重链可变区(single chain antibody variable fragment,scFv)序列在患者的T细胞膜表面表达,进而特异性地杀死肿瘤细胞,达到治疗癌症的目的。CAR的基础设计中包括一个肿瘤相关抗原结合区(通常来源于抗体抗原结合区域的scFv段)、一个细胞外铰链区、一个跨膜区和一个细胞内信号区[10-11]。细胞膜外部分是从单克隆抗体中纯化的抗原靶向部分,该抗体由scFv(重链和轻链可变区的融合蛋白)组成。scFv中的SP对自身的表达尤为重要,scFv的N端SP具有三重结构,并且与分泌蛋白的SP具有相同的特征[12-13]:疏水性α螺旋核心(h区),其N端侧翼为极性氨基酸残基(n区)。C端侧翼在裂解位点(c区)的-1和-3处含有螺旋断裂的脯氨酸和甘氨酸残基,以及小的不带电荷的残基。scFv一旦与肿瘤抗原结合,它就会触发T细胞活化并导致细胞因子释放和T细胞增殖[14]。SP能促进CAR在T细胞膜表面的表达,因此,对SP结构进行优化和选择是提高CAR表达水平的重要方法。
本研究以CD19为CAR-T治疗靶点,通过构建4种不同SP的CD19-CAR表达载体,研究4种不同来源的SP对CAR-T转染效率的影响,并验证其对CD19阳性肿瘤细胞的杀伤效果,为临床治疗急性淋巴细胞性白血病(acute lymphoblastic leukemia,ALL)提供新的CAR-T治疗方案。
1 材料和方法
1.1 细胞株与主要试剂
人胚肾细胞293T、K562细胞系和NALM-6细胞系均购自美国典型培养物保藏中心(American Type Culture Collection,ATCC),K562-CD19细胞系为武汉波睿达生物科技有限公司馈赠,大肠杆菌DH5α感受态购自南京诺唯赞生物科技股份有限公司。
慢病毒表达载体BRD-PTK-Kan购自武汉波睿达生物科技有限公司(自行构建并保存),慢病毒包装载体pMDLg/pRRE、pRSV-Rev和pMD2.G均购自美国Addgene公司,大量质粒抽提试剂盒购自美国Axygen公司,胎牛血清、DMEM-Basic、RPMI-1640培养基及0.25%的Trypsin-EDTA均购自美国Gibco公司,PE-Labeled Human CD19 Protein购自北京百普赛斯生物科技有限公司,7-AAD购自美国BD Bioscience公司,钙黄绿素购自上海阿拉丁生化科技股份有限公司,Human IFN-γ precoated ELISA kit(Cat:1110002)和Human TNF-α precoated ELISA kit(Cat:1117202)ELISA试剂盒购自深圳达科为生物科技股份有限公司。寡核苷酸引物由武汉擎科生物科技有限公司合成。
1.2 4种不同SP的CD19-CAR分子的设计
CD19-CAR分子的单链抗体片段来源于GenBank:HM852952.1,将细胞外域CD19-scFv(包含SP1序列)、跨膜区、细胞内域共刺激因子CD28、4-1BB及CD3ζ依次串联连接,获得完整的CD19-CAR片段,CD19抗原的scFv可在细胞膜上稳定表达。然后通过分子克隆技术将SP2、SP3、SP4替换CD19-CAR中原有的SP1,即可得到含不同SP的CD19-CAR分子。SP序列如表1所示。

表1 SP的核苷酸和氨基酸序列及来源Tab.1 Nucleotide and amino acid sequences and sources of SP
1.3 分子重组技术构建不同SP的PTK-CD19-CAR 载体
通过基因合成得到序列大小为792 bp的CD19-scFv序列,包括SP1、VL轻链、Linker连接肽和VH重链。此外,基因合成得到大小为804 bp的基因序列,包括hinge、共刺激因子CD28、41BB及CD3ζ等结构。
通过重叠PCR 技术,将上述两段序列连接,得到CD19-CAR 片段,然后使用引物CAR-F、CAR-R(表2),扩增获得不含SP1的CAR片段。用表2的引物序列分别扩增基因合成的SP2、SP3、SP4,使其带有相同的同源臂,然后与不含SP1的CAR片段连接即可获得含有不同SP的CD19-CAR片段。随后,通过BamHⅠ和EcoRⅠ酶切,利用亚克隆技术将其连接至慢病毒表达载体BRD-PTK-Kan。最终获得分别含4种SP的CD19-CAR目的载体,即SP1-CD19-CAR、SP2-CD19-CAR、SP3-CD19-CAR和SP4-CD19-CAR,用于慢病毒包装。

表2 引物序列Tab.2 Primer sequences
1.4 细胞培养
用含10%胎牛血清的RPMI-1640培养基培养K562细胞系、K562-CD19细胞系和NALM-6细胞系。HEK-293T细胞培养使用含10%胎牛血清的 DMEM培养基,原代T细胞培养使用含1 000 U/mL IL2、1∶1 000的HEPES 1M、1∶1 000谷氨酰胺的TexMACS™ GMP培养基;细胞通过添加或替换新鲜培养基维持生长,换液需要300×g离心5 min 去细胞上清,然后按2×106~3×106个/mL 的细胞密度添加培养基,轻轻吹打均匀后置于37 ℃、CO2体积分数为5%的细胞培养箱中培养。
1.5 慢病毒的包装、浓缩及滴度测定
利用第3代慢病毒包装系统,由慢病毒包装载体pMDLg/pRRE、pRSV-Rev、pMD2.G和慢病毒表达质粒组成。用PEI转染法将慢病毒系统4种质粒共转染HEK-293T细胞,转染比例为12∶10∶6∶5,然后37 ℃、CO2体积分数为5%的培养箱中培养72 h后收集上清液,采用超速离心法进行浓缩。滴度测定:采用6孔板,每孔铺5×105个HEK-293T细胞,每孔分别加入0.5、1.0、2.0、5.0、10.0 µL的病毒,并加入聚凝胺(polybrene),使其浓度为5 µg/mL 。并设置阴性对照,72 h后通过PE-Labeled Human CD19 Protein用流式细胞术检测HEK-293T细胞转染效率并计算慢病毒滴度。每种病毒量设置2 组平行孔,实验重复3 次。
1.6 慢病毒转导T细胞构建CD19-CAR-T
显微镜下观察待转染细胞生长情况,取需要数目的生长状况良好的待转细胞;于6孔板中按感染复数等于5计算需要加入慢病毒浓缩液的量,补加Polybrene使其终浓度为5 µg/mL;37 ℃斜置温育4 h,最后补加培养基至正常培养浓度。
1.7 流式细胞术检测慢病毒感染T细胞表面CD19-CAR的表达
收集>5×105个转染待测转效或表面表达的细胞于流式管中,并选取未染色或未处理细胞作为阴性对照。向每管中加入1~2 mL流式细胞术用Buffer(PBS+2%~5%FBS,FBS维持细胞活性),300×g,离心5 min,去掉上清液,重复洗2遍,用流式细胞术用Buffer配制好工作浓度的染色抗体,并除尽离心后的上清液,重悬细胞于配制好的抗体中,4 ℃避光染色30 min。加入1~2 mL流式细胞术用Buffer终止染色,300×g,5 min离心,去掉上清液,重复洗2遍,加 2 µL 7-AAD 抗体(稀释比例 1∶100)于 0.2 mL流式细胞术用Buffer中重悬细胞,2~3 h之内流式细胞仪分析检测。
1.8 钙黄绿素释放法检测各种SP CD19-CAR-T的细胞毒性
以T、SP1-CD19、SP2-CD19、SP3-CD19 和SP4-CD19细胞作为效应细胞,阳性靶细胞为表达CD19的NALM-6细胞系和K562-CD19细胞系,阴性靶细胞为不表达CD19的K562细胞系。将靶细胞用calcein-AM 标记后,将其接种于U底96孔培养板(100 µL/孔),接种密度为1 × 105个/mL。将体积为100 µL/孔,不同效靶比(25∶1、5∶1、1∶1)的效应细胞加入对应孔中,共培养体系用含5%胎牛血清的PBS。设置:阳性对照组(加入裂解液)和阴性对照组(加入 PBS),各组均设 4个复孔,37 ℃生化培养箱中温育3 h。将96 孔板在常温下700×g离心10 min,将每个孔中所有的上清转移至新的平底96孔板预标记的对应的孔中。分参数设置酶标仪:激发光波长485/20,发射光波长530/25,扫描读取荧光值。各组效应细胞的细胞毒性根据以下公式计算:特异性杀伤百分率(%)=(实验组荧光值-阴性对照组荧光值)/(最大释放组荧光值-阴性对照组荧光值)×100%,实验重复3 次。
1.9 ELISA法检测各种SP CD19-CAR-T内IFN-γ和TNF-α的分泌水平
取适量的靶细胞,加入5×103个K562细胞于96孔板中,作为阴性靶细胞组,阳性靶细胞组加入5×103个CD19+的NALM-6 细胞,而空白组中不加入靶细胞,体积为100 µL。按照效应细胞比靶细胞为10∶1,加入T 细胞和4种SP的CD19-CAR-T(5×104个/孔,体积100 µL)于对应的孔中,每个样品做3个复孔,使用含10%胎牛血清的RPMI-1640培养基作为共培养体系。37 ℃生化培养箱中温育24 h后,将96 孔板常温,700×g,10 min离心后收集100 µL上清液,按酶联免疫吸附实验试剂盒的说明书常温操作检测IFN-γ和TNF-α的分泌水平,在450 nm波长下检测吸光度(D)值,并根据标准曲线计算各样本细胞因子的含量(pg/mL)。
1.10 数据分析
本研究采用GraphPad Prism 8软件进行数据分析,实验数据以表示,两组间比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 成功构建分别含4种SP的CD19-CAR 重组质粒
利用基因合成和分子克隆技术成功获得了含不同SP的CD19-CAR片段(图1A),将4种CD19-CAR分子亚克隆至慢病毒载体BRD-PTKKan上。通过BamHⅠ和EcoRⅠ双酶切进行鉴定,CD19-CAR分子的重链VH结构含有BamHⅠ酶切位点,则CD19-CAR分子被切成一段带SP的序列和一段大小为1 052 bp大小的序列。结果显示,含4种SP的重组质粒酶切后可见4条带SP的序列大小分别为 544、547、550和541 bp,两段序列加起来的大小与携带不同SP的CD19-CAR片段一致(图1B)。此外,载体测序结果证实,4种CD19-CAR片段基因序列和插入的阅读框与设计完全相符,证明4种慢病毒表达质粒SP1-CD19-CAR、SP2-CD19-CAR、SP3-CD19-CAR和SP4-CD19-CAR构建成功。
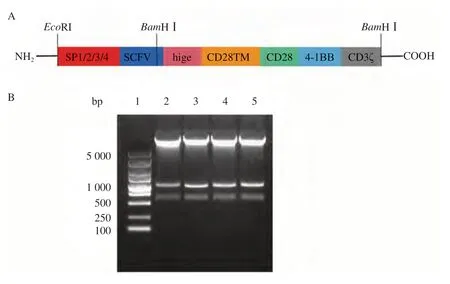
图1 含4种不同SP慢病毒表达载体的构建Fig.1 Construction of recombinant lentiviral plasmid containing four different SP
2.2 成功制备4种慢病毒载体
流式细胞术检测结果显示,用浓缩的4种病毒液分别以 0.1、0.2、0.4、0.8和1.6 µL的体积转染HEK-293T细胞,以病毒添加量为0.4 µL 时计算对应的4 种慢病毒(S P 1、SP2、SP3和SP4)的滴度。结果显示,SP4[(2.80±0.10)×108TU/mL]慢病毒的滴度显著高于SP1[(1.40±0.09)×108TU/mL]、SP2[(1.70±0.11)×108TU/mL]、SP3[(2.10±0.19)×108TU/mL](P<0.01,图2A),证明4种慢病毒包装成功,可用于后续实验。此外,如图2B所示,病毒添加量为0.4 µL时对应的4种慢病毒(SP1、SP2、SP3和SP4)的转染效率分别为11.3%、13.1%、16.6%和23.5%。
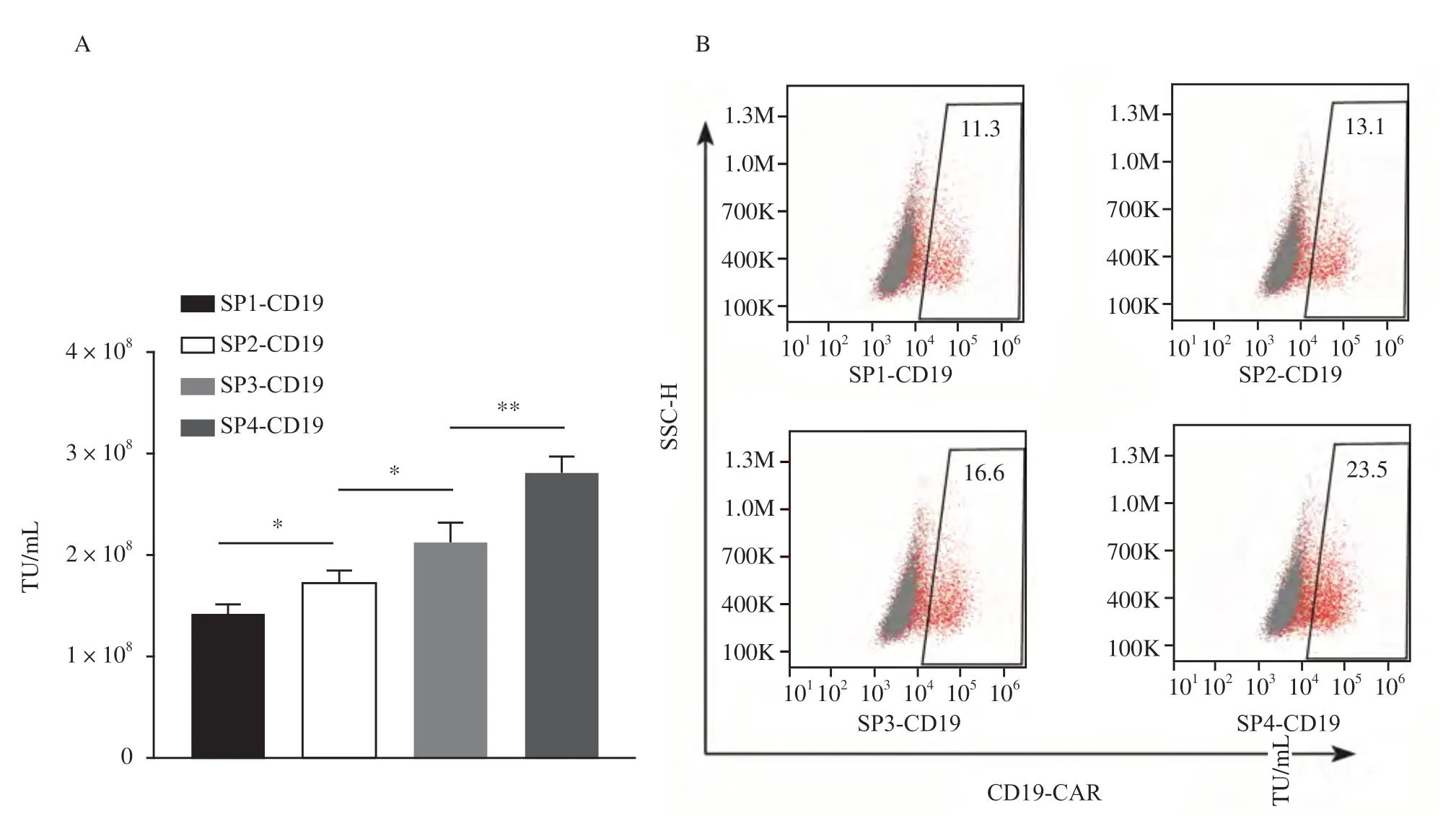
图2 4种慢病毒的成功制备Fig.2 Successful preparation of four lentiviruses
2.3 4种不同SP的CD19-CAR在T细胞中的表达差异分析
通过流式细胞术检测不同SP对CAR-T转染效率的影响,结果如图3所示,转染效率随着时间的延长呈现先上升后下降的趋势,且SP4-CD19组显著高于SP1-CD19、SP2-CD19和SP3-CD19组(P<0.05)(图3A)。并且在转染效率最高的第6天检测4组慢病毒感染组的表达情况,结果显示,含4种SP的慢病毒(SP1、SP2、SP3和SP4)感染的T细胞成功表达CD19-CAR的比例分别为20.9%、22.6%、31.5%和38.6%(图3B)。此外,本研究还检测了相同时间点CD19阳性细胞的数量,结果显示,SP4-CD19组的阳性细胞数均高于其他3组(图3C),细胞增殖实验结果显示,含不同SP的CAR结构对CAR-T细胞的增殖活性差异无统计学意义(P>0.05,图 3D)。
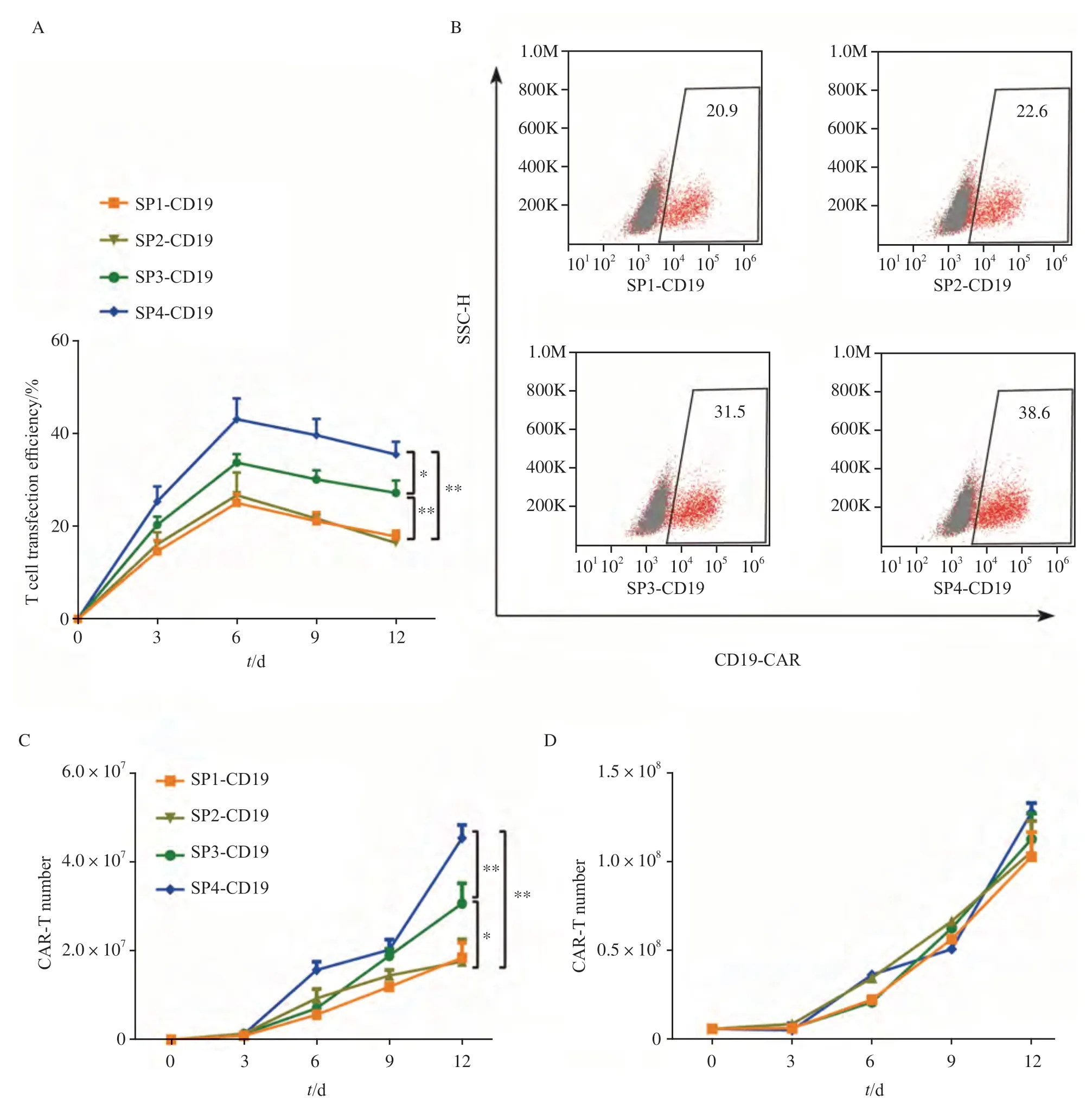
图3 4种CD19-CAR分子在T细胞中的转染效率及增殖情况Fig.3 Transfection and expression rate of four CD19-CAR in the T cells and its proliferation activity
2.4 4种不同SP的CD19-CAR-T对靶细胞的杀伤效率
本研究通过流式细胞术进一步检测4种SP的CAR-T的体外杀伤效力,实验选择不表达CD19的K562细胞作为阴性靶细胞,K562-CD19细胞(CD19稳定表达细胞系)和NALM-6细胞(CD19表达阳性率为99.6%和99.5%),作为阳性靶细胞(图4A)。
细胞毒性实验结果(图4B)显示,用第6天的CAR-T杀伤靶细胞,在效靶比相同的条件下SP4-CD19细胞对K562-CD19肿瘤细胞的杀伤作用显著高于SP1-CD19、SP2-CD19、SP3-CD19细胞和T细胞[效靶比为25∶1时,分别为(36.77±2.42)%、(15.15±1.35)%、(18.80±0.30)%、(31.58±1.47)%、(9.04±3.25)%,P<0.01]。同样SP4-CD19细胞对NALM-6肿瘤细胞的杀伤作用明显高于SP1-CD19、SP2-CD19、SP3-CD19和T细胞[效靶比为25∶1时,分别为(23.43±1.13)%vs(11.16±0.48)%、(10.54±2.27)%、(1 7.9 0±1.5 3)%和(8.2 7±2.7 5)%,P<0.01]。而两者对CD19-肿瘤细胞K562的杀伤作用差异无统计学意义[效靶比为25∶1 时,分别为(3.75±0.95)%vs(3.06±0.80)%、(2.4 2±0.7 9)%、(4.0 0±1.0 6)%和(1.92±0.76)%,P>0.05]。
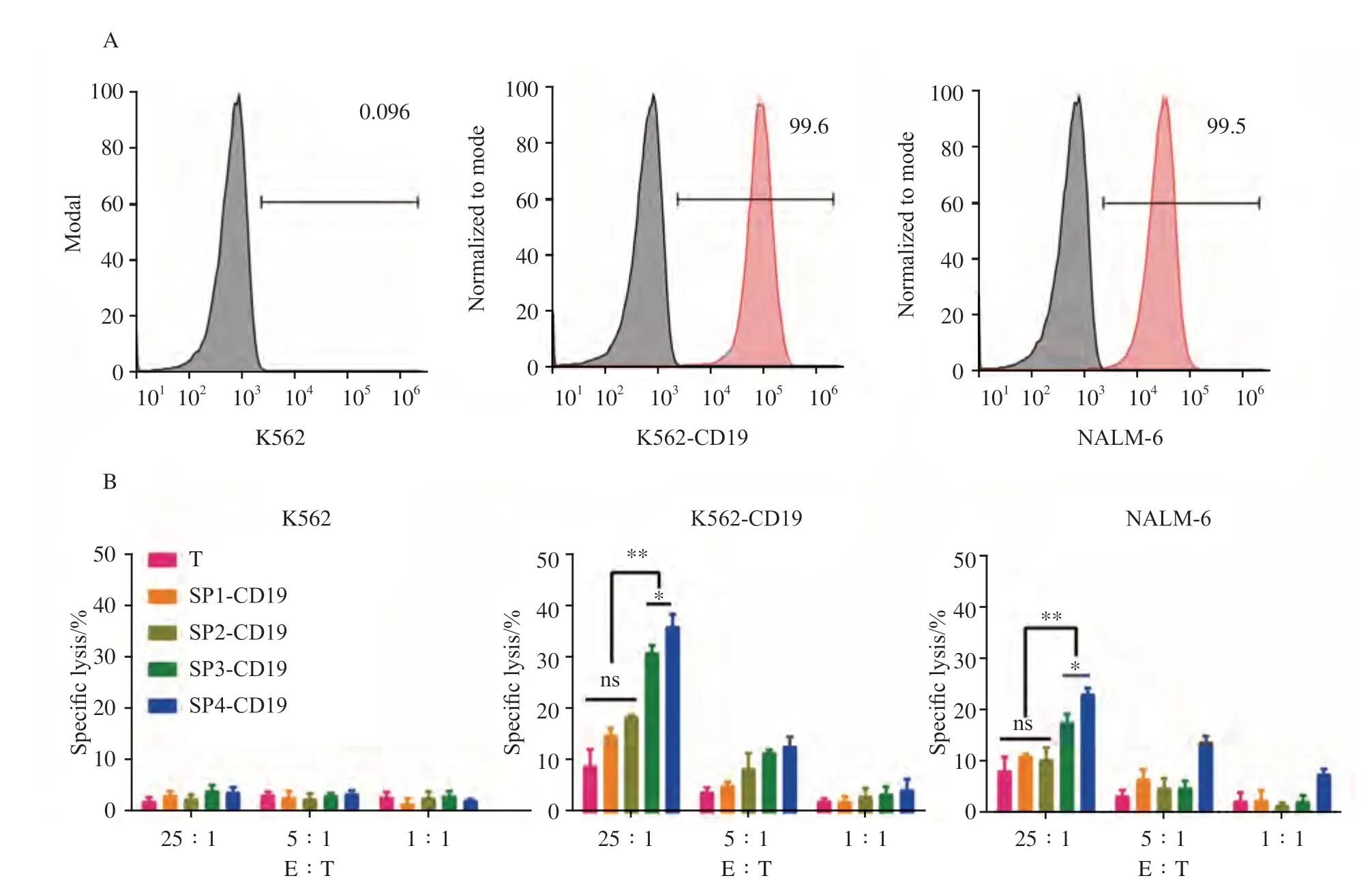
图4 4种CD19-CAR-T对CD19+靶细胞的杀伤效应Fig.4 Killing effect of four CD19-CAR-T on CD19+ target cells
2.5 4种不同SP的CD19-CAR-T中IFN-γ和TNF-α的分泌
前期研究发现,细胞因子IFN-γ和TNF-α可发挥协同作用杀死肿瘤细胞,因此本研究采用ELISA技术检测细胞因子IFN-γ和TNF-α的释放情况[15-16]。结果显示,效靶比为10∶1 时,共培养24 h后,阳性靶细胞组与空 白 细 胞 组 相 比,T 细 胞I F N-γ 和T N F-α 的分泌水平没有显著变化[IFN-γ:(894.90±8.83)pg/mLvs(649.60±64.70)pg/mL,P>0.05;TNF-α:(419.80±8.81)pg/mLvs(401.60±25.80)pg/mL,P>0.05],而4种不同SP的CD19-CAR-T中IFN-γ和TNF-α的分泌水平在阳性靶细胞组中显著升高(图5)。在阳性靶细胞组中,SP4-CD19细胞IFN-γ和TNF-α的分泌水平比SP1-CD19、SP2-CD19、SP3-CD19细胞和T细胞显著升高[IFN-γ:(5 819.00±281.90)pg/mLvs(2 626.00±154.50)pg/mL、(3 089.00±173.50)pg/mL、(3 844±39.08)pg/mL、(894.90±8.83)pg/mL,P<0.01;TNF-α:(5 004.00±169.50)pg/mLvs(3 014.00±85.20)pg/mL、(3 351.00±66.43)pg/mL、(3 922.00±63.38)pg/mL和(419.80±8.81)pg/mL,P<0.01]。

图5 4种CD19-CAR-T IFN-γ和TNF-α分泌水平Fig.5 The secretion levels of IFN-γ and TNF-α among four CD19-CAR T
3 讨论
ALL是淋巴细胞在分化早期恶性增殖造成的,可侵犯骨髓、血液和髓外部位,发病率高,预后和生存率不理想[17-18]。CAR-T免疫治疗能靶向性地杀伤具有特异性抗原的ALL细胞,而对正常细胞无杀伤作用,这将大大降低脱靶效应,为ALL的临床治疗提供新的策略。有研究[19-20]表明,增加CAR在T细胞表面的表达可以增加CAR-T的抗肿瘤能力,这为治疗ALL提供了一个全新的方案。本实验成功构建了表达不同SP的CD19-CAR分子的T细胞,并在体外验证出其具有靶向特异性,CD19抗原CAR对CD19+ALL细胞有较为明显的杀伤作用,并且SP4-CD19细胞的转染效率和对CD19+ALL细胞的杀伤作用明显高于SP1-CD19、SP2-CD19和SP3-CD19细胞。该研究结果为CAR-T在临床转化中的优化方案提供了重要的实验依据。
近年来,靶向CD19的CAR-T在白血病的治疗中取得了重大突破[21-22],关于CAR结构的胞内域改造方面的研究也越来越深入,而对scFv的N端SP研究较少。CAR的主要结构包括抗原结合区(包含SP)、铰链区、跨膜区和细胞内信号区[23]。这些元件都有各自独特的功能,可以通过使用来源于各种蛋白的结构域组合,来优化CAR的结构。因此,为了增强CAR结构在T细胞表面的表达及杀伤作用,本研究主要采用由单链抗体scFv、CD28跨膜区、CD28细胞内结构域、细胞内共刺激域4-1BB和CD3ζ链组成的第三代CAR的结构,并在此基础上优化了抗原结合区SP结构,从而增强对靶细胞的杀伤。从细胞毒性实验结果可以看出,携带不同SP的SP-CD19 CAR-T对CD19+ALL细胞表现出特异性的杀伤效果,由此可以证明,不同的SP能够影响CAR在T细胞表面的表达以及对靶细胞的杀伤。
从研究结果可以看出,SP4-CD19细胞较其他SP的SP-CD19细胞对CD19+ALL细胞杀瘤效应显著增强。ELISA法检测IFN-γ和TNF-α分泌水平结果显示,在CD19+肿瘤细胞刺激下SP4-CD19细胞较其他SP的SP-CD19细胞IFN-γ和TNF-α分泌水平显著提高。研究表明,改造SP是一种有效增加重组蛋白表达量的方式[24],并且SP具有极强的异质性,许多SP即使在不同物种之间也具有功能上的互换性[25]。这可能与CAR结构中的SP与SRP(信号识别颗粒)的识别有关,据推测,不同的SP对SRP表现出不同的亲和力,SRP随后决定了新生多肽链进入分泌途径的效率[26-27]。本研究发现,SP4-CD19细胞的转染效率和对靶细胞的杀伤力较其他3个SP均显著升高,这可能与SP4结合SRP的效率有关,其中的分子机制及作用效应还有待进一步实验验证。
综上所述,随着国内外科学家们对免疫疗法的深入研究,越来越多的研究者关注CAR-T对肿瘤细胞的杀伤作用[28]。本研究制备了含不同SP的CAR-T,并通过系统的体外实验初步验证了SP对提升CAR在T细胞表面表达的影响。从本实验中CAR-T对靶细胞的体外功能鉴定结果来看,SP4-CD19细胞较其他SP的CAR-T对靶细胞的杀伤和细胞因子分泌水平显著提高。这将为ALL的临床精准治疗提供参考,但是还需要通过动物实验评估其安全性。
利益冲突声明:所有作者均不存在利益冲突。

