以PLA、PHBV为碳源的生物絮团技术在海水养殖中的应用
李晓蕊,宋协法,周广军,董登攀
(1 中国海洋大学水产学院,山东 青岛 266003;2 烟台市海洋经济研究院,山东 烟台 264004)
生物絮团(Biofloc Technology,BFT)是以异养细菌为主,同时与原生动物、藻类等水体成分混合形成的具有调节水质功能的絮状悬浮物[1]。在生物絮团养殖系统中,需要通过外加碳源以维持异养细菌的生长,碳源的种类和数量很大程度上决定了絮体的形成[2]。传统碳源如葡萄糖[3]、米糠[4]、木薯粉[5]、蜜糖[6]、玉米淀粉[7]、淀粉[8]、甘蔗渣[9]等降解速度快,需要频繁添加,容易出现碳源不足或过量情况,对养殖水体造成新的污染,对系统处理造成过高的负荷。生物可降解聚合物如3-羟基丁酸-co-3-羟基戊酸共聚物(poly3-hydroxybutyrate-co-3-hydroxyvalerate,PHBV)、聚-β-羟丁酸(poly-hydroxybutyrate,PHB)、聚己内酯(polycaprolactone,PCL)可缓慢释放有机碳源,被证明能够为生物絮团建立提供稳定的有机碳源[10-11]。研究表明,生物絮团系统中添加PHB,可促进罗非鱼(Oreochromismossanbicus)[12]、南美白对虾(Litopenaeusvannamei)[13]等的生长和抗病性的提高,但在碳源添加规律和海水养殖中的应用却鲜有研究。若将生物可降解聚合物作为碳源用于海水养殖中,盐度对其有机碳的释放势必是最为关键的一环。本研究选取聚乳酸(PLA)和3-羟基丁酸-co-3-羟基戊酸共聚物(PHBV) 作为外加碳源,探究在模拟海水生物絮团养殖中,不同盐度下,碳源有机碳释放规律,以及PLA与PHBV对于海水生物絮团养殖中水质、微生物群落多样性及其结构的影响,为生物可降解聚合物作为外加碳源的生物絮团技术在海水养殖中的应用提供参考。
1 材料与方法
1.1 试验装置
本研究采用6个PE材料反应器(下口入水,上口出水)并联运行的方式,每个反应器有效容积约2 L,内部悬挂添加PLA或PHBV 20 g,设置水体盐度为10、20、30,共设6个试验组,反应器盐度设置如表1。反应器内采用纳米管持续曝气,保证水体中溶氧为5.30~6.00 mg/L ,利用加热棒将温度控制在21.87±0.29℃,试验用水为人工配制的海水养殖废水。
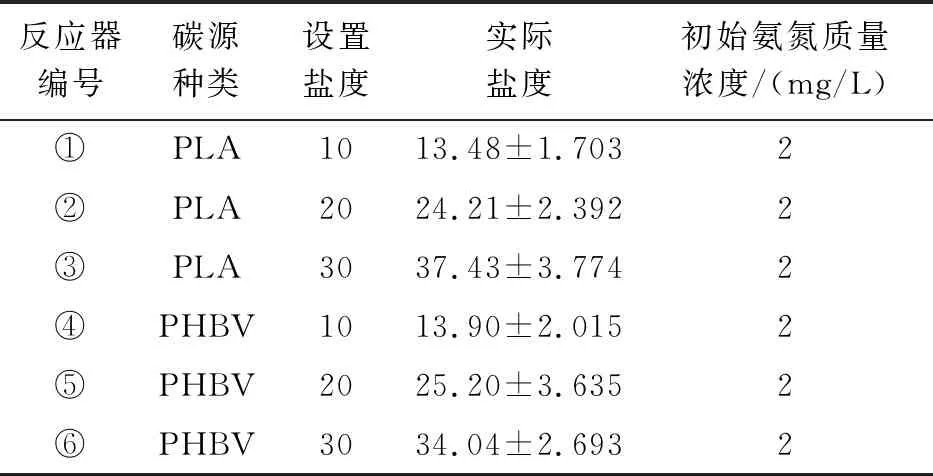
表1 生物反应器条件设置
1.2 人工配制的海水养殖废水
残饲粪便取自威海圣航水产科技有限公司的大菱鲆养殖系统,经自然风干后于烘箱内65℃烘干12 h,烘干后的残饲粪便使用研磨机粉碎。配水时取500 g溶于少量水后发酵3 d,经300目筛绢过滤,将浸出液倒入体积约65 L的水桶中混匀,弃去残渣,测定水质指标后按照比例用来自青岛近海经砂滤的纯净海水稀释作为试验用水[14]。
1.3 试验过程
1.3.1 反应器搭建
反应器采用纳米管曝气,利用蠕动泵(设置水力停留时间为5 d)补充自然蒸发水和养殖物耗水,设置海水养殖废水中的氨氮质量浓度为2 mg/L,为加快反应器中生物絮团的产生,分别在反应器中加入2 g复合芽孢杆菌,稳定4 d。
1.3.2 探究PLA与PHBV的碳源添加规律
设备稳定4 d后,从第5天开始,进行样品采集和检查。根据水体中各项指标的变化,通过加入碳酸钠控制水体中的pH在8.0以上,通过后期添加相应的PLA或PHBV以调节C/N(用COD表示水体中的碳含量,用氨氮、亚硝酸盐氮、硝酸盐氮的总和表示水体中的氮含量)。在试验进行到45 d时对水体中的沉积生物絮团清理,试验持续90 d。
1.3.3 样品采集与检测
1.3.3.1 水质检测
每3 d在早上9:00到9:30采用取样管分别在反应器周边和中心选取5个点进行取样,每次取样50 mL,使用离心机离心(4 000 r/min)5 min后进行水质指标检测。使用YSI检测水环境中的温度、盐度、pH、溶氧(DO)。总氨氮、亚硝酸盐、硝酸盐、磷酸盐以及化学需氧量(COD)指标测定参照GB 173784—2007《海洋监测规范海水分析》[15],总氨氮检测方法为纳氏试剂法,亚硝酸盐检测方法为盐酸萘乙二胺法,硝酸盐检测方法为锌镉还原法,磷酸盐检测方法为磷钼蓝分光光度法,COD检测方法为高锰酸钾氧化法。
1.3.3.2 生物絮团指标测定
取100~200 mL水样使用沉淀漏斗(量程1 000 mL,精度0.01,Nalgene)经过30 min沉淀,统计生物絮团沉积量[2],总固体颗粒悬浮物采用CJ/T 52—1999《城市污水悬浮固体的测定》[16],取水样50~100 mL,使用0.45 μm混合滤膜抽滤后,于105℃烘箱烘干后称重。
1.3.3.3 微生物群落分析
试验前期(11月15日)、中期(12月20日)、后期(1月27日)系统稳定时在6个反应器周边和中心取生物絮团质量浓度较高的底层水样,置于沉淀漏斗中,取沉淀物进行抽滤后,留取抽滤后滤膜,共取样18个。
利用1%琼脂糖凝胶电泳检测抽提的基因组DNA,进行PCR扩增,按指定测序区域,合成带有barcode的特异引物。为保证后续数据分析的准确性及可靠性,尽可能使用低循环数扩增;保证每个样本扩增的循环数一致。随机选取具有代表性的样本进行预试验,确保在最低循环数中使绝大多数样本能够扩增出质量浓度合适的产物。构建Miseq文库,进行Miseq测序。
1.4 数据记录与处理
试验数据使用Excel与SPSS 20.0记录和处理,并作图。微生物群落分析使用Flash 1.2.11进行pair-end双端序列拼接处理,使用Qiime 1.9.1生成各分类学水丰度表,进行beta多样性距离计算,使用Uparse 7.0.1090和Usearch 7.0进行OTU聚类与OTU统计分析,使用RDP Classifier 2.11进行序列分类注释,使用Mothur 1.30.2进行alpha多样性分析,微生物数据库选择SILVA132 rRNA数据库,利用Fastp 0.19.6进行质控。
2 结果
2.1 不同盐度下以PLA与PHBV为碳源的系统中水质指标的变化
不同盐度下以PLA与PHBV为碳源的系统中,水质指标氨氮、硝酸盐、亚硝酸盐和磷酸盐质量浓度及相关性见表2,变化情况见图1。
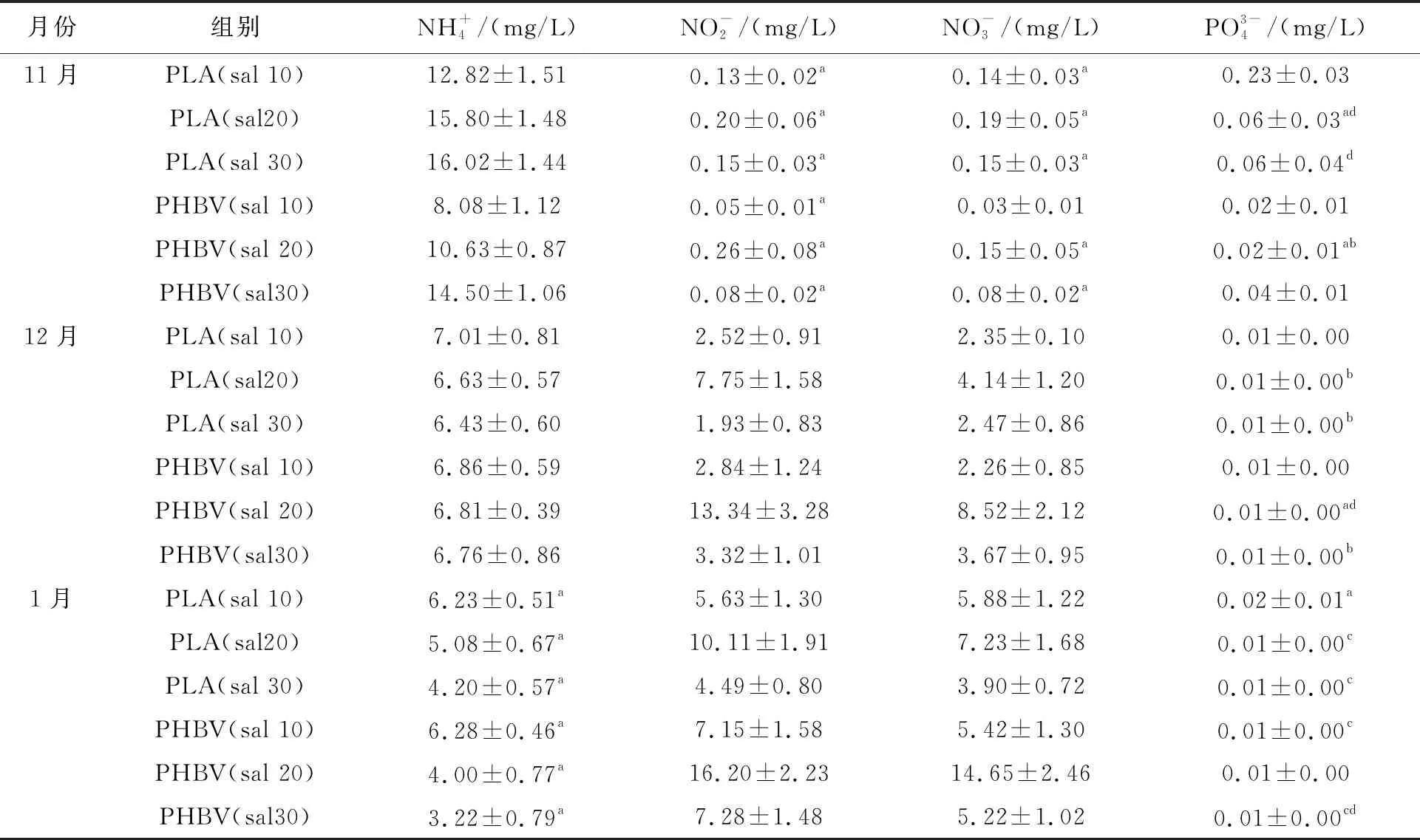
表2 不同盐度下以PLA与PHBV为碳源的系统中水质指标

图1 不同盐度下以PLA与PHBV分别为碳源的系统中水质参数的变化
在试验前期,无论是以PLA还是以PHBV为外加碳源的系统中,盐度越低,氨氮质量浓度越低,说明试验前期,低盐度系统更有利于生物絮团系统处理水体中的氨氮,低盐度系统中,PLA、PHBV试验组前期环境平均氨氮质量浓度最低,分别为12.82 mg/L、8.08 mg/L;在试验中期,氨氮质量浓度趋于稳定,盐度不再成为生物絮团处理氨氮的影响因素;在试验后期,氨氮质量浓度与系统盐度的关系呈现出与前期相反的变化趋势,高盐度系统中,PLA、PHBV试验组前期环境平均氨氮质量浓度最低,分别为4.20 mg/L、3.22 mg/L;在试验全过程,以PHBV为外加碳源的系统相较于以PLA为外加碳源的系统在同一盐度组中,都呈现出较好的氨氮处理效果。硝酸盐质量浓度与亚硝酸盐在试验全过程都呈现出上升趋势,硝酸盐质量浓度呈直线上升,亚硝酸盐质量浓度在后期变化较平缓,其中,中盐度系统中增长速度最快。在试验全过程,磷酸盐能够有效被处理,最终保持在0.01 mg/L以下。
2.2 不同盐度以PLA与PHBV为碳源的系统中碳源的释放规律
不同盐度以PLA与PHBV为碳源的系统中,碳氮比变化见图2。
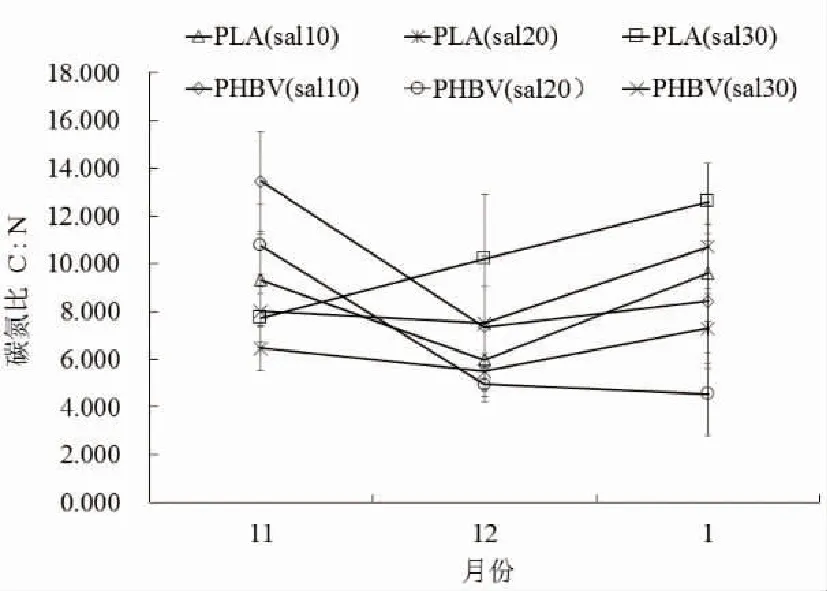
图2 不同盐度下以PLA与PHBV分别为碳源的系统中碳氮比的变化
在试验全过程,无论是以PLA还是以PHBV为外加碳源的系统,碳氮比都高于4,能够为系统提供足够的有机碳源。在试验初期,以PHBV为外加碳源的系统碳氮比要高于同盐度组以PLA为外加碳源的,与氨氮处理效率相对应;在试验中期,除以PLA为外加碳源高盐度系统碳氮比一直在上升外,其他系统都出现了一定程度的下降;在试验后期,除以PHBV为外加碳源中盐度系统碳氮比一直在下降外,其他系统都出现了上升,最终以PLA为外加碳源的系统碳氮比都高于同盐度组以PHBV为外加碳源的系统。在试验全过程,无论是以PLA还是以PHBV为外加碳源的系统,低盐度组与高盐度组的碳氮比较高,中盐度组的碳氮比较低。
2.3 不同盐度下以PLA与PHBV分别为碳源的系统中生物絮团形成
PLA与PHBV作为外加碳源都会促进生物絮团的形成。每一个系统中总固体颗粒悬浮物量都呈现出先增后减的趋势。
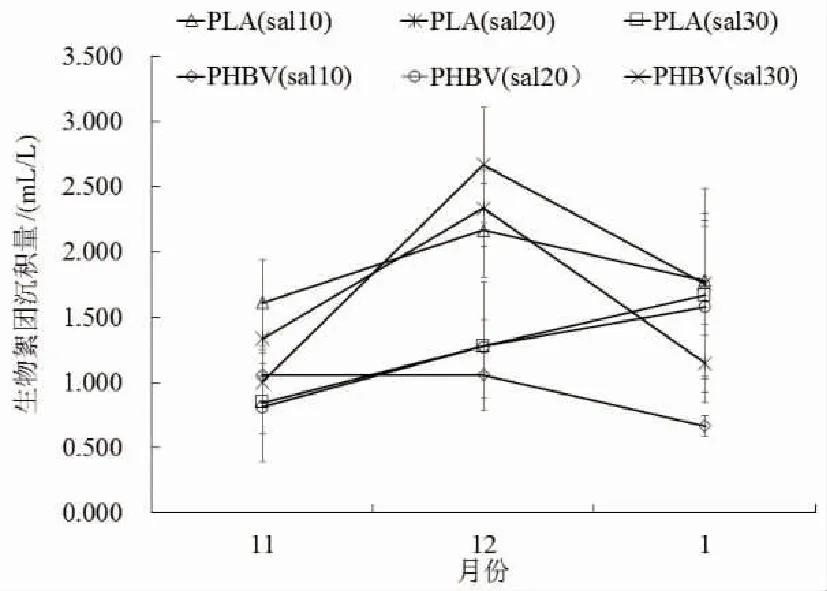
图3 不同盐度下以PLA与PHBV分别为碳源的系统中生物絮团沉积量的变化
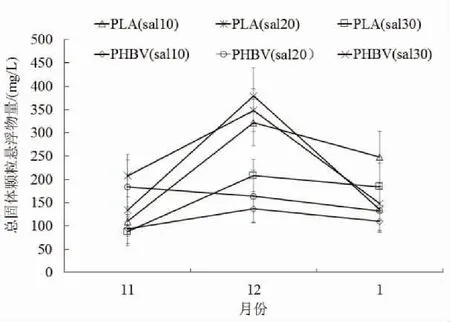
图4 不同盐度下以PLA与PHBV分别为碳源的系统中总固体颗粒悬浮物量的变化
以PLA为外加碳源低盐度、以PLA为外加碳源中盐度、以PHBV为外加碳源低盐度、以PHBV为外加碳源高盐度系统中,生物絮团沉积量的变化呈现出与总固体颗粒悬浮物相同的先增后减的变化趋势,以PLA为外加碳源的高盐度系统和以PHBV为外加碳源的中盐度系统生物絮团沉积量呈现出一直上升的变化趋势。
2.4 不同盐度下以PLA与PHBV分别为碳源的系统中微生物群落多样性及结构分析
2.4.1 微生物群落的多样性指数分析
对样品的进行微生物群落多样性指数分析(表3),所有样品的覆盖率(coverage)在99.5%以上,说明能够覆盖99.5%以上的细菌。样品多样性指数(Shannon指数和Simpson指数)可以得到以PLA为外加碳源的试验组与以PHBV为外加碳源的试验组多样性相差不大,整体多样性较低,Chao1指数表明,两组试验菌群丰度相差不大,整体较低。
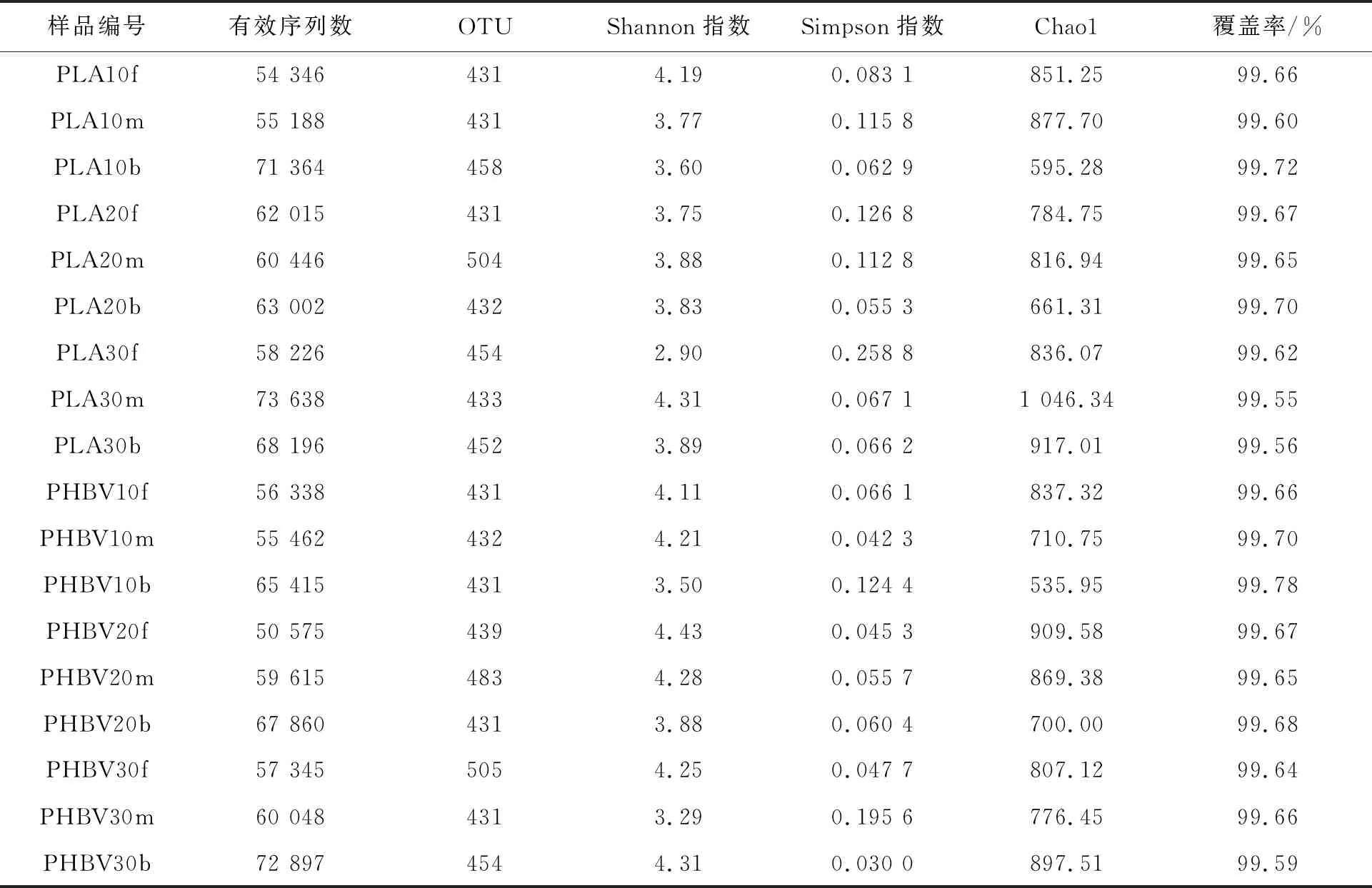
表3 微生物群落中生物覆盖和多样性指数对比
2.4.2 微生物群落结构分析
通过对样品进行门水平的细菌门类及其相对丰度的分析,共获得9个重要菌门(图5),分别为变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidota)、放线菌门(Actinobacteriota)、绿弯菌门(Chloroflexi)、疣微菌门(Verrucomicrobiota)、蓝藻门(Cyanobacteria)、类浮霉状菌门(Planctomycetota)、髌骨细菌门(Patescibacteria),占群落微生物数量的99%以上,其中变形菌门(Proteobacteria)为优势菌,占群落微生物的40%,以PLA为外加碳源的系统中的优势菌丰度占比略大于以PHBV为外加碳源的系统,两种外加碳源系统中变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidota)和放线菌门(Actinobacteriota)4种菌丰度占有绝对优势,为80%~90%。
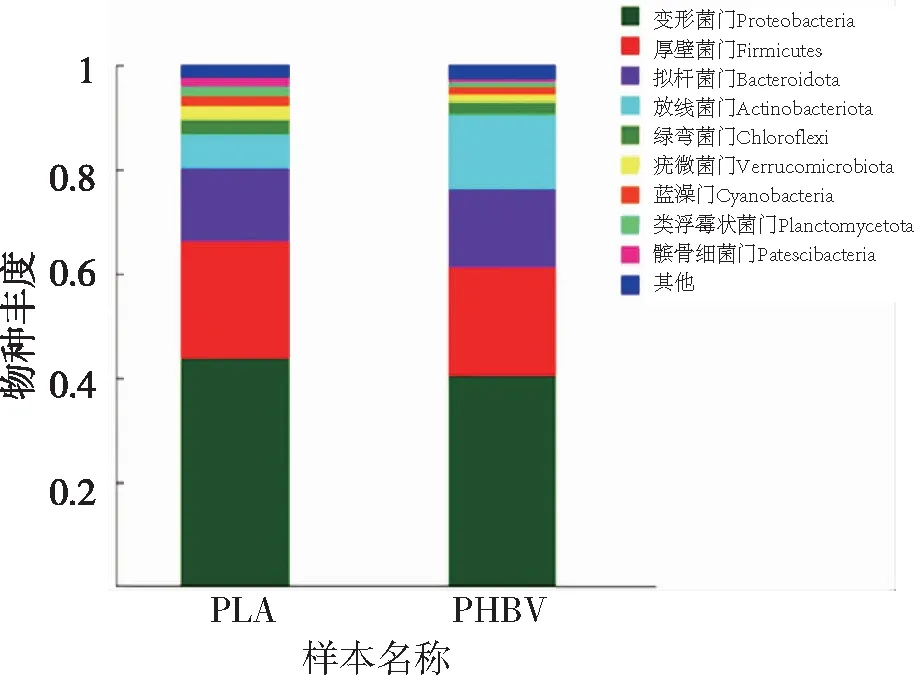
图5 以PLA与PHBV分别为碳源的系统中优势菌门及其相对丰度
图6所示,在属水平上,有50%左右的细菌属于无法分类和丰度极低的细菌。在以PLA为外加碳源系统和以PHBV为外加碳源系统中,优势菌群均为芽孢杆菌属(Bacillus),丰度占比在20%左右,以PLA为外加碳源系统要略高于以PHBV为外加碳源系统。此外,在以PLA为外加碳源系统中,未分类微杆菌科(umclassified-Microbacteriaceae)、鼠尾菌属(Muricauda)、象牙白栖东海菌属(Donghicola)、Roseibaca、海杆菌属(Marinobactersp.)、Methyloligellaceae丰度较高,在以PHBV为外加碳源系统中未分类微杆菌科(umclassified-Microbacteriaceae)、鼠尾菌属(Muricauda)、Roseibaca丰度较高。

图6 以PLA与PHBV分别为碳源的系统中优势菌属及其相对丰度
图7所示,在以PLA为外加碳源的系统中,除在低中高盐度的系统中都有约30%~40%的无法分类和丰度极低的物种外,在低盐度系统和中盐度系统中,芽孢杆菌属(Bacillus)都为优势菌属,丰度为20%~30%,中盐度系统中芽孢杆菌属(Bacillus)丰度略高于低盐度系统,在高盐度系统中芽孢杆菌属(Bacillus)与象牙白栖东海菌属(Donghicola)丰度相差不多,在15%左右,芽孢杆菌属(Bacillus)丰度明显低于低中盐度系统。
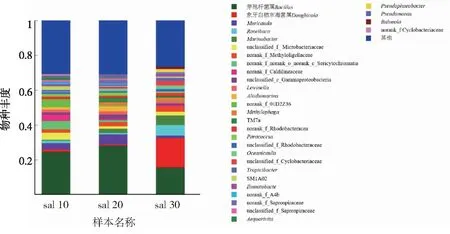
图7 以PLA为碳源的系统中优势菌属及其相对丰度
图8所示,在以PHBV为外加碳源的系统中,在低中高盐度的系统中都有约30%~40%的无法分类和丰度极低的物种外,在低中高盐度系统中,芽孢杆菌属(Bacillus)都为优势菌属,丰度为15%~25%,其中芽孢杆菌属(Bacillus)丰度较高的为低盐度和高盐度系统,在中盐度系统中,未分类微杆菌科(unclassified-Microbacteriaceae)为相对丰度第二高的菌科,约为5%。
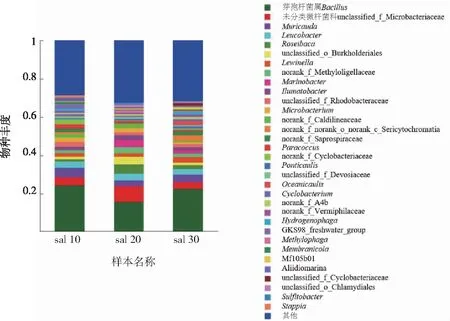
图8 以PHBV为碳源的系统中优势菌属及其相对丰度
3 讨论
3.1 不同盐度下以PLA与PHBV分别为碳源的系统中水质指标的变化
通过试验结果可以得知,低盐度的环境有利于生物絮团系统的建立,这表现在无论是以PHBV还是以PLA为碳源的系统中,低盐度的系统在试验初期的氨氮处理和保持效果优于中高盐度,这一结果表明盐度在海水生物絮团养殖中是不可或缺的重要条件且会对生物絮团系统的建立速度产生影响,中后期3种盐度系统中氨氮的处理和保持效果逐渐趋于一致,说明盐度只会对生物絮团系统的建立速度产生影响而不会对后期处理效果产生影响。亚硝酸盐和硝酸盐在两种碳源的中盐度系统中的异常快速增长同样说明中盐度系统对于亚硝酸盐和硝酸盐的转化过程相较于低高盐度系统处理速度更加缓慢。氨氮、亚硝酸盐和硝酸盐的变化证明PHBV碳源的释放和处理效率要高于PLA碳源。生物絮团系统中磷酸盐的变化也说明在生物絮团系统中除氨氮外,磷酸盐也能够被有效利用。
在生物絮团系统中,会出现3种氨氮转化反应,第1种是异养细菌以氨氮为氮源、以有机碳为碳源合成自身菌体蛋白[17];第2种是自养硝化细菌以氨氮为氮源、以碳酸氢根为碳源合成自身菌体蛋白[17-18];第3种是反硝化细菌以硝酸盐为氮源、以有机碳为碳源合成自身菌体蛋白[17]。根据水质指标的变化得知:水体中的氨氮产生了第1种[17]的反应,且在大多数生物絮团养殖系统中都会出现硝酸盐的积累现象。黎爽等[20]在探究光照强调对凡纳滨对虾生物絮团养殖的影响中,也在试验后期出现了硝酸盐的积累,最高质量浓度达到了16 mg/L;Samocha等[21]曾在不换水集约化跑道式养殖系统中硝酸盐质量浓度最高达到了400 mg/L;Wu等[22]在生物絮团凡纳滨对虾养殖系统中发现,养殖11周后,水体中硝酸盐质量浓度从0 mg/L积累到16 mg/L。在本试验中,除PHBV碳源组中盐度系统中在后期达到16 mg/L以外,其他试验组为6~8 mg/L,要低于养殖系统中的硝酸盐质量浓度,可能与反应系统中没有养殖种参与整个生物絮团系统构建,氮源的提供主要依靠模拟养殖废水有关。
3.2 不同盐度下以PLA与PHBV为碳源的系统中外加碳源的释放规律
碳氮比的变化不仅反应碳源的释放情况,同时还反应水体中氮含量的变化。整个试验过程,氨氮变化不明显、亚硝酸盐和硝酸盐质量浓度一直在上升,除PLA碳源高盐度组外,其他组在试验中期出现的碳氮比减小说明氮含量在上升,但有机碳释放量减少并不明显,而在后期,PLA和PHBV两种碳源都能很好地适应氮含量的增加,相应增加有机碳的释放,这也从另一个方向反映出,PLA和PHBV作为生物絮团系统中的外加碳源在提供有机碳方面强大的适应性,相比于传统碳源的人工调节,PLA和PHBV根据养殖水体需求做出的自动化调整具有重要的意义。在碳氮比变化上,PHBV碳源在同时期相较于PLA碳源更加有利于水体中碳氮比的保持和调节,具有一定的优越性。
在水产养殖业中,碳氮比在工厂化养殖的各种模式中都具有重要意义,合理的碳氮比能够促进微生物群落、藻类的生长生活,引导微生物群落的发展朝着需要适合养殖需要的方向发展,对于整个水产养殖业具有重要意义。在生物絮团养殖系统中,碳氮比的检测与控制尤为重要。金毅等[23]在生物絮团日本沼虾养殖中,发现生物絮团的产生和水质处理在碳氮比为20时最佳,碳氮比为25或15时欠佳,碳氮比为10时基本不会产生生物絮团,日本沼虾的特定生长率也是在碳氮比为20时最佳;魏继红[24]在控制养殖水体絮体质量浓度的情况下发现,在总固体颗粒悬浮物量为500 mg/L时,碳氮比20时对氨氮、亚硝酸盐的去除率最大,但各组显著性较低;王广军等[25]在零换水杂交鳢稚鱼养殖中发现当碳氮比大于等于10时可以形成较多的生物絮团并达到调控水质的目的,但当碳氮比超过15时会对杂交鳢稚鱼产生不利影响;孙盛明等[26]通过对零换水团头鲂养殖的研究发现碳氮比影响水体生物絮团的形成并会改变团头鲂肠道菌群结构;卢炳国等[27]在草鱼池生物絮团形成的研究中发现当碳氮比大于等于15时,形成的生物絮团可以有效地调节水质。通过以上可以了解到碳氮比在不同养殖种的养殖水体中适合的碳氮比不同,在本试验中,由于系统中没有养殖动物的参与,碳氮比相对较高。
3.3 不同盐度下以PLA与PHBV为碳源的系统中微生物群落多样性及结构分析
在生物絮团技术中,一般使用芽孢杆菌或EM菌微生态制剂来诱导生物絮团的生成,加快生物絮团的产生生物絮团系统中微生物群落的演变以及结构的研究有利于引导生物絮团技术走向更加精确的养殖方向。王博等[28]在墨吉明对虾生物絮团养殖系统中设置不同养殖密度进行试验发现,系统中微生物群落的丰富度和多样性会随着养殖密度的增加而增加;秦海鹏等[29]通过高通量测序发现系统中微生物的菌群丰度和多样性都随着养殖周期的增加而增加,在门水平上,变形菌门(Proteobacteria)的丰度逐渐下降,与本试验中发现微生物群落的发展在前期是向着生物群落多样性逐渐上升、微生物种类逐渐增加的方向发展的结论一致;廖栩峥等[30]在凡纳滨对虾生物絮团养殖系统中同样发现变形菌门(Proteobacteria)丰度最高;郭小泽等[31]在以糖蜜为碳源的草鱼生物絮团养殖系统中发现变形菌门(Proteobacteria)丰度占比较高。由此可知生物絮团系统中,在一般情况下,变形菌门(Proteobacteria)的丰度较高,在大部分情况是其优势种,接下来对于变形菌门(Proteobacteria)在生物絮团系统中重要作用进行研究十分重要。在本试验中,微生物群落系统在门水平上,变形菌门(Proteobacteria)占有绝对优势,在属水平上,就碳源种类而言,芽孢杆菌属(Bacillus)在PLA碳源系统中较高于PHBV碳源系统,这同样也验证了PLA碳源系统中微生物群落的发展较落后于PHBV碳源系统中。
在PLA碳源系统中,高盐度系统中,象牙白栖东海菌属(Donghicola)这种只存在于两个高盐度系统中的菌属异常升高,与芽孢杆菌属(Bacillus)共同构成了更加稳定的海水生物絮团系统;在PHBV碳源系统中,象牙白栖东海菌属(Donghicola)虽然存在但丰度较小。两个系统中的象牙白栖东海菌属(Donghicola)的含量对比可以初步推测PLA碳源高盐度系统在后期的微生物群落完善要快于PHBV碳源高盐度系统。
4 结论
PLA与PHBV生物可降解聚合物都可以用于生物絮团技术在海水养殖中进行应用,PHBV的水质处理效果和系统建立速度要优于PLA;低盐度更有利于生物絮团系统的建立。在微生物群落建立中,在高盐度系统中会出现象牙白栖东海菌属(Donghicola)与芽孢杆菌属(Bacillus)相互配合形成稳定系统的情况,PLA碳源组表现更为明显,另外象牙白栖东海菌属(Donghicola)只存在于高盐度系统中。
□

