黄独微型块茎环阿屯醇合酶基因克隆与序列分析
柯维忠 曾晓健 徐婷 刘霞霞 胡品书 游检









摘要:获取黄独皂苷合成途径关键酶环阿屯醇合酶(CAS)的基因全长 cDNA 序列,并进行序列分析。通过黄独微型块茎转录组数据库筛选得到 CAS基因的核心片段,利用RT-PCR 技术获得CAS 基因保守片段,采用cDNA末端快速扩增(RACE)技术获得CAS 基因的 3′及 5′末端序列,并采用生物信息学方法进行序列分析。结果表明,黄独微型块茎CAS基因编码序列长2 280 bp,编码814 bp的氨基酸序列,相对分子量为86 665.17 u,等电点为 6.21。CAS蛋白主要是由α螺旋(3366%)、延伸链(21.62%)以及无规则卷曲(44.72%)构成。CAS蛋白为亲水性蛋白,无信号肽,三级结构为单体,含有CAS所必需的功能结构域,具有PLN03012多元结构域。CAS蛋白主要存在于质膜和内质网,可能为膜蛋白。黄独CAS蛋白与其他植物的CAS 蛋白同源性较高,其中与菊叶薯蓣的CAS蛋白氨基酸相似性为9605%。从黄独微型块茎中首次获得 CAS 基因 cDNA 全长序列,该基因具有 CAS 同源基因的典型特征。
关键词:黄独;微型块茎;环阿屯醇合酶;基因克隆;序列分析
中图分类号: R282;S188文献标志码: A
文章编号:1002-1302(2022)04-0029-07
收稿日期:2021-05-26
基金项目:江西省教育厅科学技术研究一般项目(编号:GJJ190877);国家自然科学基金(编号:31360072);上饶市科技局平台载体建设项目(编号:2019I017、2020I001、2020J001)。
作者简介:柯维忠(1976—),男,江西上饶人,实验师,主要从事植物生物技术研究。E-mail:258536862@qq.com。
黄独(Dioscorea bulbifera L.)为薯蓣科薯蓣属缠绕草质藤本植物[1]。黄独地下块茎(俗称黄药子)药性寒、味苦,有小毒,能清热解毒、凉血止血、化痰消瘿[2-3]。黄药子生物活性广泛[4],临床上多用于治疗甲状腺肿等疾病,疗效显著[5]。黄药子化学成分丰富,其特有的成分为黄独总皂苷[6-7]。研究表明,甾醇皂苷是由异戊二烯途径合成的。环阿屯醇合酶(cycloartenol synthase,CAS)可将鲨烯环氧酶(squalene epoxidase,SE)催化成为环阿屯醇,这个反应是异戊二烯代谢途径中进一步合成甾醇皂苷的必经步骤[8]。因此,CAS 是植物甾醇及甾体类物质生物合成的第一个关键酶,其基因的克隆和序列分析受到了专家和学者重视。因此,研究黄独环阿屯醇合酶的基因克隆与序列分析具有现实意义。
目前,对环阿屯醇合酶基因克隆与序列分析的研究主要集中在葫芦巴(Trigonella foenum-graecum L.)[9]、丹参(Salvia miltiorrhiza)[10]、滇重楼[Paris polyphylla Smith var. yunnanensis (Franch.) Hand.-Mazz.][11]和盾叶薯蓣(Dioscorea zingiberensis C.H.Wright)[8]等植物上,而关于黄独环阿屯醇合酶基因的克隆与序列分析未见报道。近年来,黄独的药用价值愈加得到人们重视,黄独的市场需求较为旺盛,造成黃独资源的缺乏。因此,采用植物组织培养技术对其进行育苗,是提高黄独种苗的有效途径。目前,对黄独的茎尖脱毒快繁[12]、种质超低温保存[13]以及微型块茎诱导形成[14]等方面已经开展研究,今后利用细胞悬浮培养的方法提高总皂苷的产量,也是总皂苷生产的一个总方向[15]。因此,对黄独环阿屯醇合酶基因进行克隆与序列分析可以为黄独细胞悬浮培养生产总皂苷提供靶向筛选选择。本研究拟以黄独微型块茎为材料,采用CDNA末端快速扩增(RACE)技术克隆其皂苷合成代谢途径中的黄独环阿屯醇合酶(CAS)基因,并对其进行序列分析,为进一步研究黄独总皂苷合成代谢机制和利用次生代谢工程的手段提高黄独品质奠定基础。
1 材料与方法
1.1 试验材料
黄独试管苗微型块茎由上饶师范学院生命科学学院植物组织培养室提供。试验时间:2016年10月至2017年3月。试验地点:上饶师范学院生命科学学院。
1.2 试验方法
1.2.1 引物设计 以从黄独微型块茎转录组数据库中筛选的CAS基因中间序列为基础,利用Primer 5软件设计引物:RC190-CAS-1F(A A C A Y A T W C A T T A T G A A G A T G A G A A C A);RC190-CAS-1R(C C A W G C A C C T T T W G A A A T G T G A C);RC190-CAS-1R1(C C A R C C A C C W G A A G G W A G C T S T)。接头引物:3′adaptor(G C T G T C A A C G A T A C G C T A C G T A A C G G C A T G A C A G T G T T T T T T T T T T T T T T T T T T);5.3′outer(G C T G T C A A C G A T A C G C T A C G T A A C);5.3′inner(G C T A C G T A A C G G C A T G A C A G T G);AUAP(G G C C A C G C G T C G A C T A G T A C);AAP(G C C A C G C G T C G A C T A G T A C G G G G G G G G G G)。3′RACE 特异性引物:RC190-CAS-F3(G A T G C A A A A C G G C T T T A T G A T G C T G T C);RC190-CAS-F4(G G C T T T G C C A C T T A T G A A C T G A C A C G A T);RC190-CAS-F4i(G A G A T C C A A A A C C A T T G C A T)。5′RACE 特异性引物:RC190-CAS-R10(T G T G A C C C T C G A T G T G T A A A C C C C A A);RC190-CAS-R9(G C C C C A T C T C C T C C T T C A G C T T C T T);RC190-CAS-R6(G C A G G T G C A A C T T A A A G G C C T C T G A A T T);RC190-CAS-R5(G G C T G C C A T T A T A A C C C T G C A T T T T C A T);RC190-CAS-RT1(C C A C C A T C T T C A T T C A T G A G G G A A A G G A T)。
1.2.2 RNA抽提与纯化 RNA抽提与纯化采用柱式Trizol总RNA提取试剂盒[生工生物工程(上海)股份有限公司的试剂盒SK1312]。采用1.5%琼脂糖进行电泳,经1×TAE电泳缓冲液,在紫外透射光下进行观察并对其拍照。
1.2.3 cDNA第一链合成 在0.2 mL PCR管中加入total RNA(10 μL)和 3′adaptor(1 μL)。70 ℃温浴 5 min,然后冰浴2 min,加入 5× First-Strand Buffer 4.0 μL、10 mmol dNTP 2 μL、RNase抑制剂1 μL、逆转录酶2 μL进行离心(总体积 20.0 μL)。离心后42 ℃温浴60 min,再72 ℃温浴10 min。
1.2.4 基因调取 PCR反应体系(总体积25 μL):2×GC Buffer Ⅰ 12.5 μL、10 μmol/L RC190-CAS-1F 0.5 μL、10 μmol/L RC190-CAS-1R/RC190-CAS-1R1 0.5 μL、2.5 mmol/L dNTP 4 μL、ddH2O 6.3 μL、cDNA模板1 μL、5 U/μL Taq酶0.2 μL。PCR循环条件:95 ℃预变性3 min;94 ℃ 变性30 s,58 ℃退火30 s,72 ℃延伸60 s,33个循环;72 ℃修复延伸7 min。利用柱式DNA胶回收试剂盒[生工生物工程(上海)股份有限公司试剂盒B518131]进行PCR电泳与回收。经1%糖凝胶电泳观察结果后,对PCR产物胶进行回收测序。
1.2.5 3′RACE 第一轮巢氏PCR反应体系(以3′adaptor为反转引物的cDNA为模版)(总体积 25 μL):2×GC Buffer Ⅰ 12.5 μL、10 μmol/L RC190-CAS-F3 0.5 μL、10 μmol/L 5.3′outer 0.5 μL、2.5 mmol/L dNTP 4 μL、ddH2O 6.3 μL、模板(cDNA)1 μL、5 U/μL Taq 酶0.2 μL。第二轮巢氏PCR反应体系(以3′adaptor为反转引物的cDNA为模版)(总体积50 μL):2×GC Buffer Ⅰ 25 μL、10 μmol/L RC190-CAS-F4 1 μL、10 μmol/L 5.3′inner 1 μL、2.5 mmol/L dNTP 8 μL、ddH2O 12.5 μL、模板(第一轮PCR稀释产物) 1 μL、5 U/μL Taq酶 0.5 μL。第一轮PCR循环条件:95 ℃ 预变性3 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸60 s,33个循环;72 ℃修复延伸7 min。第二轮PCR循环条件:95 ℃预变性3 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸60 s,33个循环;72 ℃修复延伸7 min。利用柱式DNA胶回收试剂盒[生工生物工程(上海)股份有限公司试剂盒B518131]进行PCR电泳与回收。经1%糖凝胶电泳观察结果后,对PCR产物胶进行回收测序。
1.2.6 5 ′RACE 第一轮巢氏PCR反应体系(末端加C法,以特异性引物RC190-CAS-RT1反转,得到cDNA,经核糖核酸酶H(RNase H)和末端脱氧核苷酸转移酶(TdT)处理后,进行巢氏PCR,操作步骤见Invitrogen 5′ RACE系统手册)(总体积25 μL):2×GC Buffer Ⅰ 12.5 μL、10 μmol/L AAP 0.5 μL、10 μmol/L RC190-CAS-R5/RC190-CAS-R9 05 μL、25 mmol/L dNTP 4 μL、ddH2O 6.3 μL、模板(cDNA) 1 μL、5 U/μL Taq酶0.2 μL。第二轮巢氏PCR反应体系(末端加C法,以特异性引物RC190-CAS-RT1反转,得到cDNA,经RNase H 和TdT处理后,进行巢氏PCR,操作步骤见Invitrogen 5′ RACE系统手册)(总体积50 μL):2×GC Buffer Ⅰ 25 μL、10μmol/L AUAP 1 μL、10 μmol/L RC190-CAS-R6/RC190-CAS-R10 1 μL、2.5 mmol/L dNTP 8 μL、ddH2O 12.5 μL、模板(第一轮PCR稀释产物)1 μL、5 U/μL Taq酶 05 μL。第一轮PCR循环条件:95 ℃ 预变性 3 min;94 ℃变性30 s,68 ℃退火30 s,72 ℃延伸 60 s,33个循环;72 ℃修复延伸7 min。第二轮PCR循环条件:95 ℃预变性3 min;94 ℃变性30 s,68 ℃退火30 s,72 ℃延伸60 s,33个循环;72 ℃修复延伸7 min。按照柱式DNA胶回收试剂盒[生工生物工程(上海)股份有限公司试剂盒B518131]进行PCR电泳与回收。经1%糖凝胶电泳观察结果后,对PCR产物进行克隆测序。
1.2.7 序列拼接 利用 DNAMAN 软件将中间序列及RACE试验得到的序列进行拼接,得到基因全长序列。
1.2.8 分析方法 测序获得的基因cDNA序列经NCBI的ORF finder(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)服務器,进行开放阅读框分析。此外,借助ProtParam pI/Mw(http://web.expasy.org/compute_pi)、GOR IV(http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_gor4.html)、SWISS-MODEL(http://swissmodel.expasy.org/)软件预测目标序列一、二、三级结构;再依次利用 SigalP 4.1 Server(http://www.cbs.dtu.dk/services/SignalP/)和 ProtScale(http://web.expasy.org/protscale/)软件预测基因编码氨基酸的信号肽和疏水性/亲水性;最后使用Blastp 工具在NCBI 上查找基因同源氨基酸序列,并运用MEGA 4.0软件中的近邻相接法(nerghbor-joining,NJ)(1 000次Bootstrap)构建同源进化树。
2 结果与分析
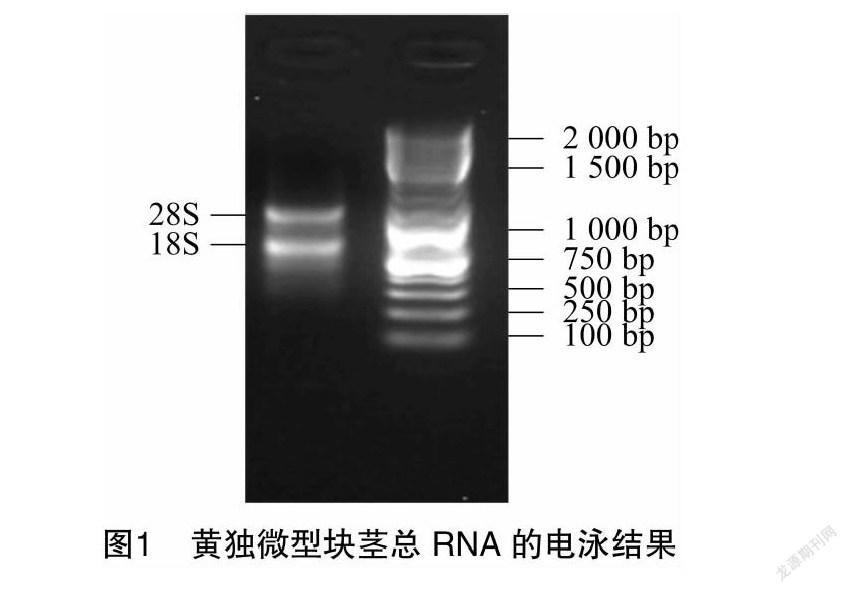
2.1 RNA 提取
黄独微型块茎总RNA的电泳图见图1。左侧泳道可清晰观察到28S和18S 2条区带,表明提取的RNA较为完整,质量较高,可用于RT-PCR。
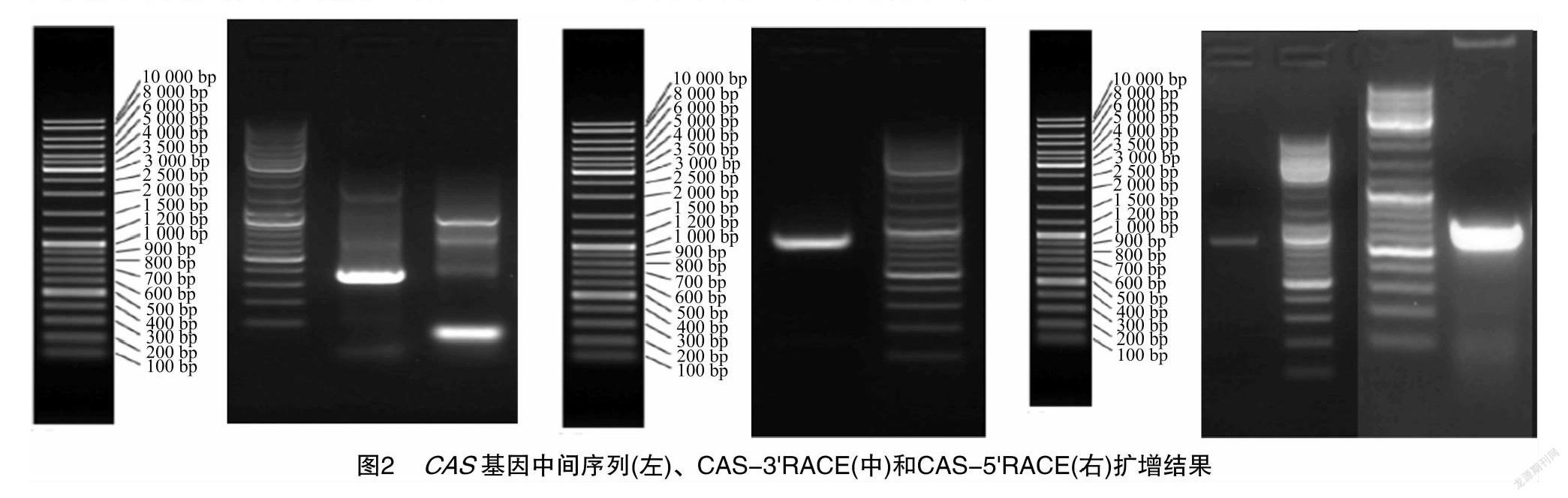
2.2 黄独微型块茎CAS基因克隆
通过RACE技术(图2),得到全长为2 280 bp的cDNA序列(图3),G+C含量为45.70%,A+T含量为54.30%,碱基组成见图4。经NCBI的ORF finder进行开放阅读框分析,得到814 bp的氨基酸序列(图5)。
2.3 CAS基因预测氨基酸的一级结构分析
Protparam预测显示该蛋白由759个氨基酸组成,分子量为86 665.17 u,等电点为6.21,为亲水性蛋白。氨基酸的组成和比例为49个丙氨酸 (Ala),占6.5%;40个精氨酸 (Arg),占5.3%;31个天冬酰胺 (Asn),占4.1%;36个天冬氨酸(Asp),占47%;19个半胱氨酸(Cys),占2.5%;24个谷氨酰胺 (Gln),占3.2%;50个谷氨酸(Glu),占6.6%;59个甘氨酸 (Gly),占7.8%;27個组氨酸 (His),占3.6%;42个异亮氨酸(Ile),占5.5%;79个亮氨酸(Leu),占10.4%;35个赖氨酸 (Lys),占 4.6%;22个甲硫氨酸 (Met),占2.9%;28个苯丙氨酸 (Phe),占3.7%;41个脯氨酸 (Pro),占5.4%;47个丝氨酸 (Ser),占6.2%;33个苏氨酸 (Thr),占4.3%;27个色氨酸 (Trp),占3.6%;33个酪氨酸 (Tyr),占4.3%;37个缬氨酸 (Val),占4.9%。负电荷残基(Asp+Glu)总数为86;正电荷残基(Arg+Lys)总数为75;原子总数为12 058个,具体组成如下:碳原子3 917个,氢原子5 950个,氮原子1 050个,氧原子1 100个,硫原子41个。
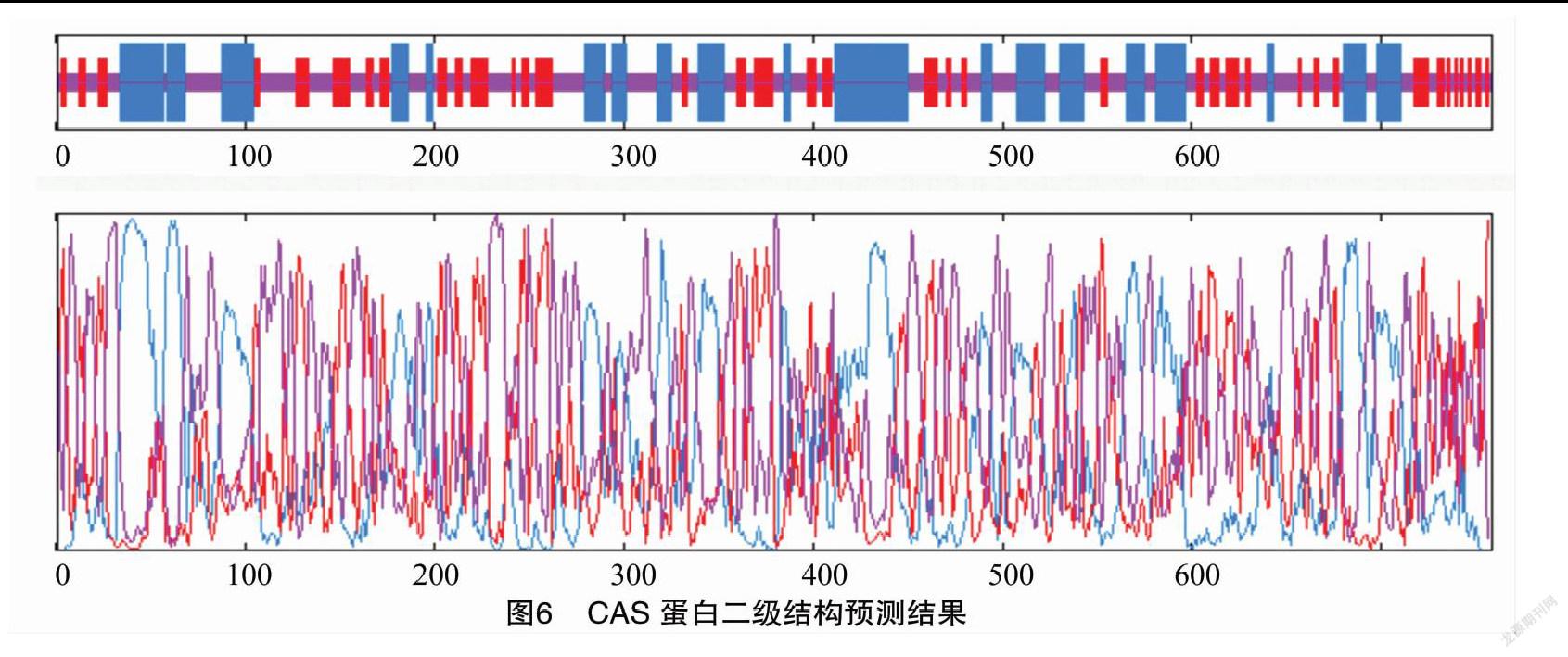
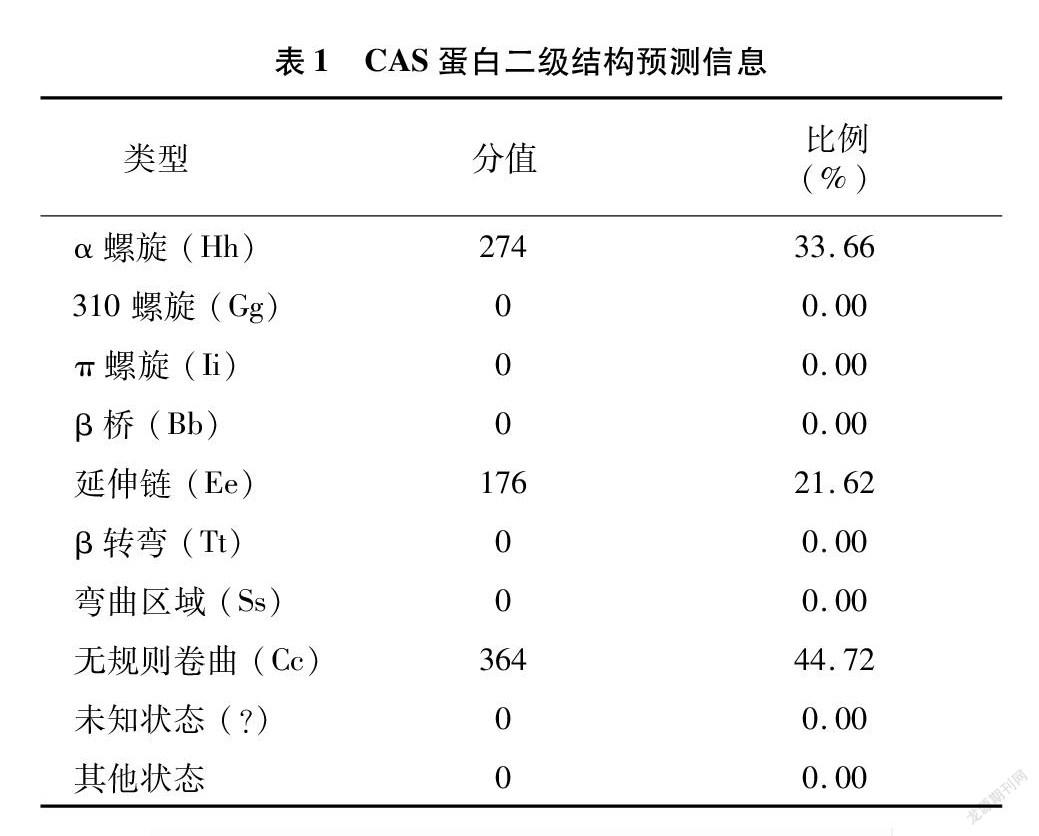
2.4 CAS蛋白二级结构分析
由GOR IV软件预测(图6和表1)得知,CAS蛋白主要是由α螺旋(图6中蓝色部分,占33.66%)、延伸链(图6中红色部分,占21.62%)以及无规则卷曲(图6中黄色部分,占44.72%)构成,该蛋白质可能不含β折叠结构。
2.5 CAS蛋白亲水性/疏水性预测
通过ProtScale软件预测分析,从图7可知,图中的高峰值(正值)的区域表示疏水的区域,而负值的低谷区域是亲水区域。 由亲疏水性分析可知,该蛋白为亲水性蛋白质。
2.6 CAS蛋白信号肽预测与分析
SignalP 4.0 Server软件预测结果(表2)显示,CAS编码蛋白的第25位苯丙氨酸残基可能是信号肽原始剪切位点,其最高预测分值及最高的信号肽分值分别仅为0.168、0.277,第35位丙氨酸残基的最高综合剪切位点分值0.201,综合分析结果表明CAS蛋白无信号肽。
2.7 CAS蛋白三级结构分析
蛋白质三维结构预测分析结果显示,CAS蛋白质主要由α螺旋、延伸链以及无规则卷曲构成,与二级结构分析结果一致。SWISS-MODEL预测结果显示其三级结构为单体。蛋白质结构域分析结果表明,CAS蛋白包含有CAS所必需的功能结构域(图8)。
2.8 CAS蛋白功能预测
通过CAS氨基酸序列比对KEGG数据库,得到直系同源KEGG号:K01853(http://www.genome.jp/dbget-bin/www_bget?K01853)(图9)。参与 2,3-环氧角鲨烯生成环阿屯醇的酶促反应过程。
2.9 CAS蛋白的保守结构域分析
经软件分析,该蛋白属于 IDOPREN_C2_like superfamily,具有PLN03012多元结构域。
2.10 CAS蛋白亚细胞定位
采用 Psort在线软件对CAS基因的表达部位进行预测结果(图10)表明,定位于质膜(plas)中的数量为6,内质网(E.R.)中的数量为4,叶绿体(chlo)中的数量为1,细胞核(nucl)中的数量为1,细胞质(cyto)中的数量为1,线粒体(mito)中的数量为1,表明CAS蛋白主要存在于质膜和内质网。该蛋白可能为膜蛋白。
2.11 CAS蛋白的氨基酸同源性分析
应用NCBI中的BlastP程序,对CAS蛋白的氨基酸序列进行同源性分析(图11)发现,该蛋白与菊叶薯蓣(Dioscorea composite,AIW81530.1)的CAS蛋白氨基酸相似性为96.05%。系统进化树分析也显示,该蛋白与菊叶薯蓣CAS蛋白(AIW81530.1)亲缘关系较近。
3 讨论
薯蓣皂苷广泛存在于药用植物中,如薯蓣科、百合科、石竹科和蔷薇科等,尤其在薯蓣属植物根茎中含量丰富[16-17],具有抑瘤、抗菌、免疫调节等多种药用活性[9]。薯蓣皂苷为糖缀合物,1个或多个糖链连接于非极性三萜或类固醇苷骨架,化学结构类似甾体激素[18]。因此,薯蓣皂苷广泛用于激素类药物的合成,是医药工业中仅次于抗生素的世界第二大类药物,被誉为“激素之母”,我国薯蓣皂苷年产量约为3 500 t,占全世界年需求总量的70%[19]。研究表明,胆固醇或 β-谷甾醇是薯蓣皂素的合成前体,而薯蓣皂素合成的必经中间体是环阿屯醇[20]。氧化鲨烯环化酶家族中一个重要成员是CAS,它可以催化2,3-氧化鲨烯转化为环阿屯醇[21],CAS基因是环阿屯醇合成的关键调控基因,也是甾醇及甾体类物质生物合成的重要环化酶[22]。环阿屯醇为植物甾醇类化合物,是甾醇类化合物生物合成的关键前体物质,可抗炎、抗氧化、抗肿瘤、调节胆固醇等。目前,CAS基因已从葫芦巴(Trigonella foenum-graecum L.)[9]、丹参(Salvia miltiorrhiza)[10]、滇重楼[Paris polyphylla Smith var. yunnanensis (Franch.) Hand.-Mazz.][11]和盾叶薯蓣(Dioscorea zingiberensis C.H.Wright)[8]等多种植物中分离和克隆,并对其序列特征进行了分析。
微型块茎别称“零余子”“小块茎”“珠芽”,是腋芽形成的地上变态小块茎颗粒,特指薯蓣属植物组培试管苗腋芽处极易诱导形成且附生较多气生根的小型变态块茎[23],可以在黑暗和低温处长期保存且可恢复活力萌芽,具有体积小、便于储存和运输等优点[23],不仅可作为薯蓣属植物田间繁殖的生产种子,也可作为薯蓣皂苷提取和生产的重要来源[24]。本试验通过对黄独微型块茎转录组数据进行分析,筛选到CAS基因的中间序列核心片段,利用RACE 技术获取该基因全长cDNA序列,生物信息学分析结果表明,CAS基因编码序列长2 679 bp,编码814 bp的氨基酸序列,相对分子量为 92 703.04 u,等电点为 621。这是在黄独中首次分离得到该基因,研究结果对下一步利用该基因构建表达载体,分析其在微型块茎诱导形成过程中所具有的功能具有重要意义。同时,也为进一步研究黄独总皂苷合成代谢机制和利用次生代谢工程的手段提高黄独品质奠定了基础。
参考文献:
[1]巫圣乾,张 璐,龚梦鹃,等. 黄独素B致小鼠急性肝损伤的代谢组学研究[J]. 中国药房,2018,29(22):3046-3050.
[2]杜樂梅,付淑军,吴增光,等. 黄独素B的体外代谢通路及其代谢产物研究[J]. 中草药,2019,50(23):5760-5766.
[3]刘劲松,高卫娜,郑 娟,等. 黄独鲜块根化学成分研究[J]. 中国中药杂志,2017,42(3):510-516.
[4]李 军,刘 晨,王君明,等. 黄药子黄独素B活性、毒性及配伍减毒[J]. 中国老年学杂志,2019,39(15):3846-3848.
[5]付淑军,袁 圆,石小娜,等. 黄独中二萜内酯类成分的LC-MS/MS分析方法的建立[J]. 中药材,2019,42(10):2335-2338.
[6]李春红,梅志强,田 吉,等. 黄独总皂苷的含量测定研究[J]. 泸州医学院学报,2012,35(6):577-579.
[7]李春红,梅志强,田 吉,等. 大孔树脂对黄独总皂苷的分离纯化工艺优选[J]. 中国实验方剂学杂志,2012,18(16):27-29.
[8]涂碧梦,陈永勤,杨之帆. 盾叶薯蓣环阿屯醇合酶全长基因的克隆与分析[J]. 西北植物学报,2010,30(1):8-13.
[9]刘梦迪,李长福,章焰生. 葫芦巴环阿屯醇合酶基因的分离及其对薯蓣皂素合成的影响[J]. 植物科学学报,2019,37(1):87-92.
[10]李 珍,王东浩,姚 伟,等. 丹参环阿屯醇合酶基因克隆及表达分析[J]. 西北植物学报,2013,33(7):1285-1291.
[11]袁梦求,丁春邦,陶 亮,等. 滇重楼环阿屯醇合酶基因的克隆及序列分析[J]. 中草药,2012,43(11):2250-2256.
[12]尹明华,洪森荣. 黄独脱毒苗快繁技术的研究[J]. 中草药,2009,40(12):1975-1980.
[13]Yin M H,Hong S R.A simple cryopreservation protocol of Dioscorea bulbifera L. embryogenic calli by encapsulation-vitrification[J]. Plant Cell,Tissue and Organ Culture,2010,101(3):349-358.
[14]洪森荣,尹明华,夏瑾华. 植物生长调节剂对黄独试管苗微型块茎诱导形成的影响[J]. 中草药,2014,45(13):1928-1937.
[15]袁丽红,周海霞,于 潇,等. 盾叶薯蓣悬浮培养细胞生长及薯蓣皂苷元合成[J]. 生物加工过程,2008,6(2):43-47.
[16]陈亚琴,曹拥军.薯蓣皂苷的现代药理学研究进展[J]. 现代中西医结合杂志,2019,28(23):2613-2617.
[17]徐 梅,魏怡冰,杜富强,等. 10种黔产薯蓣属植物叶表皮微形态特征及分类学意义[J]. 江苏农业科学,2019,47(24):82-87.
[18]Ulbricht C,Basch E,Sollars D,et al. Wild yam (Dioscoreaceae)[J]. Journal of Herbal Pharmacotherapy,2003,3(4):77-91.
[19]杨鹏飞,朱烨婷,方 旭,等. 加压提取法制备盾叶薯蓣根茎中薯蓣皂苷元[J]. 中成药,2019,41(11):2745-2747.
[20]Sonawane P D,Pollier J,Panda S,et al. Plant cholesterol biosynthetic pathway overlaps with phytosterol metabolism[J]. Nature Plants,2017,3:16205.
[21]Stohs S J,Sabatka J J,Rosenberg H.Incorporation of 4-14C-22,23-3H-sitosterol into diosgenin by Dioscorea deltoidea tissue suspension cultures[J]. Phytochemistry,1974,13(10):2145-2148.
[22]乔 晶,崔晟榕,石宏武,等. 罗汉果环阿屯醇合酶的同源建模、分子对接及催化环化的机理推测[J]. 生物技术通报,2019,35(2):101-108.
[23]李俊华,刘世宇,李成龙,等. 铁棍山药微型块茎遗传转化体系的建立[J]. 植物学报,2019,54(1):72-80.
[24]李明军,刘欣英,李 萍,等. 山药微型块茎诱导形成的影响因子研究[J]. 中草药,2008,39(6):905-910.
[25]李明军,刘世宇,刘 雯,等. 怀山药微型块茎形成过程中的生理生化变化[J]. 植物生理学报,2017,53(5):807-814.
3593500338242

