内皮-间质转化在眼部疾病中的研究进展
孟志尚,吴文一,罗 静
0引言
内皮-间质转化(endothelial-to-mesenchymal transition, EndoMT)是在特定的病理或生理条件下,内皮细胞向间质细胞转化或分化,并伴随表型和功能改变的过程。具体表现为内皮细胞由鹅卵石样外形转为长梭形,失去特异标志物如VE-钙黏蛋白(VE-cadherin)、Tie受体1/2(tyrosine kinase with Ig and EGF homology domains 1/2, Tie-1/2)、血管内皮生长因子受体1/2(vascular endothelial growth factor receptor 1/2, VEGFR 1/2)、血小板-内皮细胞黏附分子-1/CD31(platelet-endothelial cell adhesion molecule-1/cluster of differentiation 31, PECAM-1/CD31)等,转而表达间质细胞特异性标志物,如α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)、波形蛋白(Vimentin)和成纤维细胞特异性蛋白-1(fibroblast specific protein-1, FSP-1)等,并获得较强的增殖和迁移能力[1](图1)。作为上皮-间质转化(epithelial-to-mesenchymal transition, EMT)的特殊形式,该现象最早在心血管系统胚胎发育中被发现[2],亦是机体损伤修复的重要机制[3]。与EMT类似,EndoMT广泛参与肿瘤侵袭及心、肺、肾、眼等器官纤维化疾病等病理过程[4-5]。越来越多的证据证实了EndoMT在眼部疾病中的重要作用,包括角膜病[6]、青光眼[7]、视网膜脉络膜新生血管性疾病[8-9]等。本文针对EndoMT的基本生物学特征、发生机制及其在眼部疾病中的相关研究展开综述。
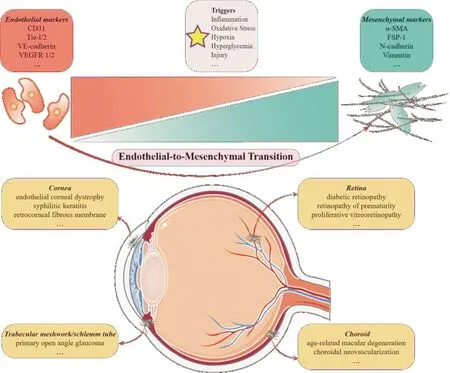
图1 EndoMT参与眼病模式图 眼球插图基于Servier Medical Art(http://smart.servier.com/)修改,并根据Creative Common Attribution 3.0许可使用(https://creativecommons.org/licenses/by/3.0/)。
1 EndoMT的基本生物学特征
胚胎发育过程中,EndoMT介导了视网膜血管的发育[10]。成体中正常表型的内皮细胞是维持机体正常功能的重要保障。包括脑毛细血管内皮细胞参与构成的血-脑屏障,眼中虹膜血管内皮细胞参与构成的血-房水屏障、视网膜血管内皮细胞参与构成的血-视网膜屏障等[11]。机体在创伤、药物、感染等损伤因素作用下,抗损伤修复机制启动,包括成纤维细胞激活、大量增殖,细胞外基质合成增多、沉积等[12]。但慢性炎症等刺激因素可诱发病理性新生血管形成及成纤维细胞过度增殖,造成瘢痕、组织纤维化等不良后果,EndoMT在其中扮演了重要的角色[13],且其在一定时间及条件范围内具备可逆性[14]。所以,研究EndoMT的发生机制,探究其中的关键分子和涉及的信号通路,寻求潜在的治疗靶点,具有重要的临床意义。
2 EndoMT的发生机制
EndoMT发生机制复杂,涉及多种分子和通路的交互作用,目前研究多聚焦于转化生长因子β(transforming growth factor beta,TGF-β)家族关键分子和通路的作用及相应抑制剂的运用方面。
TGF-β是诱导EndoMT发生的关键因子,TGF-β的3种亚型TGF-β1、TGF-β2和TGF-β3均参与EndoMT[15]。其中,TGF-β2被认为是最有效的激活剂,TGF-β1和TGF-β3诱导的EndoMT亦需TGF-β2介导,且运用siRNA沉默TGF-β2基因表达可减弱经TGF-β1和TGF-β3处理的细胞中EndoMT标志物的表达[16]。TGF-β/Smad以及非Smad依赖的非经典型途径均参与EndoMT过程(图2),经典Smad途径中,TGF-β与膜受体结合活化后,Smad2/Smad3磷酸化,继而结合Smad4,在细胞核内发挥调控EndoMT相关基因表达的作用,Smad7是其中重要的负性调控因子[17]。多条非Smad依赖性通路也参与EndoMT的发生,TGF-β可通过MAPK家族(包括ERK、JNK、p38 MAPK)、PI3K/Akt/mTOR、Rho/ROCK、Rac、c-Abl、PKC和NF-κB等下游通路参与EndoMT[18]。另外,TGF-β途径与Wnt、Notch等通路可能存在交互作用,如Notch配体Jagged-1是Wnt/TCF的靶基因[19]。通过上述途径,内皮特异性基因转录减少或由EndMT相关转录因子(如Snail、Slug、Twist、Zeb等)介导的间质特异性基因转录增加,作为靶蛋白的内皮特异标志物表达相应减少,内皮细胞结构改变,获得间质细胞表型,也即产生EndoMT[20]。细胞因子在EndoMT中也发挥了直接或间接作用,如TNF-α、IL-1β、IL-6、IL-13等可通过IRAK的介导激活NF-κB而参与EndoMT,IL-13诱导的EndoMT中还涉及了STAT6、AKT分子级联反应等过程[3]。随着表观遗传学、多组学研究等领域的发展,有关非编码RNA在EndoMT中的调控网络也逐步被揭开[18,21]。
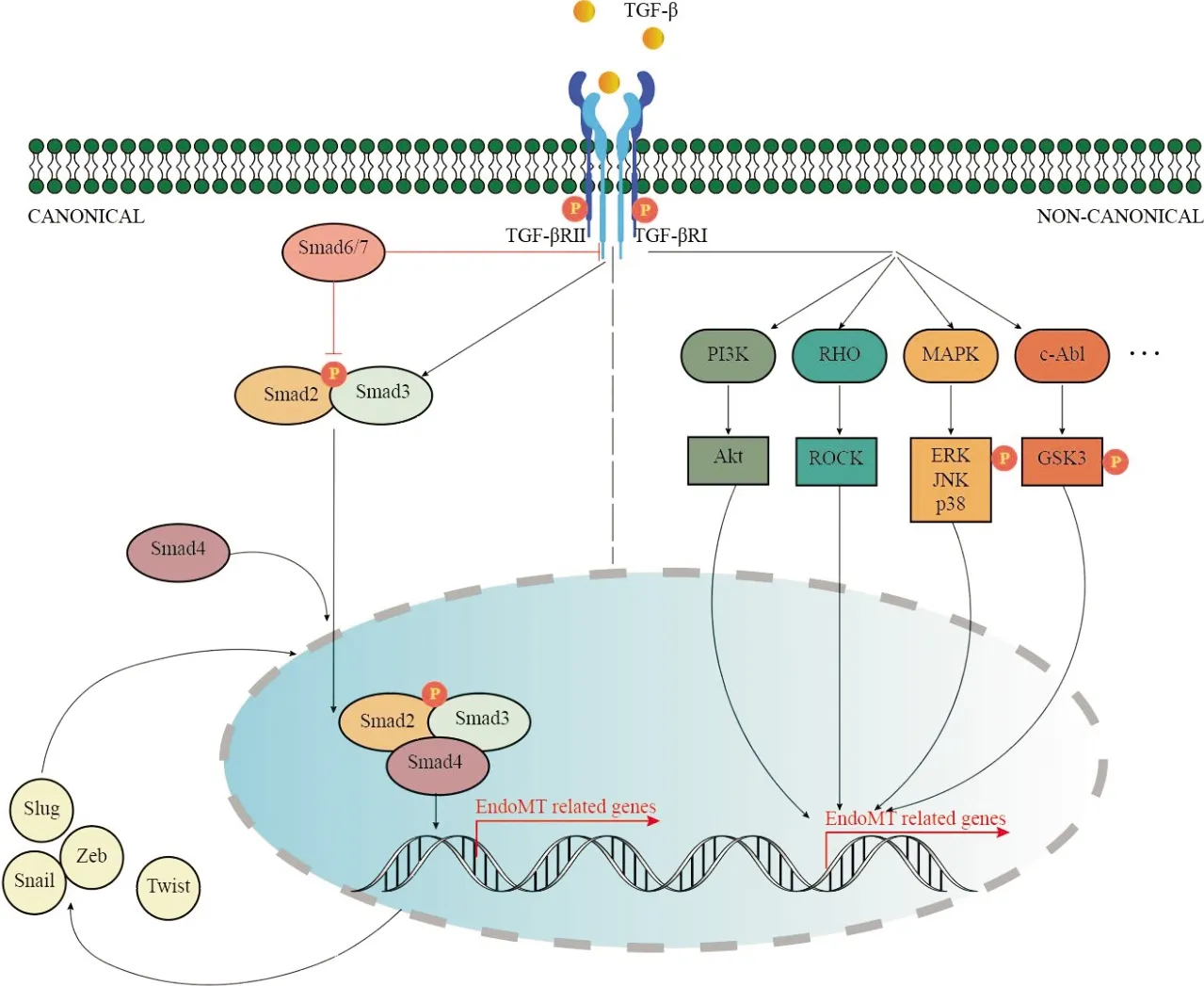
图2 TGF-β通路参与EndoMT示意图。
3 EndoMT与眼部疾病
3.1角膜病正常数量和质量的角膜内皮细胞通过主动泵机制,维持角膜透明性。角膜内皮损伤较小时可由附近的正常细胞迁移修复,而在内眼手术损伤、角膜基质和前房持续炎症等因素刺激作用下,EndoMT参与的纤维化及细胞外基质可沉积于角膜内皮层与后弹力层之间,形成角膜后膜[22]。在Fuchs角膜内皮营养不良、后部多型性角膜内皮营养不良、梅毒性角膜基质炎患者中均发现角膜内皮细胞向间质转化的表现,如细胞梭形改变,α-SMA、波形蛋白、FSP-1、I型和Ⅲ型胶原表达阳性等[23-24],且Zeb1突变与迟发型Fuchs角膜内皮营养不良、后部多型性角膜内皮营养不良相关[25]。人离体角膜细胞模型中,碱性成纤维细胞生长因子可上调Snail1/2、Zeb1/2而诱导EndoMT,且随传代培养程度加重[26]。核p120连环蛋白可调节Rho/ROCK,控制接触抑制状态的角膜内皮细胞增殖,转入p120 siRNA可激活p-120连环蛋白-kaiso信号传导途径,抑制EndoMT而不影响正常细胞增生[6],运用ROCK抑制剂也可有效改善角膜内皮细胞的细胞形态、细胞间连接及转运蛋白表达[27]。基质金属蛋白酶(matrix metalloproteinase, MMP)家族激活Wnt信号通路,由成纤维细胞产生的外泌体介导,使离体角膜内皮表现出间质特征,MMP抑制剂可逆转这一过程[28]。在转入Smad7基因的大鼠角膜碱烧伤模型中,Smad2被阻断从而抑制EndoMT,而正常的创伤修复过程不受影响[22]。上述多维度的研究结果展现出EndoMT相关分子作为角膜纤维化疾病治疗靶点的广泛前景,揭示其中精密复杂的调控机制可能是未来研究的方向。
严重角膜内皮失代偿者需角膜移植,Naranjo等[23]研究发现在一部分后弹力层剥离角膜内皮移植(DSAKE)术后病例中,组织病理切片可见后弹力层与内皮层间存在纤维膜样组织,其中可发现长梭形细胞及间质细胞标志物α-SMA、波形蛋白表达阳性,可能是由角膜内皮细胞经EndoMT机制转化形成成纤维样细胞,分泌非正常的细胞外基质形成角膜后膜,造成角膜混浊,严重者最终导致移植失败。角膜供体不足也是困扰角膜移植领域的难题,研究再生医学工程EndoMT作用的重要性不言而喻,探索EndoMT在离体角膜细胞培养中的相关机制可能是再生医学领域中的潜在突破点。
3.2青光眼小梁网和Schlemm管的病理性纤维化会使房水流出通道受阻,参与青光眼的病理生理过程。Ashok等[7]研究发现,小梁细胞的EndoMT参与原发性开角型青光眼(primary open angle glaucoma,POAG),正常构象的朊病毒蛋白(prion protein, PrPC)是正常基因编码的产物,小梁细胞和Schlemm管内皮细胞表达的PrPC具有抗氧化及维持细胞外基质平衡的重要生理功能,其缺失或功能障碍会激活Rho/ROCK通路,致使小梁细胞EndoMT,发生病理性纤维化而增加房水流出阻力。此外,TGF-β2处理体外培养的Schlemm管内皮细胞可出现失去CD31、VE-钙黏蛋白等标志,转而表达α-SMA、Ⅰ型和Ⅳ型胶原等一系列EndoMT的特征性转变[29]。除EndoMT外,EMT参与了青光眼中滤过手术后瘢痕化、视神经受损纤维化等病理过程[3],展现出其在青光眼发生及术后纤维化全过程中发挥的重要作用,为青光眼全程管理提供了新见解。
3.3视网膜脉络膜疾病正常血管的生长和成熟是一个多种生长因子及抑制因子平衡控制,既涉及组织的自然发育,也涉及新生血管性疾病病理过程[30-31]。血管新生与纤维增殖是视网膜脉络膜疾病重要的研究方向,内皮细胞的增殖迁移是其中的重要环节,探究其涉及的调控机制及潜在治疗策略有重要的临床意义。
糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病患者终末器官损害的眼部表现[32]。抗VEGF治疗糖尿病性黄斑水肿(diabetic macular edema, DME)中可能出现的纤维化加重,增殖性糖尿病视网膜病变(proliferative diabetic retinopathy, PDR)中纤维增殖膜等造成牵拉性视网膜脱离,加大手术难度等都是临床亟待解决的关键问题。多项研究表明,EndoMT不但参与了上述纤维化过程,更贯穿了DR发生发展的始终[9,33]。高糖可诱导血管内皮细胞发生EndoMT,血管紧张素-Ⅱ(angiotensin Ⅱ)是参与的介质之一[34]。晚期糖基化终末产物也被证实可诱导视网膜血管内皮细胞发生EndoMT,AKT2信号通路是此过程的关键要素[35]。神经损伤动物模型中,血管内皮细胞可通过自噬-溶酶体途径吞噬清除受损的髓鞘,诱导炎症、血管生成和以EndoMT为基础的纤维修复等序贯事件,揭示了EndoMT在DR神经病变中发挥的重要作用[36]。在PDR患者的纤维增殖膜中发现,血管内皮细胞经EndoMT机制转化为活化的成纤维细胞,表达α-SMA、FSP-1等EndoMT的特异标志物[37],并且已经发生转化的细胞可以发挥抑制新生血管生成的作用[33],这一发现可能为DR的血管新生与纤维化之间的“跷板”平衡理论提供了新的证据[38]。现有一些处于临床试验中抗DME新生血管的“双抗”药物已取得较为满意的实验结果[39],提示针对EndoMT相关的纤维化和抗新生血管形成的联合疗法,可能是未来治疗DR的合理趋势。
早产儿视网膜病变(retinopathy of prematurity, ROP)是致婴幼儿失明的常见视网膜血管性疾病,其致盲的主要原因是新生血管增生牵拉形成的牵拉性视网膜脱离和(或)异常血管渗漏导致的渗出性视网膜脱离[40]。ROP患儿的抗血管内皮生成因子(vascular endothelial growth factor, VEGF)治疗目前仍不在该药常见治疗疾病范围内,其安全性、对正常发育的影响、加重纤维增殖等仍然是临床难题。研究发现,在ROP小鼠模型中,缺血缺氧条件可能促使内皮细胞从现有血管床分离,经EndoMT机制增殖,进一步克隆扩增,参与病理性新生血管的形成[41]。虽然其具体过程仍需进一步研究,但也为ROP治疗提供了切入点。
年龄相关性黄斑变性(age-related macular degeneration, ARMD)是中老年人视力丧失的主要病因[42]。根据病理特征可分干性和湿性,后者以脉络膜新生血管(choroidal neovascularization, CNV)为主要特征。病患人群中湿性ARMD更多且视力危害更严重[43]。尽管抗VEGF药物已经成为湿性ARMD的标准治疗药物,但存在长期使用疗效降低导致视网膜下纤维化和瘢痕形成及地图样萎缩使病情加重等问题。脉络膜和视网膜血管内皮细胞的EndoMT机制参与了视网膜下新生血管改建、损伤愈合及纤维病灶的形成[8]。转录因子Snail1在促进包括CNV在内的眼部新生血管性疾病早期阶段起着重要的作用。RNA-seq结果分析表明,敲除Snail1基因减少了控制细胞骨架排列和细胞外基质重塑的基因表达,行玻璃体腔内注射Snail1 siRNA抑制了CNV小鼠模型中新生血管的形成[44]。Rossato等[45]研究发现,EndoMT还可能是CNV抗VEGF治疗耐药的原因,抗VEGF药物可诱导人视网膜血管内皮细胞(human retina endothelial cell, HRECs)发生EndoMT病理改变,抑制EndoMT后可明显提高HRECs对抗VEGF药物的反应,在CNV的小鼠模型中联合使用抗VEGF及抗EndoMT药物可明显抑制新生血管的形成,为眼科新生血管疾病的研究及联合治疗提供了新思路。
4结语与展望
综上所述,EndoMT在人体生理功能和疾病进程中都发挥了重要的作用,相关靶向治疗药物已在心、肺、肾等器官或系统性纤维化疾病中作为临床治疗选择。眼部疾病自身承载的视觉器官具有精准细微等特点,需要更科学更完善的理论和实验研究。通过寻找早期可靠的EndoMT相关生物标志物,针对下游病理性靶标精准治疗的同时,又不影响正常损伤修复相关的信号通路,为基础研究及临床工作提供依据。

