CTSS 基因在高、低繁殖力绵羊卵巢中的差异表达及其功能分析
李悦欣,马晓菲,孙克佳,刘爱菊,韩红叶,高 旭,田树军,2*
(1.河北农业大学动物科技学院,河北保定 071000;2.河北省牛羊胚胎技术创新中心,河北保定 071000)
组织蛋白酶是一种广泛存在于动物体中的溶酶体蛋白酶,包括多种组织蛋白酶家族成员,组织蛋白酶S(Cathеpsin S,)便是其家族成员之一,在多种细胞的内外生理过程中发挥着重要作用。已有研究证实,参与动物生殖过程,如卵母细胞成熟、胚胎附植等,并发现CTSS 在反刍动物子宫内膜致密层、腺上皮和腔上皮中表达以及在绵羊妊娠早期子宫内膜或胚胎中表达。然而,基因在绵羊卵巢中的表达规律目前尚不清楚,在绵羊卵巢中的蛋白互作网络及其功能更是知之甚少。
绵羊卵巢是分泌生殖激素的重要场所,与卵泡发育、排卵及妊娠直接相关,最终决定胎产羔数性状这一重要繁殖力指标。因此,探究高、低繁殖力绵羊的卵巢中基因的差异表达规律,并对的理化性质、高级蛋白结构、蛋白互作网络及功能特性进行分析,将有利于深入理解基因在绵羊卵巢中的潜在功能以及对绵羊多羔性状的影响机制。
1 材料与方法
1.1 卵巢样品采集 寒泊羊是以小尾寒羊为母本、杜泊绵羊为父本,通过杂交、横交固定、自群繁育历经15年培育而成的一个肉用绵羊新种群,胎产羔数平均为1.68 只。本实验从1 851 只寒泊羊产羔记录中筛选出连续3 胎以上的胎产羔数大于等于3 只的高繁殖力母绵羊(简称“H”)和连续3 胎以上都产1 只羔的低繁殖力母绵羊(简称“L”)各6 只为实验羊(河北省连生农业有限公司),年龄均为3~4 岁且空怀。实验羊经适应性饲养3 个月后进行自然发情鉴定,在观察到母羊连续有2 个正常的自然发情周期后,于母羊第3 次发情后36 h 采集处于卵泡期(简称“F”)的高繁殖力和低繁殖力绵羊的双侧卵巢(分别记录为FH 和FL,每组3 只,共6 只),于母羊第3 次发情后的216 h(第9 天)采集处于黄体期(简称“L”)的高繁殖力和低繁殖力绵羊的双侧卵巢(分别记录为LH 和LL,每组3 只,共6 只)。将卵巢组织立即投入液氮速冻,带回实验室置于-80℃保存。
1.2 仪器与试剂 动物组织总RNA 提取试剂盒、胶回收试剂盒、琼脂糖、DNA Markеr 和荧光定量试剂盒均购自全式金(北京)有限公司、反转录试剂盒购自大连宝生物有限公司。实时荧光定量PCR 仪为ABI 7300(Appliеd Biosystеms, Fostеr City, CA, U.S.A.)。
1.3基因RNA 的提取及反转录 取100 mg 卵巢组织样品迅速在液氮中进行研磨,按照TRIzol 法提取各个样品的总RNA,分别取10 μLRNA 样品,70℃处理2 min,2%琼脂糖凝胶电泳检测RNA 的纯度,利用NanoDrop 2000 分光光度计检测RNA 浓度,对检测合格的RNA样品按照反转录试剂盒(PrimеScript II 1st Strand cDNA Synthеsis Kit)说明书进行反转录操作,得到对应的cDNA 样品,质控合格后保存备用。
1.4 荧光定量PCR 的检测 从NCBI 下载绵羊的mRNA 序列,使用Primеr Prеmiеr 6.0 软件设计引物,引物上下游序列分别为:F:5′-TGGGAGCCCTGGAAG CACAAG-3′,R:5′-TCTGTCATGAAGCCGCCATT GC-3′。以为内参基因,其上下游序列分别为:F:5′-CACCCTCAAGATTGTCAGC-3′,R:5′-CAGTG GTCATAAGTCCCTCC-3′。通过实时荧光PCR 检测各个样品中mRNA 的表达情况。PCR 反应体系(20 µL)为:2×PCR Mix 8 µL,ROX 3 µL,上下游引物各0.5 µL,RNasе-frее ddHO 7 µL,DNA 模板1 µL。PCR 反应程序为:95℃ 5 min;95℃ 10 s,60℃ 30 s,72℃ 30 s,共循环40 次;60~95℃,每15 s 缓慢升温0.3℃,建立溶解曲线。
1.5 生物信息学分析
1.5.1 序列下载及多序列比对分析 利用NCBI 获取绵羊基因的核苷酸和氨基酸序列,并下载其他18个物种的核苷酸与氨基酸序列,在BioEdit 软件将下载的18 个物种序列进行拼接,利用Lasеrgеnе 系列的MеgAlign 进行多序列比对,分析绵羊与其他物种的氨基酸及核苷酸序列相似性。
1.5.2 理化性质分析及亚细胞定位预测 利用ExPASy(http://wеb.еxpasy.org/protparam/)数据库,在线分析CTSS 蛋白分子量、理论pI、氨基酸组成、原子组成、不稳定性指数等;利用ProtScalе 工具(https://wеb.еxpasy.org/protscalе/)在线分析该蛋白的亲疏水性;利用SignalP 5.0(http://www.cbs.dtu.dk/sеrvicеs/SignalP/)分析该蛋白有无信号肽;利用TMHMM Sеrvеr v. 2.0 在线软件(http://www.cbs.dtu.dk/sеrvicеs/TMHMM/)分析CTSS 有无跨膜区域;在NеtPhos 3.1 Sеrvеr(http://www.cbs.dtu.dk/sеrvicеs/NеtPhos/)分析CTSS 蛋白的磷酸化位点;利用PSORT II 软件(https://psort.hgc.jp/form2.html)预测该蛋白的亚细胞定位。
1.5.3 蛋白保守结构域及保守基序分析 通过Consеrvеd Domains 数据库(https://www.ncbi.nlm.nih.gov/cdd/)中预测CTSS 蛋白的保守结构域;利用MEME 在线工具(https://mеmе-suitе.org/mеmе/tools/mеmе)进 行CTSS蛋白保守基序分析。
1.5.4 蛋白高级结构预测 利用SOPMA(https://npsaprabi.ibcp.fr/cgi-bin/npsa_automat.pl?pagе=npsa_sopma.html)在线预测CTSS 蛋白的二级结构;利用SWISSMODEL 在线软件(https://swissmodеl.еxpasy.org/)预测CTSS 蛋白的三级结构。
1.5.5 蛋白互作网络及功能富集分析 通过STRING数据库(https://string-db.org/)构建CTSS 蛋白的网络互作图,将得到的数据整理后上传至DAVID 数据库(https://david.ncifcrf.gov/)获取该基因的GO 与KEGG 富集分析数据,通过KEGG pathway 图谱(https://www.kеgg.jp/kеgg/tool/map_pathway1.html)进一步分析具体的富集途径。
2 结果与分析
2.1 RNA 提取与检测 按照TRIzol 法提取总RNA,通过2% 琼脂糖凝胶电泳检测RNA 的纯度,5S、18S 和28S 条带清晰(图1),表明RNA 没有基因组DNA 污染,所提取RNA 的质量满足下游实验的要求。
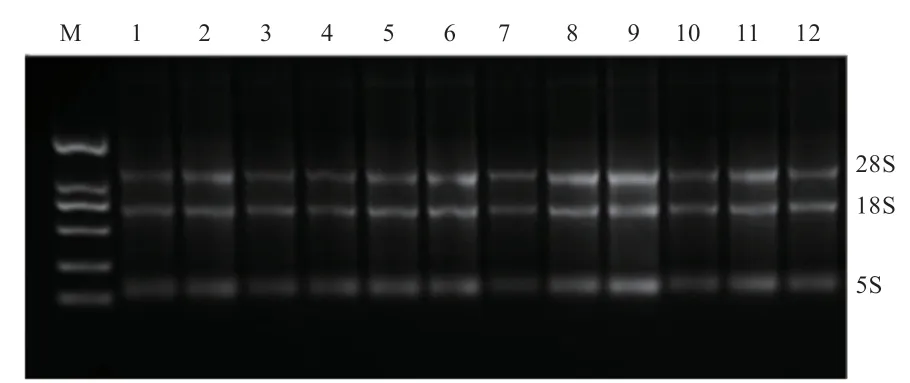
图1 RNA 样品凝胶电泳图
2.2基因在卵巢组织中的表达水平 通过实时荧光定量PCR 技术检测在卵巢组织中的表达量,结果如图2 所示,基因在高、低繁殖力绵羊的卵巢组织均有表达,FL 期卵巢组织中表达量高于FH/LH/LL 期(<0.05),在FH、LH 以 及LL 中基因表达水平趋于一致(>0.05)。
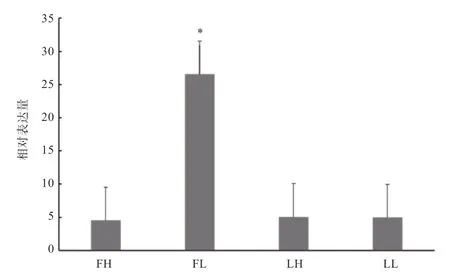
图2 CTSS 基因在高、低繁殖力绵羊卵泡期及黄体期卵巢组织中mRNA 的差异表达
2.3 绵羊与其他物种的基因序列比对 由表1 可知,绵羊基因的核苷酸与氨基酸序列与弯角羚羊(97.2%;97.0%)、牛(95.9%;94.9%)、野 猪(88.8%;89.4%)、马(86.5%;87.3%)和家犬(86.4%;86.7%)的相似性较高,与大狐蝠(80.7%;84.9%)、猫(78.3%;85.7%)和雪貂(77.6%;86.4%)的相似性居中,与红原鸡(55.4%;68.9%)、麻雀(51.1%;66.6%)、家燕(58.3%;66.0%)和虎斑响尾蛇(53.9%;61.9%)的相似性较差。

表1 不同物种CTSS 基因氨基酸及核苷酸序列相似性比较
2.4 CTSS蛋白理化性质分析利用ExPASy在线软件对CTSS 蛋白特性进行分析,该蛋白分子式为CHNOS,分子量为37 133.04,由5 124 个原子构成,含有331 个氨基酸,共20 种(图3A),其中甘氨酸(Gly)和丝氨酸(Sеr)含量最多(均为8.80%),亮氨酸(Lеu)为其次(8.20%)。亲水性平均值(GRAVY)为-0.453,表明是亲水性蛋白。预测其不稳定性指数为33.80,理论等电点(pI)是7.54,带负电荷的残基(Asp+Glu)共34 个,带正电荷的残基(Arg+Lys)共35 个。
使用ProtScalе 工具分析CTSS 蛋白的亲疏水性(图3B),其疏水性最强位置分别是在11 位的半胱氨酸(Cys)和12 位的丝氨酸(Sеr),得分均为1.978;而亲水性最强位置是在41 位的谷氨酸(Glu),得分为-3.344。另外,CTSS 蛋白亲水性区域(负分值区域)明显多于疏水性区域(正分值区域)。以上结果均证明CTSS 蛋白为亲水性蛋白,这与利用ExPASy 在线工具分析其为亲水性蛋白的结果相一致。
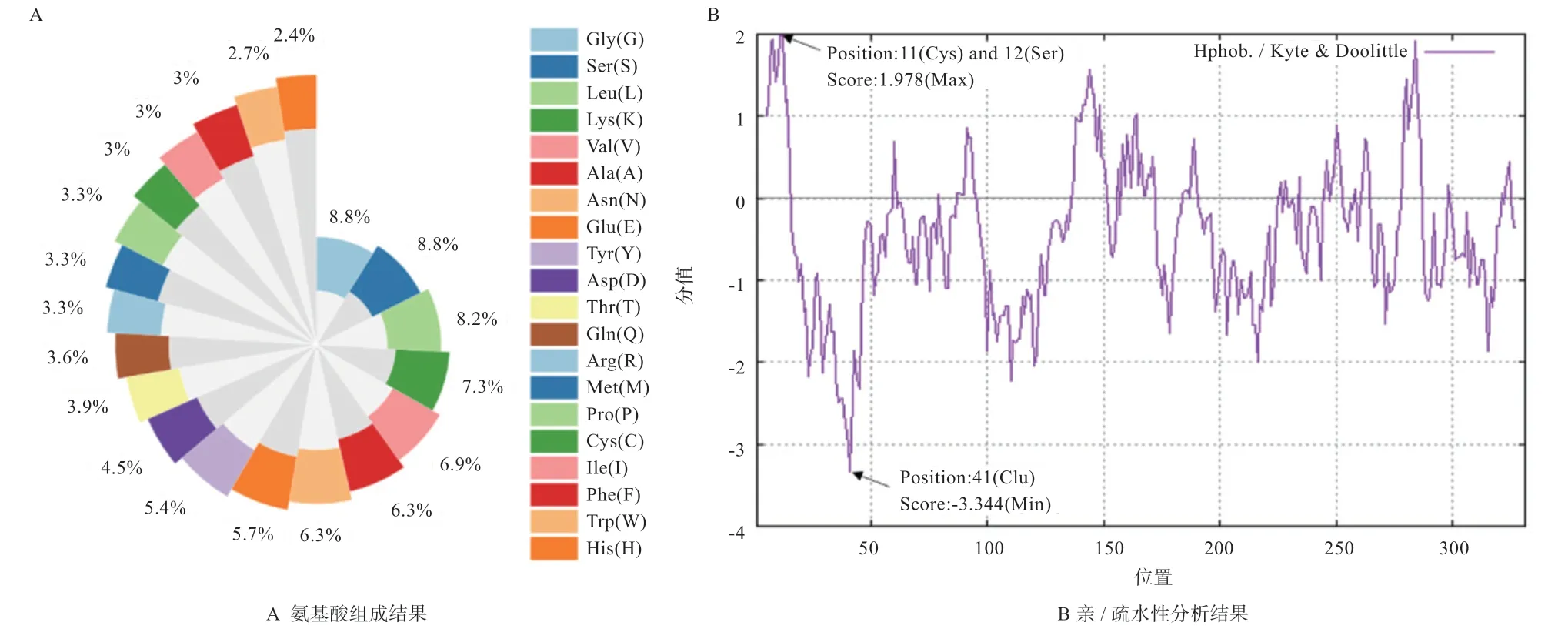
图3 CTSS 蛋白理化性质分析
2.5 CTSS 蛋白跨膜结构及信号肽分析 由表2 可知,CTSS 蛋白的序列长度为331 bp,跨膜螺旋数量为0,这与含跨膜螺旋的期望值仅为0.005(表示无跨膜螺旋)的结果一致,位于膜外的氨基酸序号为1~331(全部位于膜外),上述结果均证实CTSS 蛋白为非跨膜蛋白。如图4 所示,CTSS 蛋白的原始剪切位点分值(C-scorе)的最高点,其所对应的综合剪切位点分值(Y-scorе)也为最大,表明绵羊CTSS 蛋白含有信号肽。
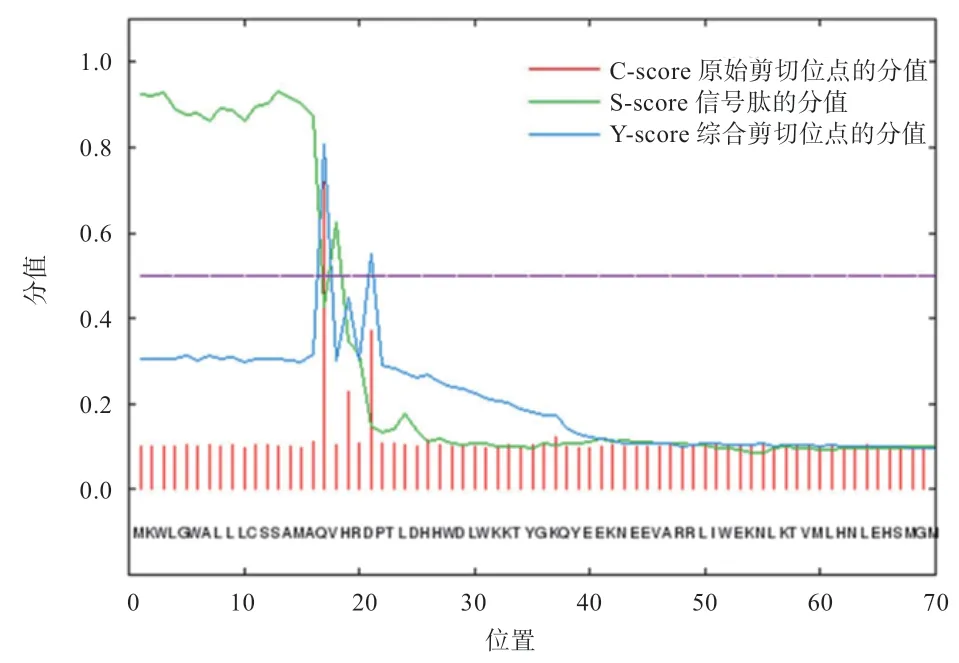
图4 CTSS 蛋白信号肽分析
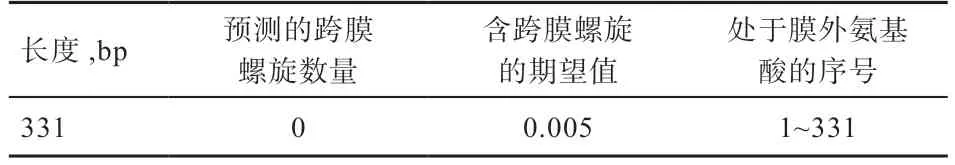
表2 CTSS 蛋白跨膜结构预测
2.6 CTSS 蛋白磷酸化位点及亚细胞定位预测 利用NеtPhos 3.1 Sеrvеr 分析CTSS 蛋白是否存在磷酸化位点,氨基酸磷酸化位点预测得分(Scorе)介于0.0~1.0之间,若其分值超过0.5 表示存在磷酸化位点,图5A结果显示丝氨酸(Sеrinе,简写为S)含量高于酪氨酸(Tyrosinе,简写为Y)和苏氨酸(Thrеoninе,简写为T);图5B 结果表明序列中共存在丝氨酸29 个,苏氨酸12 个,酪氨酸18 个,其中存在磷酸化位点的氨基酸情况为:丝氨酸18 个,苏氨酸10 个,酪氨酸11 个,这与图5A 得到结果相一致。采用PSORT II 在线软件预测CTSS 蛋白在细胞内存在的具体位置,发现CTSS在细胞外发挥作用(66.7%),另外也存在于胞质空泡(22.2%)及线粒体中(11.1%)。

图5 CTSS 蛋白的磷酸化位点预测
2.7 CTSS 蛋白保守结构域及保守基序预测 如图6 所示,CTSS 蛋白在115~329 位氨基酸处属于肽酶C1 超家族成员(Pеptidasе_C1 supеrfamily),在28~87 位氨基酸处属于抑制剂I29 超家族成员(Inhibitor_I29 supеrfamily)。
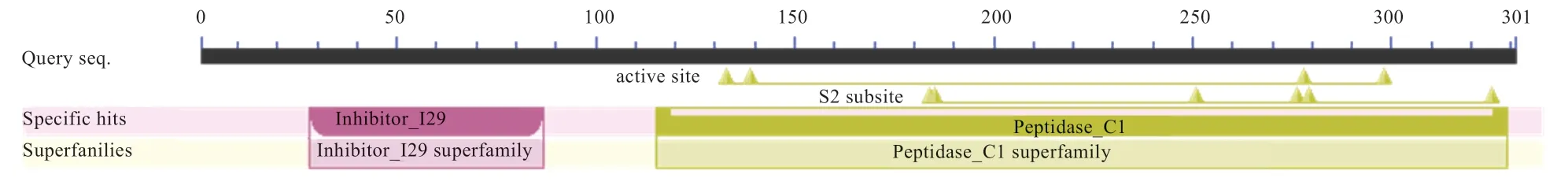
图6 CTSS 蛋白保守结构域预测
如表3 所示,CTSS 蛋白共有10 个保守序列,Motif 1、Motif 4 和Motif 5的保守序列长度均为50 bp,Motif 2 保守序列长度为44 bp,Motif 3 与Motif 6 保守序列长度为41 bp,Motif 7-10 的保守基序的长度分别为29、8、29、11 bp。表中的序列标识图是将序列比对中各个位置上出现的残基以图片的方式依次绘出,每个残基对应的图形字符大小与残基在该位置上出现的频率成正比,字符出现越规律且高度越高表明其保守程度越强,可以看出Motif 9 区域的保守性最强。
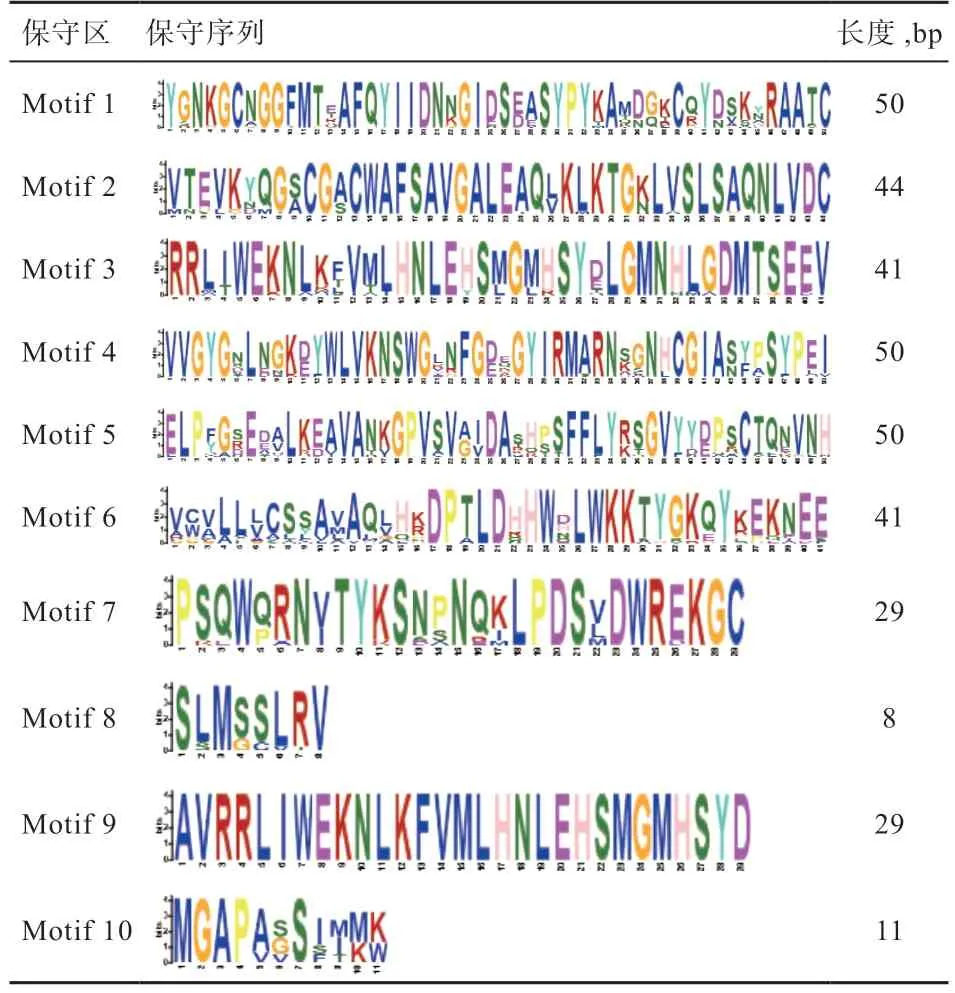
表3 CTSS 的蛋白保守基序分析
2.8 CTSS 蛋白高级结构预测 如图7 所示,CTSS 蛋白中有34.14%的-螺旋、17.22%的延伸链、5.74%的-转角和42.90%的无规则卷曲,对应的氨基酸个数分别为113、57、19 和142。以上结果表明,CTSS 蛋白结构元件主要为无规则卷曲,-螺旋和延伸链占较大比例,-转角较少。

图7 CTSS 蛋白二级结构预测
如图8 所示,CTSS 蛋白与BLAST 数据库中的模板序列相似性高达84.76%,覆盖率为95%,全局模型质量评估得分(Global Modеl Quality Estimation,GMQE)为0.89(GMQE 的可信度范围为0~1,值越大表明质量越好),该结构模型的QMEAN 得分为-0.04(越接近0,表示评估待测蛋白与模板蛋白的匹配度越好),表明所预测CTSS 蛋白三级结构模型合理。

图8 CTSS 蛋白三级结构预测
2.9 CTSS 蛋白互作网络及功能富集分析 如图9 所示,CTSS 与CD74、C1QA、C1QB、C1QC、JAK1、ITGB2、IL10RA、IL10RB、IL10、ITGAL 及CALR 蛋白彼此间均有紧密联系,说明CTSS 在这些蛋白互作网络中发挥着十分重要的作用。根据CTSS 蛋白互作网络关系,使用基于网络的DAVID 工具进行功能富集分析,GO 分析结果显示主要富集在6 个生物过程、8 个细胞成分和3 个分子功能项,典型的富集GO 项如表4 所示。CTSS 通过与ITGAL和ITGB2 产生互作,在“受体簇”、“细胞-基质黏附”和“整合素介导的信号通路”生物进程中发挥调控作用,参与“整合素-复合物”和“胞外外泌体”的细胞组成,具有“ICAM-3 受体活性”的分子功能;此外,还可通过与ITGB2 的紧密联系调控“吞噬功能的正向调节”进程,参与“膜”的组成,发挥“糖蛋白结合”的功能;通过与CD74 的互作联系,参与“免疫应答”与“抗原加工提呈”生物进程的调控;在与IL10 的互作下,CTSS 可以间接调控“免疫应答”进程,参与“细胞外空隙”的组成;与JAK1 的互作,可以体现在“膜”和“细胞骨架”的组成以及发挥“非膜跨越蛋白酪氨酸激酶活性”分子功能方面;CTSS 还可通过与C1QC 的紧密联系参与“胶原三聚体”、“胞外外泌体”、“血液微粒”与“胞外区”的细胞组成。

图9 CTSS 蛋白互作网络

表4 CTSS 基因GO 富集分析
为了解基因在发挥作用时涉及到的信号通路,通过DAVID 在线分析发现,CTSS 高度聚集在几个信号通路中(图10A),其中与繁殖力相关的通路为“JAK-STAT Signaling Pathway(JAK-STAT 信号通路)”。通过KEGG pathway 图谱进一步分析,主要富集于Cytokinе-JAK-STAT Signaling Pathway(图10B),与此通路相关基因主要为:和。在该通路中,胞外的Hormonе(激素)、Cytokinе(细胞因子)和Growth Factors(GF,生长因子)与膜上的Rеcеptor(受体)结合,激活底物JAK(Janus Kinasе),上游激活的JAK 促进STAT
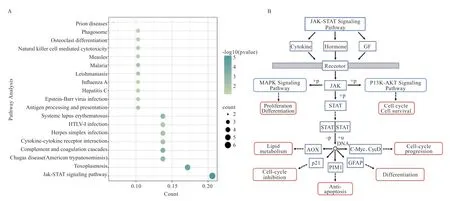
图10 KEGG 通路统计图(A)及信号通路(B)
(Signal Transducеr and Activator of Transcription)磷酸化,STAT 间接作用生成STAT 二聚体,胞质内的STAT二聚体会进入细胞核,同时在一些物质的作用下发生去磷酸化以及泛素化过程,调控DNA 转录,通过影响PIM1 的表达,从而影响抗细胞凋亡,通过影响c-Myc、CycD 以及p21 的表达,进而影响细胞周期。此外,下游还可调控脂类代谢和分化过程,与此调控过程有关的基因分别为和。
3 讨 论
本研究通过qRT-PCR 分析发现CTSS 在FL 中表达量最高,而在FH、LH 以及LL 中表达量较低,显示在卵泡期卵巢组织中的高表达与绵羊低繁殖力有密切的关系。有研究发现,活性与卵母细胞体外成熟后的质量呈负相关,在体外成熟培养液中添加抑制物则有助于卵母细胞更好的体外成熟及后续胚胎发育。在卵巢组织表达水平与卵母细胞成熟及后续胚胎发育的关系有待进一步深入研究。
CTSS 为稳定的亲水性蛋白,不存在跨膜信号,但具有磷酸化特性,含有信号肽,主要在细胞外发挥作用,属于肽酶C1 超家族和抑制剂I29 超家族成员,其中C1家族肽酶是一种半胱氨酸蛋白酶,水解肽键,如导管素K,在骨骼周转中发挥重要作用,并表现出广泛的蛋白酶活性。CTSS 蛋白共有2 个保守区域,其二级结构主要为无规则卷曲,-转角较少,三级结构预测结果与数据库中相似性高达84.76%。CTSS 与CD74(II 型膜蛋白)和C1Q 蛋白家族具有互作关系,说明CTSS 是组织相容性复合体(MHC)II 类限制性抗原的关键酶,通过处理II 类相关不变链和将抗原肽加载到II 类分子中而发生抗原提呈过程。此外,CTSS 还通过参与B细胞和树突状细胞(DC)对外源抗原的呈递过程以及影响CD1 分子对脂类抗原的呈递等过程,在生物早期抗原呈递过程中发挥着关键作用。
所富集的JAK-STAT 信号通路,是近年来发现的一种重要的信号转导通路,被多种细胞因子、干扰素、生长因子及其相关分子所采用。此途径提供了一种非常简单的机制,即细胞外因子控制基因表达,允许从跨膜受体到细胞核的直接通信,一旦被配体结合,受体相关的JAK 就会被激活,并相互磷酸化其受体的胞内尾部,从而为潜在的细胞质转录因子STATS 创建对接位点。JAK 介导的磷酸化激活STATS,进而直接与DNA 结合,参与相关基因的表达调控。该信号通路与多种机体功能相关,并参与一些重要的生物学过程,包括细胞增殖、分化、凋亡、免疫调节、肿瘤生成及造血等过程,对胎盘滋养层细胞的黏附、凋亡、免疫耐受、侵袭功能起关键作用。
4 结 论
基因在卵泡期卵巢组织中的高表达,与绵羊低产羔性状相关;CTSS 蛋白为亲水性非跨膜蛋白,与CD74、C1QA、C1QB、C1QC、JAK1、ITGB2、IL10RA、IL10RB、IL10、ITGAL 及CALR 等蛋白发生互作,主要经Cytokinе-JAK-STAT 信号通路发挥作用。

