OsSAMS1在水稻稻瘟病抗性中的功能研究
杨德卫 王 勋,** 郑星星 项信权 崔海涛 李生平,* 唐定中,*
在水稻稻瘟病抗性中的功能研究
杨德卫1,2,**王 勋1,**郑星星1项信权1崔海涛1李生平1,*唐定中1,*
1福建农林大学农学院 / 福建省作物设计育种重点实验室 / 福建农林大学植物免疫研究中心, 福建福州 350002;2福建省农业科学院水稻研究所; 福建福州 350018
稻瘟病是水稻最重要的病害之一, 对农业生产造成巨大的经济损失。研究表明, 水稻中S-腺苷-L-甲硫氨酸合成酶OsSAMS1参与了水稻衰老相关的进程, 我们实验室前期利用转录组测序分析发现,基因的表达水平受稻瘟病菌诱导后明显提高。然而,是否参与水稻的免疫反应, 尚未明确。基于此, 本研究选取野生型ZH11为背景材料, 通过构建基因敲除突变体来探究该基因在水稻抗病中的功能。结果表明,主要在水稻叶片中表达; 且其表达明显受稻瘟病菌侵染所诱导。亚细胞定位结果显示, OsSAMS1在细胞膜、细胞质和细胞核内均有表达。通过接种稻瘟病菌发现, 与对照相比, 2个等位敲除突变体和均表现为更加感病, 且体内病程相关基因的表达也明显更低, 同时突变体中乙烯合成相关基因的表达也受到明显抑制。综上所述,参与了水稻的免疫反应, 且正调控水稻稻瘟病的抗性。本研究为深入揭示在稻瘟病免疫反应的分子机理奠定了基础, 并为稻瘟病抗病育种研究提供了基因资源。
水稻; 稻瘟病;基因; 乙烯; 功能研究
水稻是世界上主要的粮食作物之一, 由稻瘟病菌引起的稻瘟病是一种世界性病害[1], 近年来呈现不断上升的趋势。稻瘟病不仅引起水稻大幅减产10%~35%[2], 严重时甚至颗粒无收[3]。为了减少稻瘟病对水稻产量和品质造成的危害, 研究者利用不同的方法, 已从水稻中克隆了、、、、、和等近30个稻瘟病抗性(,)基因[4-9], 这些基因在水稻抗稻瘟病育种中发挥了极其重要的作用。这些基因常编码NLR (Nucleotide-binding domain and Leucine-rich Repeat)蛋白, 其介导的免疫防御体系, 被称为病原菌效应因子引发的ETI (effector-triggered immunity)反应[10-11]。在植物中, 除了由ETI反应引起的防御体系外, 还存在另外一层防御体系, 即PTI (PAMP- triggered immunity) 反应, 是由细胞表面的模式识别受体(PRRs, pattern recognition receptors)识别病原菌保守成分PAMPs/MAMPs (pathogen-associated molecular patterns or microbe-associated molecular patterns), 从而触发的植物免疫反应[11-12]。植物中的抗病反应过程十分复杂, 相较于ETI, PTI反应具有更好的广谱性和持久性[13]。最近研究发现, PTI和ETI反应可以相互促进, 植物免疫反应的全面激活需要PTI和ETI反应的协同作用[14-15]。
在水稻中, 研究者利用不同的方法, 已鉴定了70多个稻瘟病抗性相关的调控因子[16], 通过深入研究这些基因的功能, 初步形成了免疫反应的信号通路。例如, 水稻免疫受体OsCEBiP能特异识别并结合质外体中的PAMP组分几丁质, 并发生同源二聚化, 随后招募共受体OsCERK1 (CHITIN ELICITOR RECEPTOR KINASE1)形成异源三聚体[17]。当OsCERK1被激活后, 能直接磷酸化细胞质类受体激酶OsRLCK185, 随后通过连续激活由OsMAPKKKε/ OsMAPKKK18、OsMKK4/5和OsMAPK3/6组成的级联反应, 最终将抗病信号传递至下游, 引发水稻的PTI防御反应[18-20]。由于稻瘟病菌在致病性方面的多变性, 使得传统的育种方法和化学防治都很难控制这种病害[21]。而近年来, RNA-seq技术已经得到了广泛的应用, 为研究植物与病原菌之间的相互作用提供了一个强有力的工具[22]。研究者利用微阵列、RNA-seq的方法, 鉴定获得更多的稻瘟病抗性相关基因, 并深入研究其功能, 这些将为深入揭示水稻抗病反应的分子遗传机理以及水稻稻瘟病抗病新品种的选育奠定基础。
S-腺苷-L-甲硫氨酸合成酶(SAMS), 也被称为蛋氨酸腺苷转移酶(MAT), 研究表明SAMS参与调控植物DNA和组蛋白甲基化修饰, 进而调控植物的发育与衰老等[23-24]。如水稻F-Box蛋白OsFBK12通过靶向降解OsSAMS1参与水稻衰老相关的进程[25]。我们实验室前期利用稻瘟病菌Guy11诱导感病品种日本晴后, 通过转录组测序分析发现,基因被诱导后表达显著提高。但基因是否参与水稻的免疫反应, 尚未明确。鉴于此, 本研究选取野生型ZH11为背景材料, 通过构建基因敲除突变体来探究该基因在水稻抗病中的功能, 为深入揭示参与免疫反应的分子机理奠定基础, 并为稻瘟病抗病育种研究提供优异的基因资源。
1 材料与方法
1.1 供试材料
野生型中花11 (Zhonghua 11, ZH11)为福建农林大学植物免疫中心保存, 突变体和是本实验室利用基因编辑技术在野生型ZH11背景下敲除而获得的2个等位纯合突变体。
1.2 室内喷雾接菌
室内稻瘟病抗性鉴定, 参照Yang等[4]方法接菌, 并进行适当修改。将带有Guy11孢子的滤纸片放置到完全培养基上, 于28℃黑暗培养1周后, 转接到米糠培养基上, 再培养至菌丝长满米糠培养基, 刮去菌丝, 于28℃光照培养箱中进行产孢。5~7 d后用含0.2% Tween 20的水将孢子进行悬浮并调整浓度至1×105个 mL–1, 均匀地喷雾到生长15 d左右的水稻叶片表面, 将喷菌后的幼苗放置在26℃黑暗培养24 h, 然后放置于长日照接菌室, 并保持环境高湿, 3~5 d后, 统计发病表型。
1.3 基因表达分析
水稻总RNA提取按照提取试剂盒(TRIzol, Invitrogen, USA)说明书的要求与步骤进行, 用反转录试剂盒(宝生物工程(大连)有限公司)合成总cDNA。所有的qRT-PCR实验均使用染料法实时荧光定量试剂盒(宝生物工程(大连)有限公司), 并用CFX Connect实时荧光定量PCR仪(Bio-Rad)进行检测与分析。qRT-PCR分析按照Bustin等[26]描述的步骤进行, 设置3个独立的生物重复; 接菌后水稻叶片真菌生物量的变化, 参考Park等[27]方法进行分析。植物病程相关基因(,)为、和, 植物乙烯生物合成相关基因为、、和, 引物序列见表1。

表1 研究OsSAMS1所用引物信息
1.4 OsSAMS1的亚细胞定位
扩增OsSAMS1基因的cDNA全长序列, 用无缝克隆(infusion)技术, 将OsSAMS1全长cDNA序列插入到pCMABIA2300-35S-eGFP载体的R I和LI两个酶切位点之间, 完成35S-OsSAMS1-eGFP载体的构建。然后将构建的载体转化到农杆菌菌株GV3101中, 并注射到烟草叶片中。注射3 d后, 用Zeiss 880共聚焦显微镜观察并拍摄GFP信号。
1.5 农艺性状调查分析
于2019年10月, 供试材料种植于福建农林大学大型人工气候室。敲除纯合突变体ossams1-1、ossams1-2和野生型ZH11分别种植1个小区, 每个小区种植3行, 每行种20株, 每个小区设置3个重复, 常规管理。水稻株高、穗长和分蘖数等主要农艺性状, 参考Yang等[28]方法进行调查和分析。
1.6 系统发育树分析
以OsSAMS1 (基因号为)的蛋白序列为参考序列, 利用BLAST分析在NCBI (https://www.ncbi.nlm.nih.gov/)、RGAP (http://rice.plantbiology.msu.edu/index.shtml)和TAIR (http://www.arabidopsis.org/)蛋白数据库中对OsSAMS1进行同源蛋白搜索, 获得水稻中2个同源蛋白LOC_ 01g18860和LOC_01g22010、拟南芥中2个同源蛋白AtSAM1和AtSAM2、以及玉米、高粱、黍稷和粟中的SAMS1蛋白, 然后利用MEGA7.0软件进行进化树分析。
2 结果与分析
2.1 稻瘟病菌诱导后OsSAMS1的表达分析
我们实验室前期对日本晴在0、12、24和36 h不同时间点进行稻瘟病菌Guy11诱导处理, 并进行转录组测序和分析, 结果表明, OsSAMS1被稻瘟病菌侵染后表达量显著提高(图1-A)。为了验证测序结果的准确性, 我们利用稻瘟病菌Guy11对生长2周左右的水稻品种ZH11进行喷雾接菌, 并以水处理作为对照。在接菌后的0、12、24、48和72 h分别进行取样, 定量测定不同时间点水稻OsSAMS1基因的表达量。结果表明, 相比于水处理对照, 在接菌后12 h, 水稻OsSAMS1的表达量明显上调; 在接菌后24 h, OsSAMS1表达量达到最高, 且差异更显著; 在接菌48 h后, 虽然OsSAMS1的表达量开始下降, 但是仍然比对照高(图1-B)。上述结果表明OsSAMS1很可能参了水稻的免疫反应。
2.2 OsSAMS1的时空表达模式分析
为了确定在水稻不同组织中的时空表达模式, 在野生型ZH11中, 取不同发育阶段的组织样品, 利用qRT-PCR技术分析基因在不同发育阶段的表达水平(检测引物见表1)。结果表明, 在生长2周、4周和6周等水稻愈伤组织, 以及水稻抽穗期、成熟期的不同组织中均有表达, 但是在各个时期的叶片中表达量最高(图2)。
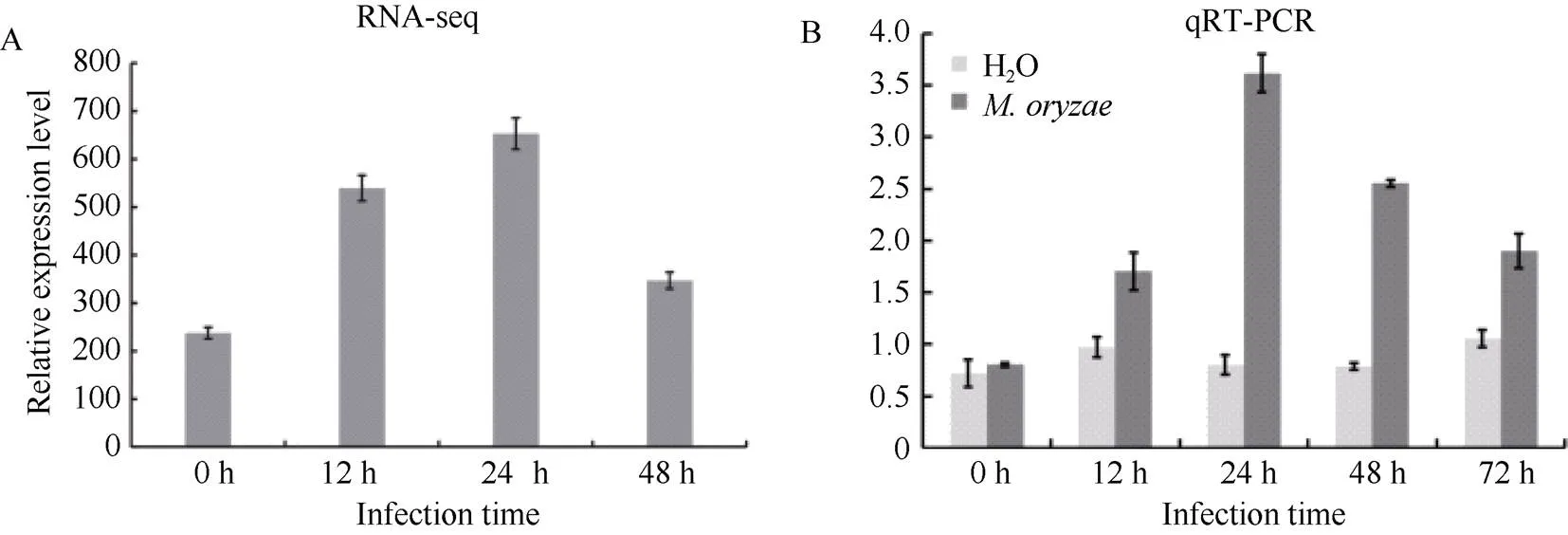
图1 稻瘟病菌Guy11侵染后OsSAMS1的表达变化
A: 对稻瘟病菌侵染前和侵染后12、24和36 h后的样品进行转录组测序分析, 发现明显受稻瘟病菌侵染而诱导表达; B: 对稻瘟病菌侵染前和侵染后12、24、48和72 h后的样品进行qRT-PCR分析, 发现与水处理对照相比, 稻瘟病菌侵染后的表达水平明显升高, 侵染24 h后达到最高。
A:transcriptome sequencing analysis of rice samples before and 12, 24, and 36 hours afterinfection showed that the relative expression level ofwas induced byinfection; B: qRT-PCR analysis of the rice samples before and 12, 24, 48, and 72 hours afterinfection showed that the relative expression level ofwas increased and reached the highest level at 24 hours after infection compared to the control.
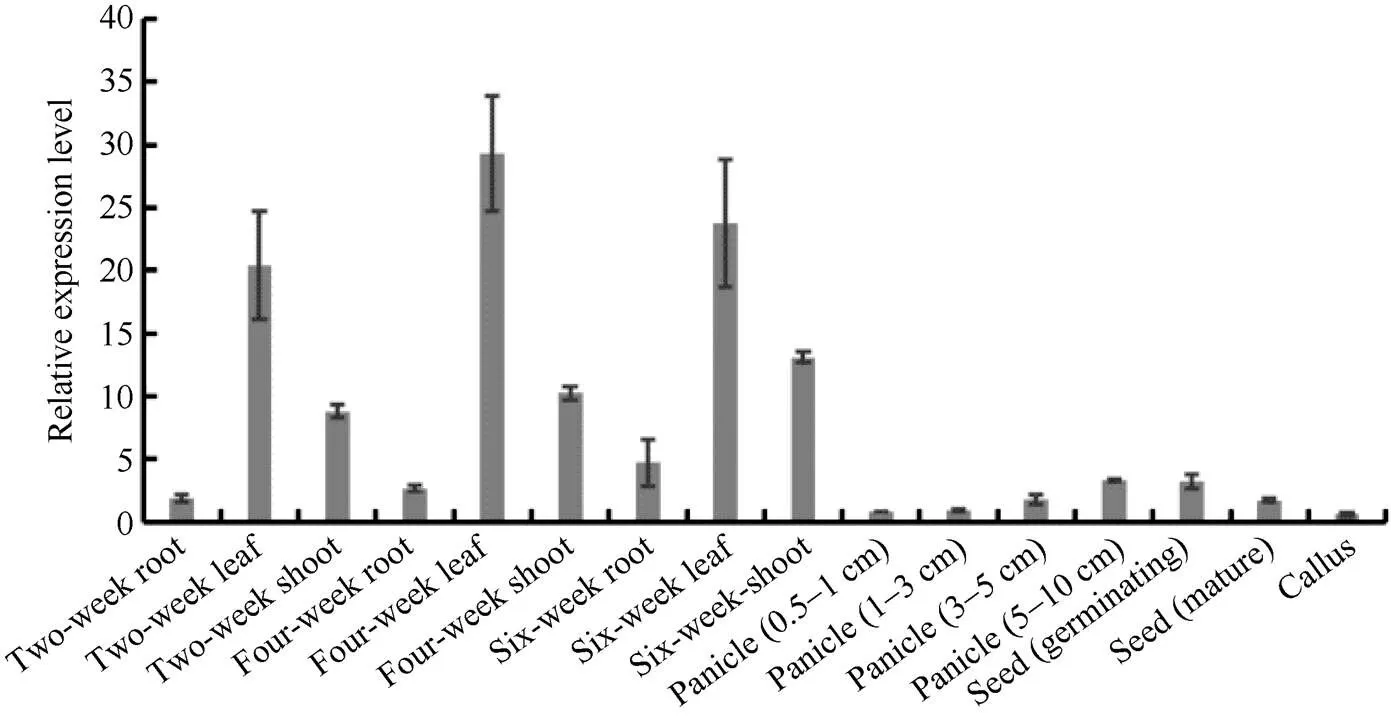
图2 OsSAMS1的时空表达模式
利用qRT-PCR对生长2周、4周和6周水稻的根、茎、叶, 0.5~1.0 cm、1~3 cm、3~5 cm和5~10 cm的小穗, 萌发和成熟的种子及愈伤组织中的表达水平进行分析。误差线表示从3个独立的样本获得数值的标准偏差。
The relative expression levels ofin roots, stems, and leaves of two-week old, four-week old and six-week old seedlings, spikelets of 0.5–1.0 cm, 1–3 cm, 3–5 cm, and 5–10 cm length, germinating and mature seeds and callus were analyzed by qRT-PCR.The error bar represents the standard deviation (SD) of the value from three independent biological samples.
2.3 ossams1突变体的获得与农艺性状分析
2.3.1突变体的基因型鉴定 在前期研究发现,基因在受到稻瘟病菌侵染后表达水平上调。为了进一步验证在水稻抗病中的功能, 本研究利用CRISPR/Cas9技术对水稻ZH11中的基因进行了双靶点敲除。在基因中选择了2个不同的20 nt序列作为Cas9切割的靶位点, 获得敲除株系后, 利用检测引物对靶位点进行测序分析(表1和图3)。结果表明, 敲除系靶标位点有4个碱基的缺失, 敲除系靶标位点有1个碱基的插入(图3)。
2.3.2突变体和野生型农艺性状分析
为了明确功能缺失后对水稻生长发育造成的影响, 我们通过对灌浆期2个等位突变体和及野生型ZH11进行拍照观察(图4), 并对成熟期的、和野生型ZH11农艺性状进行调查, 结果表明ossams1-1和与ZH11相比, 在结实率、粒长、粒宽和千粒重等性状没有明显差异, 而在株高、穗长、有效穗和每穗颖花数等性状具有明显差异(表2)。
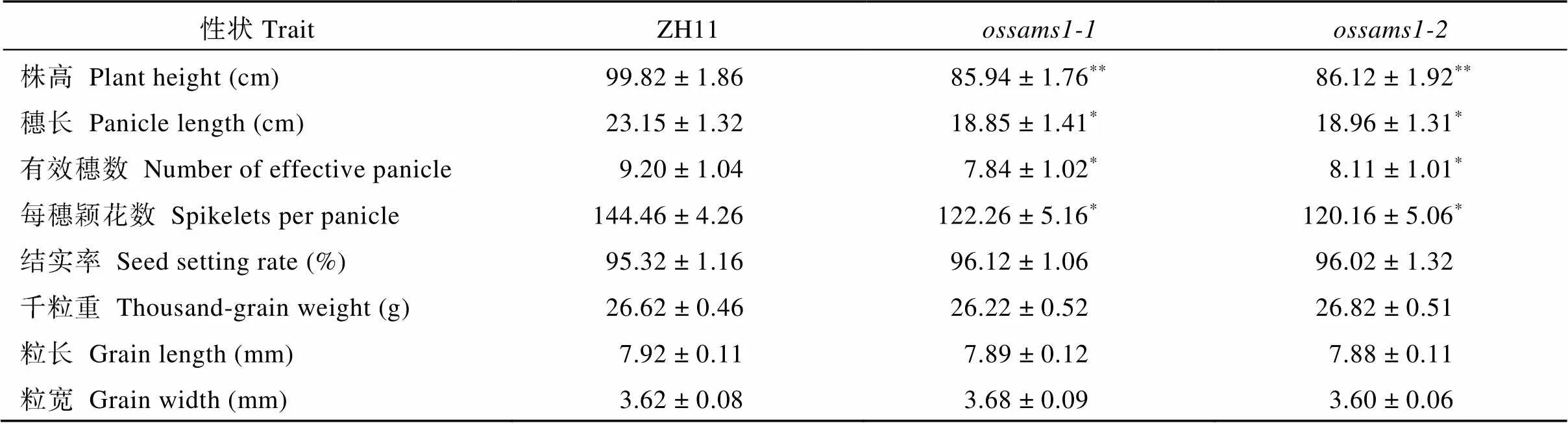
表2 野生型与2个敲除系在株高、穗长和千粒重等主要农艺性状比较
*:<0.05;**:<0.01.
图3(A)和(B)敲除突变体的鉴定
Fig.3 Determination of(A)and(B) knockout transgenic lines

图4 ZH11、ossams1-1和ossams1-2的生长发育表型
对正常生长灌浆期的水稻进行表型观察, 标尺为10 cm。
The phenotypes of ZH11,,andat filling stage were observed; bar: 10 cm.
2.4 OsSAMS1在水稻免疫反应中的功能分析
2.4.1对稻瘟病菌表现为更加感病 利用稻瘟病菌菌株Guy11对2个等位突变体(ossams1-1和ossams1-2)和野生型ZH11进行喷雾接菌, 3 d后调查发病情况。结果表明, ossams1突变体比野生型ZH11更加感病(图5-A)。为了进一步证实上述结果, 我们再次对ossams1突变体和ZH11进行喷雾接菌, 在接菌3 d后, 检测接菌后叶片上的真菌生物量, 将均匀感染的叶片等量混合后, 提取总DNA, 并进行qRT-PCR分析。结果表明, ossams1突变体叶片表面的真菌生物量均明显高于野生型ZH11 (图5-B)。综上表明, OsSAMS1正调控水稻的抗病反应。
2.4.2 稻瘟病菌侵染后中病程相关基因的表达分析 一般情况下, 植物病程相关基因的表达在植物受到病原菌侵染后经常被激活。为了进一步分析基因能否通过激活细胞内基因的表达来调控稻瘟病抗性, 我们对、和野生型ZH11进行接种稻瘟病菌Guy11, 利用qRT-PCR对接菌0、24、48和72 h样品中的、和等基因的表达模式变化进行分析。结果表明, 在接种Guy11后, 野生型ZH11和突变体均能激活、和基因的表达, 但ossams1突变体在接菌48 h时,、和基因的表达水平明显低于野生型ZH11, 而在72 h时, 差异水平达到了极显著水平(图6)。上述结果进一步证明,参与了水稻抗病反应, 并且正调控水稻稻瘟病抗性。
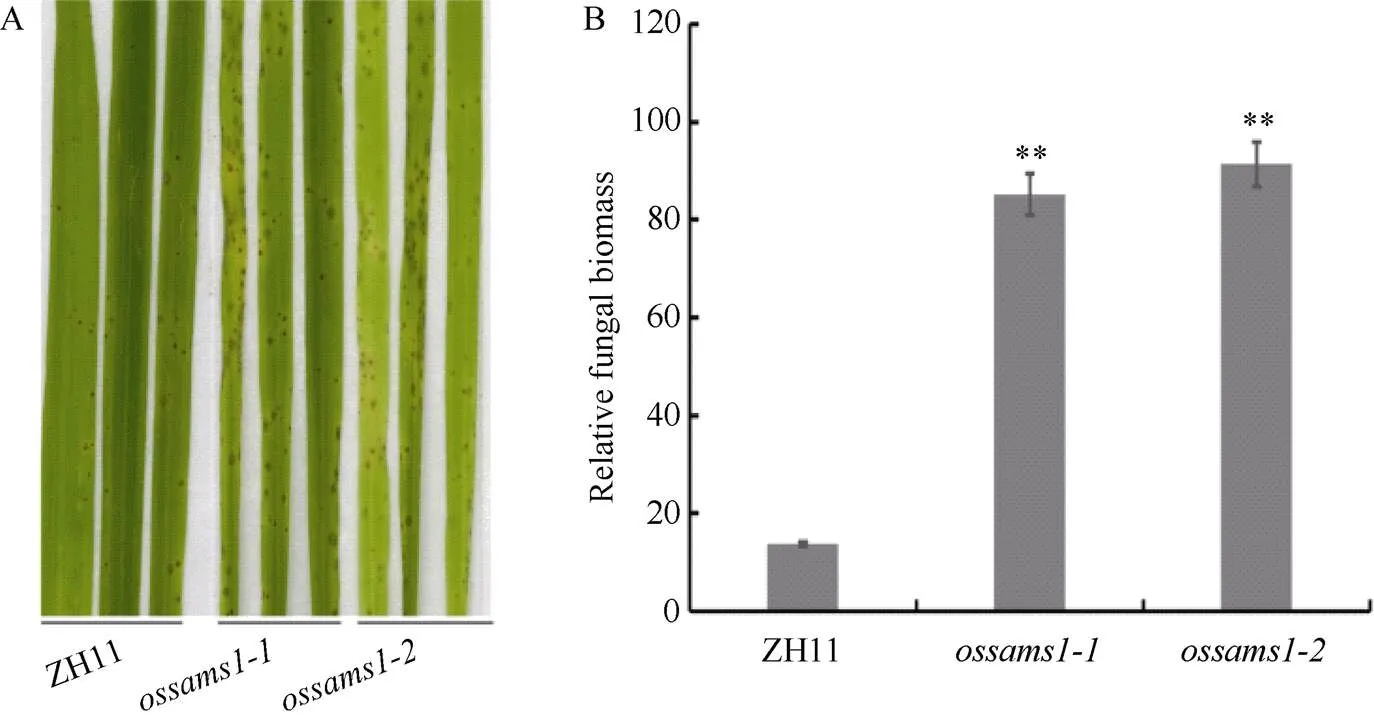
图5 ossams1-1和ossams1-2与对照ZH11相比更感稻瘟病菌
A: 喷雾接种Guy11后,和植株比ZH11植株产生更多的病斑; B: 发病叶片中的真菌生物量分析, 星号代表显著差异(*:< 0.05, **:< 0.01, 采用检验)。
A: the plants ofandproduced more diseased lesions compared to the ZH11 plants after inoculation with Guy11 using the spraying method; B: the analysis of the fungal biomass in the diseased leaves.*:< 0.05, **:< 0.01, Student’s-test.
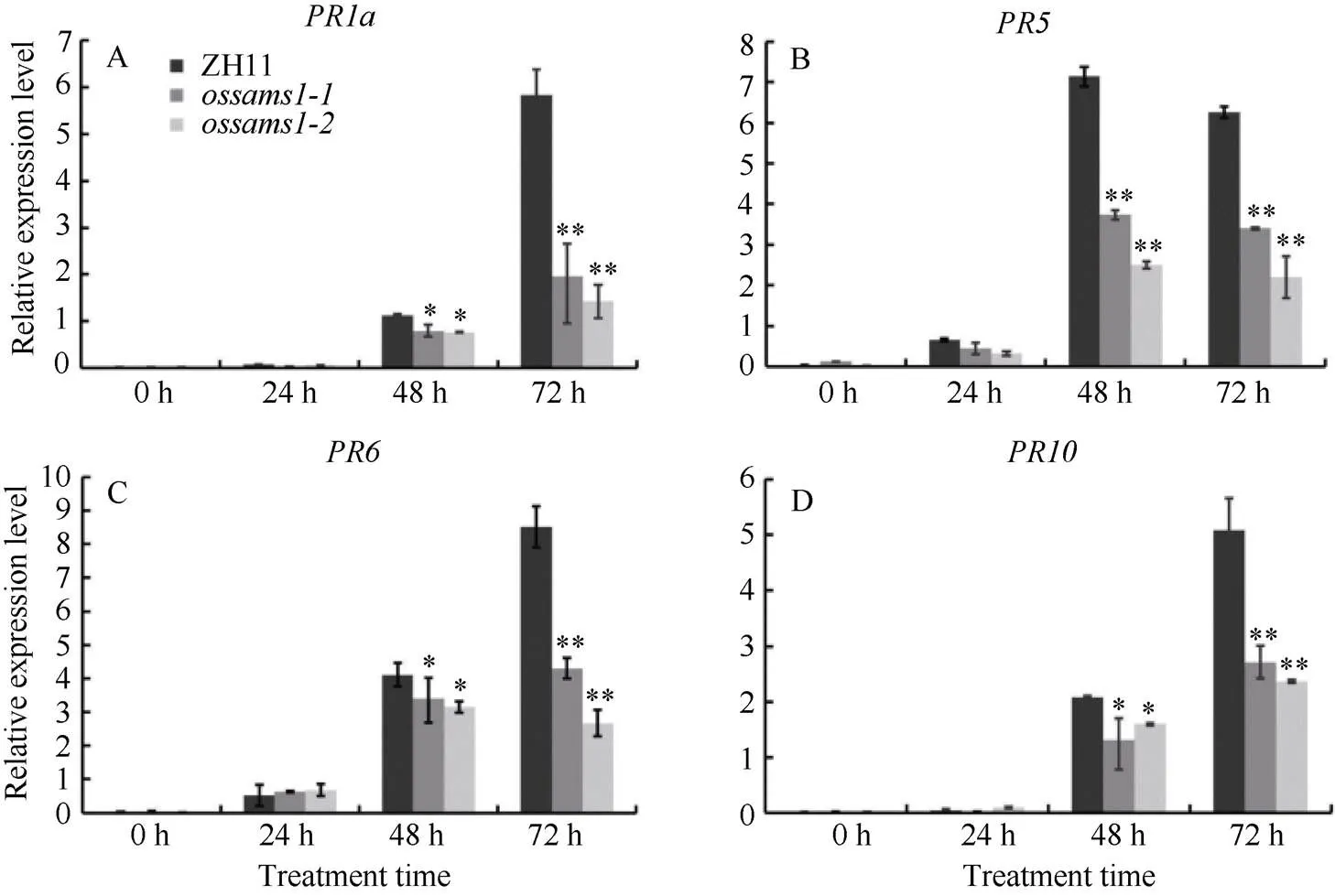
图6 ossams1-1、ossams1-2和ZH11中病程相关基因的表达分析
图中A、B、C、D分别表示利用qRT-PCR检测接种稻瘟病菌Guy11后,、和ZH11中病程基因、和转录本的积累情况(*:< 0.05; **:< 0.01).
A, B, C and D represent the expression changes of,,, andin,and ZH11after inoculation with Guy11.Asterisks represent significant differences relative to wild-type ZH11 plants (*:< 0.05, **:< 0.01, Student’s-test).
2.5 接菌后ossams1突变体中乙烯合成相关基因表达分析
研究表明与乙烯的生物合成途径密切相关[25]。而乙烯是植物免疫信号传递链中非常重要的一类防御激素[29-30]。那么,是否通过乙烯相关途径参与植物的免疫反应呢?基于此, 我们分析了突变体和野生型ZH11在接菌前后ACC合成酶(ACC synthase, ACS)基因的表达情况。ACS是植物乙烯生物合成途径中重要的限速酶, 水稻ACS基因属于多基因型组成的家族[25]。结果表明, 与未处理对照相比, 突变体和野生型ZH11中乙烯合成相关基因、、和的表达水平, 在接菌后均受到诱导表达, 在48 h时达到最高, 之后呈现降低趋势(图7)。然而, 它们在突变体中的表达水平均显著低于在野生型ZH11中的表达水平。这些结果表明,可能通过调控乙烯合成相关基因如等的表达, 从而影响水稻的稻瘟病抗性(图5)。
2.6 OsSAMS1的亚细胞定位
OsSAMS1能够正调控水稻稻瘟病抗性, 但它如何发挥抗病功能呢?我们通过构建35S∶OsSAMS1∶eGFP载体, 并转化农杆菌菌株GV3101,注射烟草2 d后, 利用激光共聚焦显微镜技术, 在烟草叶片中观察OsSAMS1的细胞定位情况。结果表明, OsSAMS1在细胞内的定位不特异, 在细胞膜、细胞质和细胞核内都有表达(图8), 与拟南芥OsSMAS1的同源蛋白AtSAM1和AtSAM2定位结果相似[31], 这与SAMS类蛋白能够通过与不同的蛋白在不同的细胞场所发生相互作用, 从而发挥不同的生物功能相一致[25,31-32]。
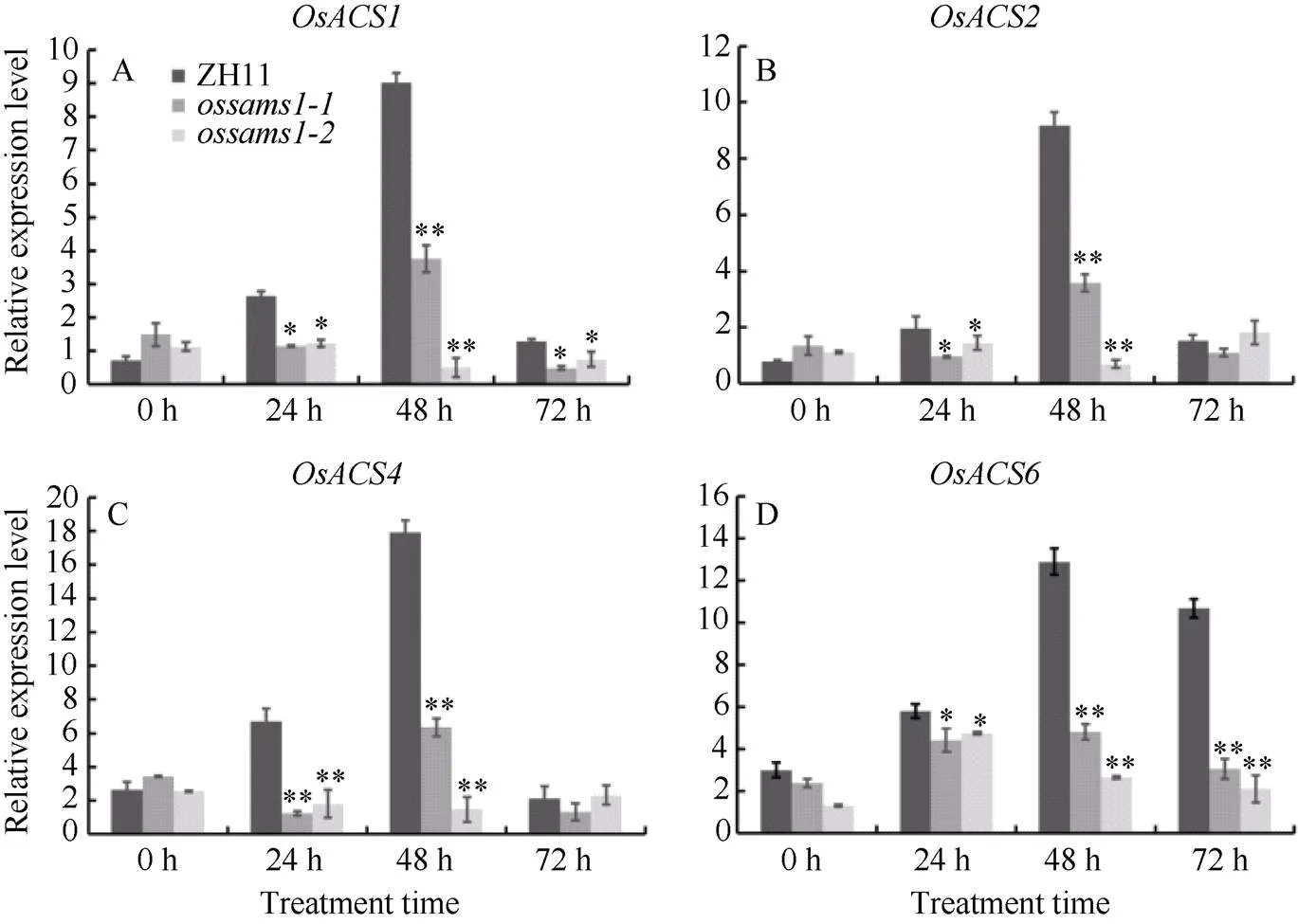
图7 接菌前后ossams1突变体与野生型ZH11中乙烯合成相关基因的表达分析
Fig 7 Relative expression patterns of ethylene synthesis related genes inmutants and the wild-type ZH11 after inoculation with
图中A、B、C、D分别代表、、和在稻瘟病菌诱导前后突变体与野生型ZH11中的表达变化情况(*:< 0.05, **:< 0.01, 采用检验)。
A, B, C, and D represent the expression changes of,,and, inmutants and the wild-type ZH11 after inoculation withrespectively(*:< 0.05, **:< 0.01, Student’s-test).
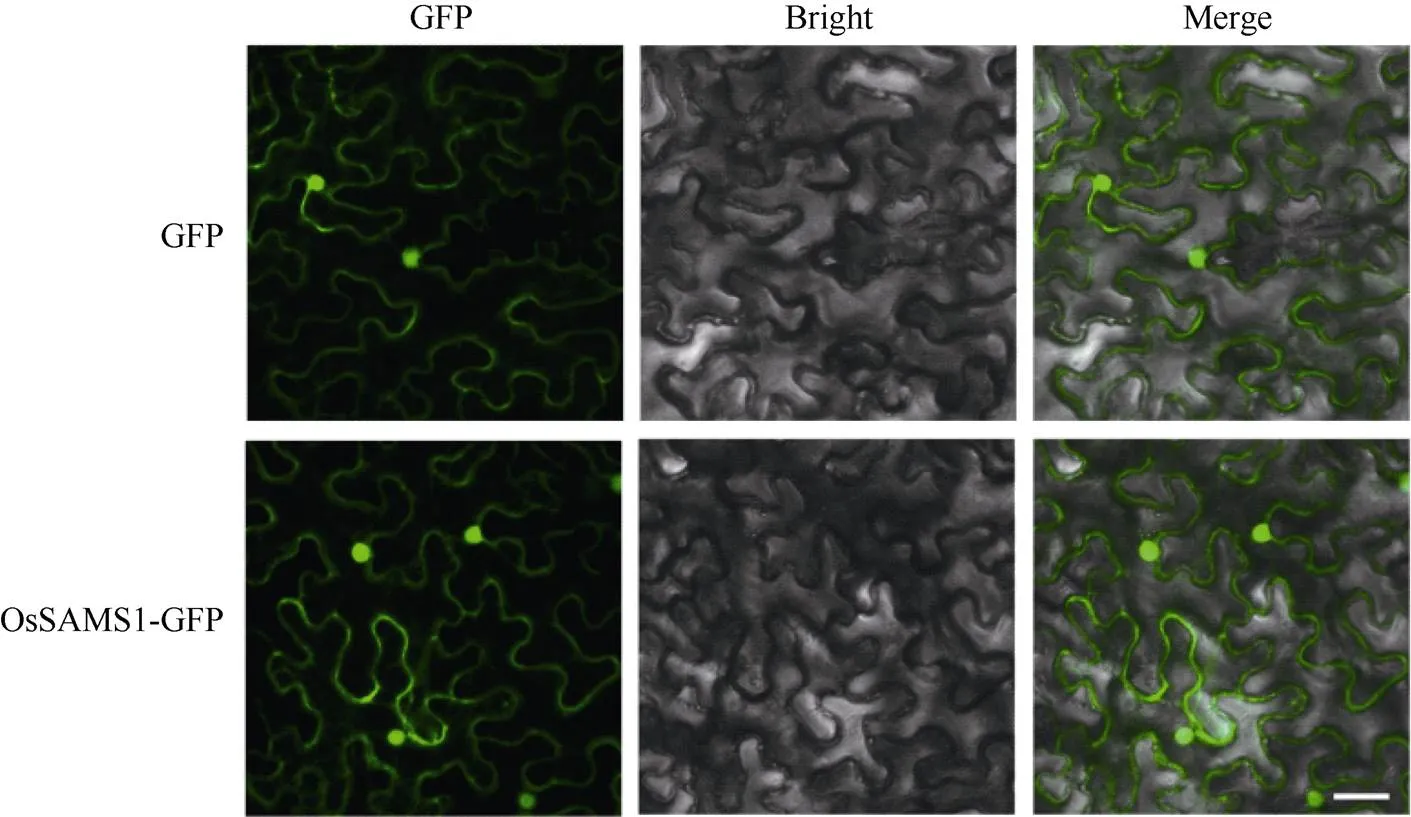
图8 OsSAMS1的亚细胞定位
利用激光共聚焦显微镜观察OsSAMS1-GFP在烟草细胞中的表达部位, 表明OsSAMS1-GFP在细胞核、细胞质和细胞膜内均有表达, 标尺为20 μm。
The expression of OsSAMS1-GFP incells was observed by laser confocal microscopy.The results showed that OsSAMS1-GFP expressed in the nucleus, cytoplasm and cell membrane; bar: 20 μm.
2.7 OsSAMS1在植物中的同源进化分析
为了对OsSAMS1在不同植物中的同源性进行分析, 我们以水稻OsSAMS1的氨基酸序列为参考序列, 通过BLAST在水稻基因组中获得和基因编码的2个同源蛋白, 在拟南芥中获得2个同源蛋白AtSAM1和AtSAM2, 在玉米中获得一个同源蛋白ZmSAMS1, 在高粱中获得一个同源蛋白SbSAMS1, 在黍稷中获得一个同源蛋白PmSAMS1, 在粟中获得一个同源蛋白SiSAMS1 (图9), 系统发育分析表明, OsSAMS1及其同源蛋白在上述高等植物中是非常保守的。
图9 OsSAMS1在植物中的进化树分析
Fig.9 Phylogenetic analysis of OsSAMS1 in plants
利用BLAST分析在NCBI、RGAP和TAIR蛋白数据库中对OsSAMS1进行同源蛋白搜索, 获得获得和基因编码的2个同源蛋白, 拟南芥中2个同源蛋白AtSAM1和AtSAM2, 以及玉米、高粱、黍稷和粟中的SAMS1蛋白, 然后利用MEGA7.0软件进行进化树分析。
Blast analysis was used to search for the homologous proteins of OsSAMS1 in NCBI, RGAP, and TAIR protein database, and two homologous proteins encoded byandin rice, two homologous proteins AtSAM1 and AtSAM2 in, and the SAMS1 protein in maize, sorghum, panicum, and setaria were obtained.Then phylogenetic analysis was performed with MEGA7.0 software.
3 讨论
3.1 OsSAMS1正调控稻瘟病抗性
Mao等[31]发现, 水稻OsSAMS1通过参与水稻DNA和组蛋白甲基化改变来调控水稻种子的萌发, 进一步研究发现F-box蛋白OsFBK12通过与OSK1互作参与了26S蛋白酶途径, 并识别底物OsSAMS1促其降解[25]。本研究利用qRT-PCR技术, 进一步确定了被稻瘟病菌诱导后表达显著提高(图1-B);并对敲除突变体、的稻瘟病抗性进行鉴定和分析, 结果表明,敲除突变体比野生型更加感病(图5); 同时, 对突变体和接菌后PR基因的表达进行分析, 结果表明,、和表达水平明显低于野生型ZH11 (图6)。上述结果表明, OsSAMS1除了参与水稻种子的萌发, 还参与了水稻的免疫反应, 并且正调控水稻稻瘟病抗性。
3.2 OsSAMS1基因与乙烯表达的相关
研究者前期利用RNA干扰技术, 对水稻基因进行干扰, 结果表明,-RNAi株系中乙烯的表达显著降低[25]。我们分析发现,在水稻中还存在和两个同源基因(图9), 同时由于RNA干扰技术的局限性,与这2个同源是否存在功能冗余还不能确定。本研究利用CRISPR/Cas9技术对基因进行特异性敲除, 结果表明, 接菌后敲除系中与乙烯合成相关基因、、和的表达明显被抑制, 表达量均显著降低(图7), 进一步确定了OsSAMS1正向参与水稻中乙烯的表达。进化树分析表明OsSAMS1在拟南芥中有2个同源蛋白, 分别是AtSAM1 (SAM1)和AtSAM2 (SAM2) (图9)。Li等[33]发现, 拟南芥受体激酶FER能够与SAM1和SAM2互作, 从而减少SAM合成, 降低了植物中乙烯的表达。这些发现说明,基因家族广泛参与了植物乙烯表达的调控。
3.3 OsSAMS1基因参与水稻稻瘟病抗性的初步探讨
本研究表明, 在稻瘟病菌诱导条件下,敲除系中乙烯合成相关基因的表达受到明显抑制, 同时敲除系的稻瘟病抗性明显降低。近年来, 研究发现乙烯参与植物的抗病反应, 植物在感知到病原菌PAMP因子之后, 体内能快速合成乙烯[34], 同时乙烯还能与内源多肽联合起作用, 将植物PTI反应信号放大, 引起植物持久的抗性[35]。在水稻中, 乙烯同样被证明在抗病方面发挥着十分重要的作用[29,36-38], 如将编码乙烯合成的关键酶基因过表达后, 水稻稻瘟病抗性明显增强[36], 水稻中乙烯含量的增加能提高稻瘟病抗性[37], 将乙烯合成基因的中心传递者沉默后, 稻瘟病抗性明显降低[38]。以上结果表明, 乙烯在调控植物抗病尤其在调控水稻稻瘟病抗性方面具有非常重要的作用。因此, 我们推测本研究中突变体稻瘟病抗性的减弱, 可能与功能丧失, 并导致植株体内乙烯合成相关基因的表达降低有关。
3.4 SAMS参与植物多种生物学功能的调控
在番茄中过量表达 SlSAMS1 可以增加碱胁迫的耐受性[39]。在拟南芥中, 存在4个成员蛋白MAT1 (SAM1) ~ MAT4 (SAM4), 其中SAM1和SAM2可以与FER发生相互作用, 进而抑制S-腺苷甲硫氨酸的产生和乙烯的生物合成, 过量表达SAM1表现出与突变体类似的表型, 如植株矮小和叶片早衰等,双突变体则与突变体表型相反, 乙烯含量降低[40]。而MAT3在花粉管的生长中发挥重要的调控作用[41],此外,突变体则表现出木质素积累的减少[42]。水稻的功能也相继被报道,基因沉默转基因植株表现出矮化, 开花延迟和育性降低的表型[43]。进一步研究发现, OsSAMS1通过与OsFBK12互作, 并作为OsFBK12 的降解底物, 共同参与水稻种子萌发与叶片衰老的调控[25]。本研究发现,还参与了水稻免疫反应的调控(图5和图6), 正调控水稻的稻瘟病抗性。表明SAMS基因广泛参与植物多种生物学功能的调控, 如生长发育, 生物和非生物胁迫反应等, 但是否还参与其他生物学功能的调控还有待进一步发掘和验证。
4 结论
本研究鉴定的S-腺苷-L-甲硫氨酸合成酶编码基因主要在水稻叶片中表达, 稻瘟病菌Guy11侵染诱导后,的表达显著提高。OsSAMS1蛋白在细胞膜、细胞质和细胞核中均有分布。敲除突变体和接菌后表现为更加感病,基因和乙烯合成相关基因的表达受到明显抑制,这些结果表明参与了水稻稻瘟病抗性的免疫反应, 正调控水稻稻瘟病的抗性。
[1] Zhang N, Luo J, Rossman A Y, Aoki T, Chuma I, Crous P W, Dean R, de Vries R P, Donofrio N, Hyde K D, Lebrun M H, Talbot N J, Tharreau D, Tosa Y, Valent B, Wang Z H, Xu J R. Generic names in., 2016, 7: 155–159.
[2] Li W T, Chern M S, Yin J J, Wang J,Chen X W.Recent advances in broad-spectrum resistance to the rice blast disease., 2019, 50: 114–120.
[3] Deng Y W, Zhai K R, Xie Z, Yang D Y, Zhu X D, Liu J Z, Wang X, Qin P, Yang Y Z, Zhang G M, Li Q, Zhang J F, Wu S Q, Milazzo J, Mao B Z, Wang E T, Xie H A, Tharreau D, He Z H.Epigenetic regulation of antagonistic receptors confers rice blast resistance with yield balance., 2017, 355: 962–965.
[4] Yang D W, Li S P, Lu L, Fang J B, Wang W, Cui H T, Tang D Z.Identification and application of thegene in rice disease-resistance breeding.,2020, 22: 1022–1029.
[5] Zhou B, Qu S H, Liu G F, Dolan M, Sakai H, Lu G D, Bellizzi M, Wang G L.The eight amino-acid differences within three leucine-rich repeats betweenandresistance proteins determine the resistance specificity to., 2006, 19: 1216–1228.
[6] Zhu X Y, Chen S, Yang J Y, Zhou S C, Zeng L X, Han J L, Su J, Wang, Pan Q H.The identification of, a new member of the rice blast resistancemultigene family., 2012, 124: 1295–1304.
[7] Jiang N, Li Z Q, Wu J, Wang Y, Wu L Q, Wang S H, Wang D, Wen T, Liang Y, Sun P Y, Liu J L, Dai L Y, Wang Z L, Wang C, Luo M Z, Liu X L, Wang G L.Molecular mapping of theallelic geneconferring broad-spectrum resistance toin the rice cultivar Jefferson., 2012, 5: 29.
[8] Su J, Wang W J, Han J L, Chen S, Wang C Y, Zeng L X, Feng A Q, Yang J Y, Zhou B, Zhu X Y.Functional divergence of duplicated genes results in a novel blast resistance geneat thelocus., 2015, 128: 2213–2225.
[9] Deng Y W, Zhai K R, Xie Z, Yang D Y, Zhu X D, Liu J Z, Wang X, Qin P, Yang Y Z, Zhang G M, Li Q, Zhang J F, Wu S Q, Milazzo J, Mao B Z, Wang E T, Xie H A, Tharreau D, He Z H.Epigenetic regulation of antagonistic receptors confers rice blast resistance with yield balance., 2017, 355: 962–965.
[10] Dodds P N, Rathjen J P.Plant immunity: towards an integrated view of plant-pathogen interactions., 2010, 11: 539–548.
[11] Wang W, Feng B M, Zhou J M, Tang D Z.Plant immune signaling: advancing on two frontiers., 2020,62: 2–24.
[12] 杨德卫,李生平, 崔海涛, 邹声浩, 王伟.寄主植物与病原菌免疫反应的分子遗传基础.遗传, 2020, 42: 278–286.
Yang D W, Li S P, Cui H T, Zou S H, Wang W.Molecular genetic mechanisms of interaction between host plants and pathogens.(Beijing), 2020, 42: 278–286 (in Chinese with English abstract).
[13] Jones J D G, Dangl J L.The plant immune system., 2006, 444: 323–329.
[14] Yuan M, Jiang Z, Bi G, Nomura K, Liu M, Wang Y, Cai B, Zhou J M, He S Y, Xin X F.Pattern-recognition receptors are required for NLR-mediated plant immunity., 2021, 592: 105–109.
[15] Ngou B P M, Ahn H K, Ding P T, Jones J D G.Mutual potentiation of plant immunity by cell-surface and intracellular receptors., 2021, 592: 110–115.
[16] Li W T, Chern M S, Yin J J, Wang J, Chen X W.Recent advances in broad-spectrum resistance to the rice blast disease., 2019, 50: 114–120
[17] Hayafune M, Berisio R, Marchetti R, Silipo A, Kayama M, Desaki Y, Arima S, Squeglia F, Ruggiero A, Tokuyasu K, Molinaro A, Kaku H, Shibuya N.Chitin-induced activation of immune signaling by the rice receptor CEBiP relies on a unique sandwich-type dimerization., 2014, 111: 404–413.
[18] Yamaguchi K, Yamada K, Ishikawa K, Yoshimura S, Hayashi N, Uchihashi K, Ishihama N, Kishi-Kaboshi M, Takahashi A, Tsuge S, Ochiai H, Tada Y, Shimamoto K, Yoshioka H, Kawasaki T.A receptor-like cytoplasmic kinase targeted by a plant pathogen effector is directly phosphorylated by the chitin receptor and mediates rice immunity., 2013, 13: 347–357.
[19] Yamada K, Yamaguchi K, Yoshimura S, Terauchi A, KawasakiT.Conservation of chitin-induced MAPK signaling pathways in rice and., 2017, 58: 993–1002.
[20] Wang C, Wang G, Zhang C, Zhu P K, Dai H L, Yu N, He Z H, Xu L, Wang E T.OsCERK1-mediated chitin perception and immune signaling requires receptor-like cytoplasmic kinase 185 to activate an MAPK cascade in rice., 2017, 10: 619–633.
[21] Pennisi E.Armed and dangerous., 2010, 327: 804–805.
[22] Mine A, Seyerth C, Kracher B, Berens M L, Becker D, Tsuda K.The defense phytohormone signaling network enables rapid, high-amplitude transcriptional reprogramming during eector- triggered immunity., 2018, 30: 1199–1219.
[23] Meng J J, Wang L S, Wang J Y, Zhao X W, Cheng J K, Yu W X, Jin D, Li Q, Gong Z Z.Methionineadenosyltransferase4 mediates DNA and histone methylation.,2018, 177: 652–670.
[24] Yan, X J, Ma L, Pang H Y, Wang P, Lei L, Cheng Y X, Cheng J K, Guo Y, Li Q Z.Methionine synthase1 is involved in chromatin silencing by maintaining dna and histone methylation., 2019, 181: 249–261.
[25] Chen Y, Xu Y Y, Luo W, Li W X, Chen N, Zhang D J, Chong K.The F-box protein OsFBK12 targetsfor degradation and affects pleiotropic phenotypes, including leaf senescence, in rice., 2013, 163: 1673–1685.
[26] Bustin S A, Benes V, Garson J A, Hellemans J, Huggett J, Kubista M, Mueller R, Nolan T, Pfaffl M W, Shipley G L, Vandesompe J, Wittwer C T.The MIQE guidelines: minimum information for publication of quantitative real-time PCR experiments., 2009, 55: 611–622.
[27] Park C H, Chen S B, Shirsekar G, Zhou B, Khang C H, Songkumarn P, Afzal A J, Ning Y S, Wang R S, Bellizzi M, Valent B, Wang G L.Theeffector AvrPiz-t targets the RING E3 ubiquitin ligase APIP6 to suppress pathogen-associated molecular pattern-triggered immunity in rice., 2012, 24: 4748–4762.
[28] Yang D W, Cheng C P, Zheng X H, Ye X F, Ye N,Huang F H.Identification and fine mapping of a major QTL,, that plays pleiotropic roles in regulating the heading date in rice., 2020, 40: 30.
[29] Schwessinger B, Ronald P C.Plant innate immunity: perception of conserved microbial signatures., 2012, 63: 451–482.
[30] Yang C, Li W, Cao J D, Meng F W, Yu Y Q, Huang J K, Jiang L, Liu M X, Zhang Z G, Chen X W, Miyamoto K, Yamane H, Zhang J S, Chen S Y, Liu J.Activation of ethylene signaling pathways enhances disease resistance by regulating ROS and phytoalexin production in rice., 2017, 89: 338–353.
[31] Mao D, Feng Y, Jian L, Poel B V, Tan D, Li J L, Liu Y Q, Li X S, Dong M Q, Chen L B, Li D P, Luan S.FERONIA receptor kinase interacts with S-adenosylmethionine synthetase and suppresses S-adenosylmethionine production and ethylene biosynthesis in., 2016, 38: 2566–2574.
[32] Ji D C, Cui X M, Qin G Z, Chen T, Tian S P.SlFERL interacts with S-adenosylmethionine synthetase to regulate fruit ripening., 2020, 184: 2168–2181.
[33] Li W X, Han Y Y, Tao F, Chong K.Knockdown ofgenes encoding S-adenosyl-L-methionine synthetases causes methylation alterations of DNAs and histones and leads to late flowering in rice., 2011, 168: 1837–1843.
[34] Iwai T, Miyasaka A, Seo S, Ohashi Y.Contribution of ethylene biosynthesis for resistance to blast fungus infection in young rice plants., 2006, 142: 1202–1215.
[35] Tintor N, Ross A, Kanehara K, Yamada K, Fan L, Kemmerling B, Nürnberger T, Tsuda K, Saijo Y.Layered pattern receptor signalingethylene and endogenous elicitor peptides duringimmunity to bacterial infection., 2013, 110: 6211–6216.
[36] Helliwell E E, Wang Q, Yang Y N.Transgenic rice with inducible ethylene production exhibits broad-spectrum disease resistance to the fungal pathogensand., 2013, 11: 33–42.
[37] Singh M P, Lee F N, Counce P A, Gibbons J H.Mediation of partial resistance to rice blast through anaerobic induction of ethylene.2004, 94: 819–825.
[38] Seo Y S, Chern M, Bartley L E, Han M, Jung K H, Lee I, Walia H, Richter T, Xu X, Cao P, Bai W, Ramanan R, Amonpant F, Arul L, Canlas P E, Ruan R, Park C J, Chen X, Hwang S, Jeon J S, Ronald P C.Towards establishment of a rice stress response interactome.,2011, 7: e1002020.
[39] Gong B, Li X, VandenLangenberg K M, Wen D, Sun S S, Wei M, Li Y, Yang F J, Shi Q H, Wang X F.Overexpression of S-adenosyl-L-methionine synthetase increased tomato tolerance to alkali stress through polyamine metabolism., 2014, 12: 694–708.
[40] Mao D D, Yu F, Li J, Van de Poel B, Tan D, Li J L, Liu Y Q, Li X S, Dong M Q, Chen L B, Li D P, Luan S.FERONIA receptor kinase interacts with S-denosylmethionine synthetase and suppresses S-denosylmethionine production and ethylene biosynthesis in., 2015, 38: 2566–2574.
[41] Chen Y, Zou T, McCormick S.S-adenosylmethionine synthetase 3 is important for pollen tube growth., 2016, 172: 244–253.
[42] Shen B, Li C, Tarczynski M C.High free-methionine and decreased lignin content result from a mutation in theS-adenosyl-L-methionine synthetase 3 gene., 2002, 29: 371–380.
[43] Li W X, Han Y Y, Tao F, Chong K.Knockdown of SAMS genes encoding S-adenosyl-l-methionine synthetases causes methylation alterations of DNAs and histones and leads to late flowering in rice., 2011, 168: 1837–1843.
Functional studies of rice blast resistance related gene
YANG De-Wei1,2,**, WANG Xun1,*, ZHENG Xing-Xing1, XIANG Xin-Quan1, CUI Hai-Tao1, LI Sheng-Ping1,*, and TANG Ding-Zhong1,*
1College of Agriculture, Fujian Provincial Key Laboratory of Crop Breeding by Design, Plant Immunity Center, Fujian Agriculture and Forestry University, Fuzhou 350002, Fujian, China;2Institute of Rice, Fujian Academy of Agricultural Sciences, Fuzhou 350018, Fujian, China
Rice blast is one of the most devastating diseases in rice, which causes great economic losses to agricultural production.It has been reported that1 () is involved in the process of senescence in rice.Transcriptome sequencing analysis showed that the relative expression level ofwas significantly increased after inoculation with().However, it remains unclear whetheris involved in rice immunity.To verify this, we constructed the knock-out mutants ofin the wild type variety ZH11.The results showed thatwas mainly expressed in rice leaves, and its expression was significantly induced byinoculation.Subcellular localization revealed that OsSAMS1 was distributed in the plasma membrane, cytoplasm, and nucleus.Compared to the wild type, the two knockout mutants,and, displayed enhanced susceptibility uponinfection, and the expression of pathogenesis-related () genes was significantly inhibited.In addition, ethylene synthesis-related genes were also dramatically decreased in both two mutants.These results suggested thatwas involved in rice immune response and positively regulated rice blast resistance, which lays a foundation for further revealing the molecular mechanism ofin plant immunity and provides genetic resources for rice breeding of blast resistance.
rice; rice blast disease;; ethylene; function research
2021-04-02;
2021-09-09;
2021-10-18.
10.3724/SP.J.1006.2022.12022
通信作者(Corresponding authors): 李生平, E-mail: lishun1981@126.com;唐定中, E-mail: dztang@fafu.edu.cn
**同等贡献(Contributed equally to this work)
杨德卫, E-mail: dewei-y@163.com;王勋, E-mail: 1448293617@qq.com;
本研究由福建省属公益类项目(2020R11010016-3), 福建省自然科学基金项目(2019J01424)和福建省科技重大专项专题(2020NZ08016)资助。
This study was supported by the Special Fund for Agro-scientific Research in the Public Interest of Fujian Province (2020R11010016-3), the Natural Science Foundation of Fujian Province (2019J01424), and the Major Science and Technology Projects of Fujian Province (2020NZ08016).
URL: https://kns.cnki.net/kcms/detail/11.1809.S.20211015.1735.008.html

