Core 3 O-型糖链参与大肠杆菌对肠上皮细胞黏附和侵袭的影响
刘 韵 叶 钧
1.陆军军医大学第一附属医院消化内科,重庆 400038;2.陆军第九五八医院消化科,重庆 400020
黏蛋白O-型糖链根据在丝氨酸/苏氨酸(Ser/Thr)分子上不同连接,可分为Core 1~8八种不同O-型糖链[1]。不同类型的O-型糖链由不同的糖基转移酶催化合成,Core 3 O-型糖链由β-1,3-N-乙酰氨基葡萄糖转移酶6(β3gnT6)催化合成。肠致病性大肠杆菌(EPEC)和肠出血性大肠杆菌(EHEC O157∶H7)可引起患者从轻度腹泻到严重疾病的发生,如出血性肠炎[2];O-型糖链可能与肠道共生菌群的选择相关,同时可以作为不同细菌的黏附位点[3]。本课题组前期研究发现,苯甲基-α-N-乙酰半乳糖胺(benzyl-α-GalNAc)抑制肠上皮细胞O-型糖链的合成,将导致细菌黏附于肠上皮细胞细菌数减少,同时侵袭入细胞内细菌数增加。因benzyl-α-GalNA抑制的是肠上皮细胞所有O-型糖链的合成,不能鉴别出是哪种O-型糖链在细菌的黏附和侵袭过程中发挥作用,本研究通过构建Core 3 O-型糖链过表达结肠上皮细胞株来探讨Core 3 O-型糖链对细菌黏附和侵袭肠上皮细胞的影响。
1 材料与方法
1.1 试剂与材料
人类结肠癌细胞系HT-29(T25-flask,货号CBP60011)和LS174T(T25-flask,货号CBP60033)购买于上海中科院细胞库。EPEC、EHEC O157∶H7、肠侵袭性大肠杆菌(EIEC)来自陆军军医大学微生物教研室。β3gnT6过表达慢病毒(1 ml,滴度为108,货号L2016-745SH)由上海吉玛公司合成,庆大霉素注射液购买于西南药业有限公司(2 ml∶80 000单位,国药准字H50021451),TEER测定细胞培养板(12孔,货号3422)购买于美国Costar公司,碘化丙啶(Propidium Iodide,PI)染色液(1 ml,货号S7109)购买于美国Sigma公司,McCoy’s 5A培养基(500 ml,货号M9309)购买于美国Sigma公司,Triton X-100(100 ml,货号T8200)购买于北京索莱宝公司。
1.2 β3gnT6过表达细胞系建立和鉴定
Ctr/HT-29、β3gnT6/HT-29、Ctr/LS174T、β3gnT6/LS174T细胞株的建立和鉴定具体方法参照本课题组前期文献[4]。
1.3 细菌黏附试验(克隆计数法)
当Ctr/HT-29、β3gnT6/HT-29、Ctr/LS174T和β3gnT6/LS174T细胞株生长融合至80%时,制备成细胞悬液,并接种于24孔板。待其生长融合至单层细胞时,加入PBS清洗3次,再加入无血清McCoy’s 5A培养基培养2 h,使细胞株适应无血清状态,再向每个培养孔中加入相同浓度的EPEC或EHEC O157∶H7,37℃细胞培养箱中共孵育2 h。将培养板取出,倒掉培养基,用冷PBS清洗3次,抑制细菌进一步生长和去除未黏附的细菌,再通过细胞刮将黏附于细胞株表面的细菌刮下,再按照梯度稀释的方法将其均匀涂布在MacConkey琼脂板上,37℃细菌培养箱中过夜,最后用菌落计数法计数黏附于细胞表面的细菌数。
1.4 细菌黏附试验(直接观察法)
细菌与细胞共培养方法同上,去除未黏附细菌后,向培养孔中加入碘化丙啶(PI)室温染色细菌30 min,再用PBS清洗3次,最后用荧光显微镜观察和计数黏附于细胞表面的细菌数。
1.5 细菌侵袭试验
当Ctr/HT-29、β3gnT6/HT-29、Ctr/LS174T和β3gnT6/LS174T细胞株生长融合至80%时,制备成细胞悬液,并接种于24孔板中。待其生长融合至单层细胞时,加入PBS清洗3次,再加入无血清McCoy’s 5A培养基培养2 h,使细胞株适应无血清状态,再向每个培养孔中加入相同浓度的EIEC,37℃细胞培养箱中共孵育2 h,将培养板取出,倒掉培养基,用冷PBS清洗3次,再向培养孔中加入100 μg/ml庆大霉素,37℃细胞培养箱中共孵育2 h,以杀灭黏附于细胞表面的细菌,再用PBS清洗3次。然后向每孔中加入200 μl 0.25%的胰蛋白酶和0.025% Triton X-100,37℃细胞培养箱中孵育10 min,以破裂细胞和使细胞内的细菌释放出来,再将裂解液均匀涂布在MacConkey琼脂板上,37℃细菌培养箱中过夜,最后用菌落计数法计数侵袭入细胞内的细菌数。
1.6 TEER测定
当Ctr/HT-29、β3gnT6/HT-29、Ctr/LS174T和β3gnT6/LS174T细胞株生长融合至80%时,制备成细胞悬液,并将其接种于TEER测定细胞培养板中,当细胞株生长融合至单层细胞时,加入PBS清洗3次,再加入无血清McCoy’s 5A培养基培养2 h,再向培养孔中加入相同浓度的EPEC或EHEC O157∶H7,在不同时间点(0、3、6、12、24 h)测定其TEER值。
1.7 统计学方法
使用SPSS 22.0统计学软件分析数据,采用样本t检验,P< 0.05为差异有统计学意义。
2 结果
2.1 细菌黏附实验(克隆计数法)结果
黏附于β3gnT6/HT-29细胞株表面的EPEC和EHEC O157∶H7细菌数明显少于Ctr/HT-29细胞株(P< 0.01);黏附于β3gnT6/LS174T细胞株表面的EPEC和EHEC O157∶H7细菌数明显少于Ctr/LS174T细胞株(P< 0.01)。见图1。
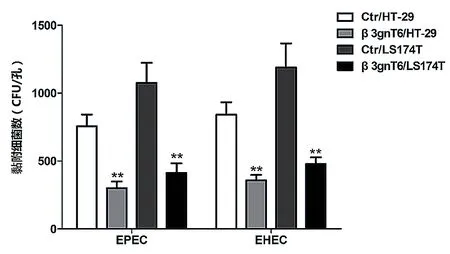
图1 黏附于细胞表面的EPEC和EHEC O157∶H7(**P < 0.01)
2.2 细菌黏附实验(直接观察法)结果
采用荧光显微镜观察发现,黏附于β3gnT6/HT-29细胞株表面的EPEC和EHEC O157∶H7细菌数明显少于Ctr/HT-29细 胞 株(P< 0.01);黏附于β3gnT6/LS174T细胞株表面的EPEC和EHEC O157∶H7细菌数少于Ctr/LS174T细胞株(P< 0.01或P< 0.05)。见图2。
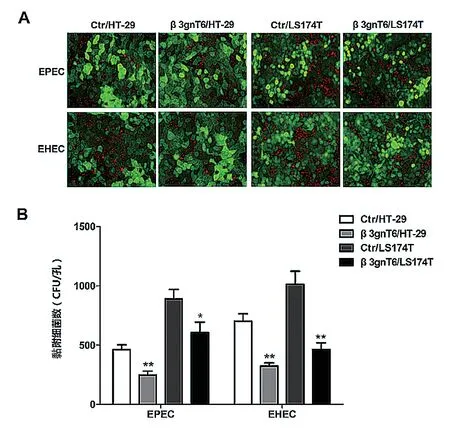
图2 荧光显微镜观察黏附于细胞表面的EPEC和EHEC O157∶H7(*P < 0.05;**P < 0.01)
2.3 细菌侵袭实验结果
侵袭入β3gnT6/HT-29细胞株内的EIEC细菌数多于Ctr/HT-29细胞株(P< 0.05);侵袭入β3gnT6/LS174T细胞株内的EIEC细菌数明显多于Ctr/LS174T细胞株(P< 0.01)。见图3。
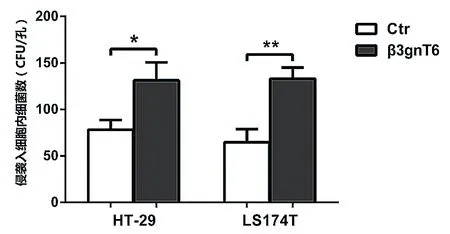
图3 侵袭入细胞内的EIEC细菌数(*P < 0.05;**P < 0.01)
2.4 TEER实验结果
在不同时间点(0、3、6、12、24 h)检测细胞株TEER值发现,未在EPEC或EHEC O157∶H7感染下,β3gnT6过表达细胞株TEER值的变化与其对照细胞比较,差异无统计学意义(P> 0.05)。在EPEC或EHEC O157∶H7感染下,β3gnT6过表达细胞株TEER值下降较其对照细胞更明显,差异有统计学意义(P< 0.01或P< 0.05)。见图4。
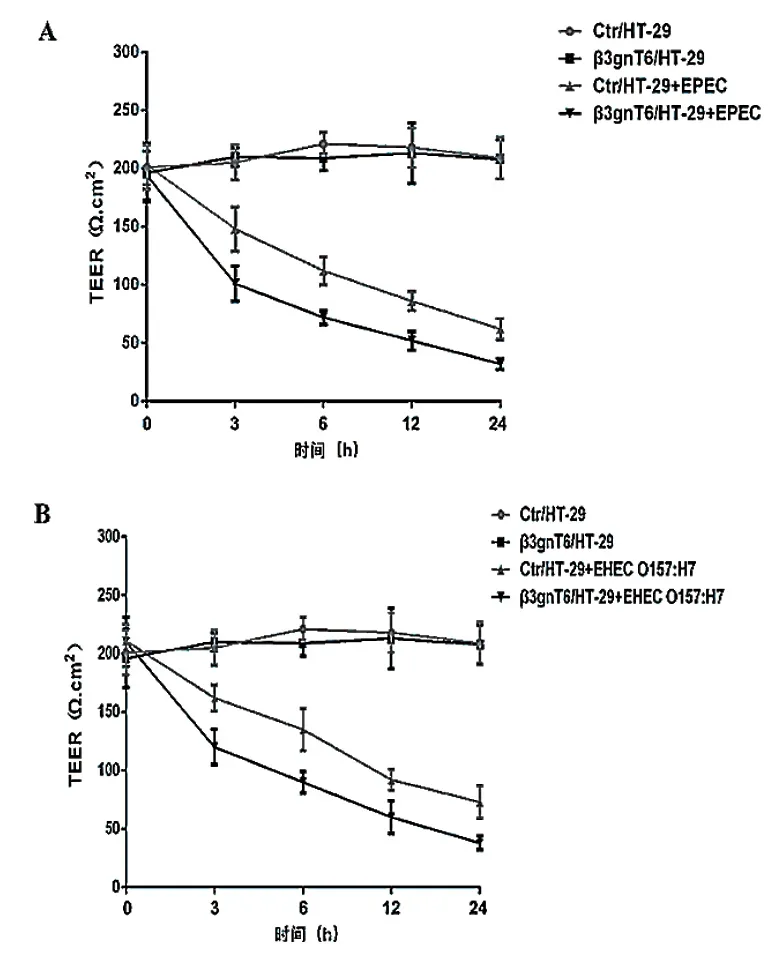
图4 不同时间点细胞株TEER值变化
3 讨论
在发展中国家,引起婴幼儿腹泻的主要致病菌是EPEC和EHEC O157∶H7[5],尽管对于EPEC或EHEC O157∶H7感染患者有一些有效的治疗手段,但为进一步优化治疗策略,需要明确EPEC或EHEC O157∶H7在肠道多重防御屏障保护下是如何致病的。在人体肠道中,EPEC或EHEC O157∶H7致病的第一步是黏附于肠道黏液屏障中的糖链上,进而定植和感染肠道上皮细胞。另一重要步骤是细菌通过Ⅲ型分泌系统分泌相关效应蛋白,使细菌进一步侵袭入肠道黏液层,进而引起肠道炎症的发生[6]。
肠道黏液屏障作为人体阻挡外界病原体、毒素的防御屏障,在人体生命活动中起至关重要的作用。结肠黏液屏障分为两层,最外面的一层为疏松层,含大量细菌;最里面一层为致密层,无细菌定植[7-8]。黏液屏障主要由肠道杯状细胞分泌的MUC2和IgGFcγBP及穿插在肠上皮细胞的膜相关黏蛋白(如MUC1、MUC3、MUC4)组成。分泌型黏蛋白和膜相关型黏蛋白有一个共同特点,就是在其内部含大量的串联重复序列(VNTRS),该重复序列中含大量的O-型糖链和N-型糖链的修饰位点。黏蛋白分子质量大约80%由O-型糖链组成,因此黏蛋白分子的功能与O-型糖链密切相关[9-12]。同时有研究表明,肠道黏蛋白O-型糖链参与细菌与宿主相互作用过程[13-18],在哺乳动物中,敲除Core 1或Core 3 O-型糖链将导致自发性结肠炎的发生[19]。
本课题组前期研究发现,通过benzyl-α-GalNAc抑制HT-29和HT-29-Gal细胞O-型糖链的合成,将导致EPEC和EHEC O157∶H7黏附肠上皮细胞数量减少,同时抑制肠上皮细胞MUC2分泌[20-21],因O-型糖链根据不同的连接在Ser/Thr残基上,黏蛋白O-型糖链可区分为八种核心结构(Core1~8)[22-23],benzyl-α-GalNAc抑制的是肠上皮细胞所有O-型糖链的合成,不能区分是哪一种或哪几种O-型糖链参与细菌黏附和侵袭。因此本课题组进一步研究发现,抑制肠上皮细胞Core 2 O-型糖链的合成,将导致EPEC和EHEC O157∶H7黏附肠上皮细胞数量减少[24],这提示Core 2 O-型糖链参与EPEC和EHEC O157∶H7黏附肠上皮细胞。本研究通过促进肠上皮细胞Core 3 O-型糖链的合成,进而明确Core 3 O-型糖链是否参与细菌黏附和侵袭肠上皮细胞。本研究显示,促进肠上皮细胞Core 3 O-型糖链的合成将抑制EPEC和EHEC O157∶H7黏附肠上皮细胞,同时增加EIEC侵袭入肠上皮细胞。这提示Core 3 O-型糖链可能不是EPEC和EHEC O157∶H7的黏附位点,Core 3 O-型糖链合成增加,将阻遏细菌黏附肠上皮细胞。同时Core 3 O-型糖链合成增强,导致EIEC侵袭入肠上皮细胞内细菌数增加,这可能是Core 3 O-型糖链的合成破坏了细胞屏障功能。因此,本研究测定不同时间点β3gnT6过表达细胞株与对照细胞株的TEER值,差异无统计学意义(P> 0.05)。而在EPEC或EHEC O157∶H7感染下,β3gnT6过表达细胞株的TEER值与其对照细胞比较明显下降(P< 0.01或P< 0.05),提示增加Core 3 O-型糖链的合成将导致细胞屏障的通透性增加,Core 3 O-型糖链具有调节细胞黏膜屏障的作用。同时有文献研究表明,在小鼠中,敲除C1galt1(合成Core 1 O-型糖链酶)将改变肠道通透性,进而增加肠道炎症及肿瘤的发生[25],而Core 1 O-型糖链与Core 3 O-型糖链的合成共用同一底物,抑制Core 1 O-型糖链的合成将增加Core 3 O-型糖链的合成[22-23],该体外研究结果与其一致。细胞株TEER值的差异发生在细菌感染条件下,而不是非感染条件下,这种差异的发生有待后续进一步探究其机制。
总之,本研究结果提示Core 3 O-型糖链参与EPEC和EHEC O157∶H7黏附肠上皮细胞,同时Core 3 O-型糖链参与EIEC侵袭肠上皮细胞,或许为将来肠道感染疾病的治疗提供新的靶点。

