非编码RNA 在骨性关节炎中对软骨细胞和胞外基质影响的研究进展
王世琦 岳 亮 谢文鹏∗ 蔡余力 ∗
(1.山东中医药大学第一临床医学院,济南 250014;2.山东中医药大学附属医院骨科,济南 250014)
骨性关节炎(osteoarthritis,OA)是世界上最常见的关节疾病,其发病率随着年龄的增长而增加。膝关节是最主要的受影响关节,可导致进行性加重的功能丧失、疼痛以及僵硬。据统计,在我国60 岁以上人群患病率约50%,75 岁以上约80%,女性的患病率为男性的2.46 倍,致残率高达53%[1]。尽管骨关节炎对个人、经济和社会方面造成了相当大的损失,但其并未引起人们的重视,更有甚者错误地认为骨关节炎是衰老必不可少的一部分[2]。软骨细胞是软骨中发现的唯一细胞,它受到严格的调控来维持生长、分化和凋亡之间的平衡。然而在OA 发病过程中,这种动态平衡会导致软骨基质的退化和软骨细胞的过度损伤,软骨细胞外基质的丢失也会导致软骨的异常重塑,最终演变为OA[3]。如何早期诊断和治疗软骨退变既是目前临床上亟需解决的关键,也是问题的难点。因此,从生物学上寻找OA 作用于软骨细胞的特异性靶点,对OA的早期诊断和治疗是十分重要的。
随着测序技术的进步,多种mRNA 以外的RNA被发现,这些新发现的RNA 并不参与蛋白的编码,被统称为非编码RNA(non-coding RNA,ncRNA)[4]。非编码RNA 主要分为微小 RNA (microRNA,miRNA)、长链非编码RNA(long non-coding RNA,lncRNA)和环状RNA(circular RNA,circRNA)。它们与诸多分子靶目标结合形成调控网络,进而启动特定的细胞生物应答,从而调控基因表达、影响细胞内信号传递、参与表观遗传修饰等多种生命活动的功能,进而在OA 等疾病的发生、发展中发挥作用[5]。近年越来越多的证据表明,ncRNA 与OA 的发生、发展、诊断和治疗等密切相关,本文就ncRNA对软骨细胞和胞外基质的影响进行归纳总结,为探索其对OA 发病机制的影响提供新思路。
1 miRNA 与OA 软骨细胞和胞外基质的关系
miRNA 是一种长度为21~23 个核苷酸的小片段非编码单链RNA,自从在秀丽隐杆线虫中鉴定出首个miRNA 后,已有超过1000 个miRNA 在人类和小鼠中被发现,miRNA 调控人类60%以上的蛋白质编码基因,在基因表达的调控中发挥重要作用。miRNA 在OA 软骨细胞中的作用机制见图1。
1.1 miRNA 与软骨细胞的增殖、凋亡的关系
OA 的发生与软骨细胞的增殖、凋亡有着密切的联系。上调或下调的miRNA 可调控软骨细胞的增殖、凋亡过程。值得注意的是,miRNA 可同时介导多个生物学过程来调控OA 的进程,比如miR-34a除与miR-108a 协同以提高NF-κB(p50)活性,降低Bcl-2 的表达,进而促进软骨细胞凋亡外[6],还可以靶向诱导生产CyR61,以抑制软骨细胞的增殖[7]。Zhang 等[8]的大鼠实验表明向关节腔中注射miR-34a 能降低软骨细胞的死亡,减少软骨的丢失。敲除MFI2-AS1 基因后,过表达的miR-130a-3p 会下调TCF4,抑制脂多糖诱导的细胞损伤,达到抑制细胞凋亡、炎症反应和细胞外基质降解的功能,从而达到缓解OA 的作用[9]。
1.2 miRNA 与软骨细胞自噬的关系
自噬是机体在应激状态下防止细胞死亡的保护机制,有利于维持细胞活性与稳态[10]。PI3K/AKT/mTOR 和NF-κB 信号通路在miRNA 调控软骨细胞自噬中发挥重要作用,miR-155 可抑制前者以诱导自噬的发生,miR-27a 的过表达可通过后者诱导自噬,miR-107 则可作用于两种通路[11-13]。miR-30b 可下调促自噬基因并上调促凋亡基因,应用antimiR-30b 后不仅起到明显的反转作用,还可以提高炎症期间的细胞存活率[14],这表明antimiR-30b具有治疗OA 的潜力。miR-9 是沉默信息调节因子1(SIRT-1)的调节因子,可通过调控SIRT1 来影响软骨细胞的自噬[15]。除miRNA 对自噬进行调节外,自噬还可调节miRNA 的生物学功能,例如,自噬选择性地针对miRNA 机制的关键组件来调节miRNA 的稳定性和功能。DICER1 和主要的miRNA效应器AGO2 通过选择性自噬受体CALCOCO2/NDP52 降解[16];mTORC1 途径和自噬控制着RNA诱导沉默复合体(RISCs)的正确组装,从而影响miRNA 的功能[17]。
1.3 miRNA 与细胞外基质降解的关系
基质金属蛋白酶13(MMP13)与人血小板反应蛋白解整合素肽酶5(ADAMTS-5)是导致关节软骨细胞外基质降解的主要水解酶,是诱发OA 的关键原因。Cao 等[18]的研究揭示了miR-214-3p 的减少会激活NF-κB 信号通路促进ECM 的降解和软骨细胞凋亡进而促进OA 的发生。促炎症细胞因子白细胞介素1β(IL-1β)可通过刺激基质降解的蛋白的表达参与OA 的发生和发展,抑制miR-30a 的表达可通过IL-1β/AP-1/MIR-30a/ADAMTS-5 轴缓解IL-1β 诱导的软骨细胞外基质降解,可见miR-30a 是软骨稳态的关键调节剂,是OA 的潜在诊断和治疗靶点[19]。Zhang 等[15]发现在OA 患者中,miR-9 的表达受抑制,而MMP-13 呈高表达,并证实miR-9 可抑制MMP13 的表达降低细胞外基质的降解。miR-140 不仅可直接作用于Adamts-5 靶点,还可能通过其他生物轴来调控细胞外基质的降解[20]。miR-122过表达可抑制SIRT1,从而增加细胞外基质的降解[21]。miR-449a 可直接靶向生长分化因子5(GDF5)促进软骨细胞的降解[22],在大鼠实验中,关节腔内注射miRNA-140 可以通过调节细胞外基质的稳态来缓解大鼠骨性关节炎的进展,这可能成为治疗OA 的新方法[23]。
2 lncRNA 与OA 软骨细胞和胞外基质的关系
lncRNA 是一类分布在细胞核和细胞质中超过200 个核苷酸的ncRNA,由RNA 聚合酶Ⅱ转录而来,因此lncRNA 在来源和结构上类似于mRNA,都具有5’帽状结构、3’polyA 结构和可变剪接体。lncRNA 可分为基因间lncRNA、内含子lncRNA、正义lncRNA、双向lncRNA、反义lncRNA[24]。lncRNA通常参与骨和软骨的形成,现有证据表明lncRNA是炎症反应的中心调节因子,可能是OA 诊断和治疗的潜在生物标志物[25]。lncRNA 在OA 软骨细胞中的作用机制见图2。
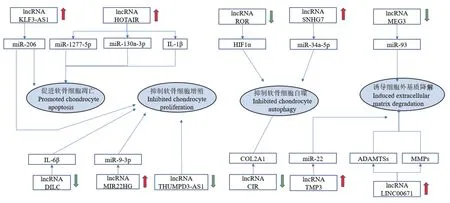
图2 lncRNA 在OA 软骨细胞和胞外基质中的作用Figure 2 Mechanism of lncRNA on OA chondrocytes and extracellular matrix
2.1 lncRNA 与软骨细胞的增殖、凋亡的关系
目前已知有4717 种lncRNA 在OA 软骨中差异表达[26],lncRNA 通常通过调节miRNA 来发挥作用。lncRNA HOTAIR 能促进IL-1β 诱导的软骨细胞凋亡,在最近的研究中发现它通过调节miR-1277-5p 和miR-130a-3p 来调控软骨细胞的增殖和凋亡[27-29],此外有报道沉默lncRNA HOTAIR 可激活Wnt/β-catenin 信号通路,抑制OA 滑膜炎在和滑膜细胞增殖,促进滑膜细胞凋亡[30],这表明lncRNA HOTAIR 不仅通过调节不同miRNA 影响软骨细胞凋亡,还可作用于OA 进程的其它病理活动,是OA 的早期诊疗的潜力靶点。IL-6β 作为一种促炎因子在多种炎症性疾病中上调,过表达lncRNA DILC 能 使IL-6β 水平降低[31]。lncRNA MIR22HG 可作为miR-9-3p 的海绵基因,抑制lncRNA MIR22HG 会通过miR-9-3p/ADAMTS5 轴促进软骨细胞的增殖,抑制软骨细胞的凋亡[32]。过表达lncRNA THUMPD3-AS1 虽然能减少软骨细胞的凋亡,但却会提高细胞周期蛋白E2、细胞周期蛋白依赖性激酶4、B 细胞淋巴瘤2、肿瘤坏死因子-α、一氧化碳和IL-6 的水平,加重炎症反应[33],由此可见ncRNA 调控OA 网络的复杂性。目前研究表明lncRNA-KLF3-AS1 可通过海绵miR-206 促进GIT1 的表达而发挥ceRNA 的作用,外源性lncRNA-KLF3-AS1 可以作用于miR-206/GIT1 轴调控软骨细胞的增殖诱导和凋亡抑制[34]。
2.2 lncRNA 与软骨细胞自噬的关系
Tian 等[35]发现,lncRNA SNHG7 在OA 软骨细胞中呈低表达状态,lncRNA SNHG7 的缺失会使miR-34a-5p 水平升高,促进软骨细胞的自噬体内和体外研究均显示lncRNA-CIR 是控制软骨自噬的关键因素,lncRNA-CIR 的上调会导致Ⅱ型胶原基因(COL2A1)水平降低,MMP3 水平升高,最终导致软骨退变[36]。Yang 等[37]发现lncRNA-ROR 可通过HIF1α 和P53 调控软骨细胞自噬,其过表达对软骨细胞的自噬有促进作用,从而缓解OA 发病。
2.3 lncRNA 与细胞外基质降解的关系
越来越多的研究表明lncRNA 通过海绵miRNA来发挥调控作用。lncRNA MEG3 可以靶向作用于miR-93/TGFBR2 轴,其过表达可缓解细胞外基质的降 解[38]。有报道 lncRNA LINC00671 可通过SMURF2/GSK-3β 轴调控细胞外基质,当lncRNA LINC00671 表达上调时,可导致MMP3、MMP13、ADAMTS-4 以及ADAMTS-5 水平提高进而使细胞外基质降解增加,在小鼠骨性关节炎模型中使用sh-LINC00671 可显著抑制MMPs 和ADAMTS 的表达,从而降低软骨细胞外基质的降解,缓解OA 的进展[39]。Li 等[40]在体外实验中发现lncRNA TMP3可作为miR-22 的海绵基因,影响ALK1 的表达,导致Smad1/5 的表达增加,从而上调MMP13 的表达和细胞外基质的降解。
3 circRNA 与OA 软骨细胞和胞外基质的关系
circRNA 是一种存在闭环结构的内源性非编码RNA,根据基因组起源和产生方式的不,可大致分为三种类型:内含子circRNA、外显子circRNA 和外显子-内含子circRNA。circRNA 可调节亲本基因、调控miRNA、与蛋白质结合形成功能复合体,而且circRNA 在细胞的增殖、分化、侵袭、迁移、自噬和凋亡等方面发挥重要作用[41-42]。人工调节circRNA有望成为对抗OA 发展的基因疗法。circRNA 在OA软骨中的作用见表1。
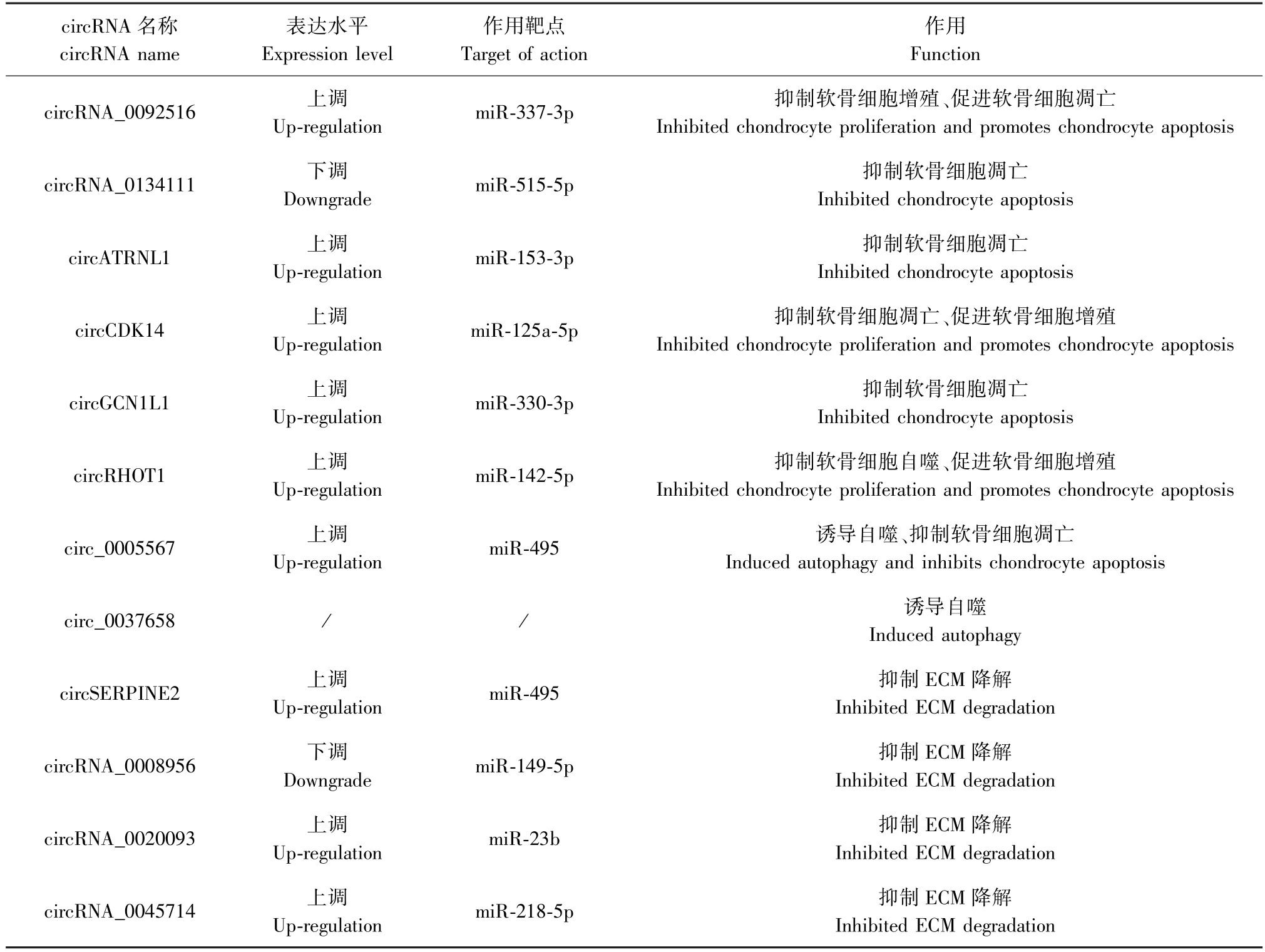
表1 circRNA 对OA 软骨细胞的作用Table 1 Effects of circRNA on OA chondrocytes
3.1 circRNA 与软骨细胞的增殖与凋亡的关系
有报道抑制circRNA_0092516 可通过miR-337-3p/PTEN 轴调控软骨细胞的增殖,抑制细胞凋亡[43]。circ_0134111 在OA 软骨细胞中过表达,并作为miR-515-5p 的海绵基因靶向调控SOCS1,敲除circ_0134111 可减轻IL-1β 诱导的软骨细胞凋亡及炎症反应[44]。circATRNL1 可通过调节miR-153-3p/KLF5 轴来改善OA 的进程,当circATRNL1 过表达时可抑制miR-153-3p,缓解软骨细胞的凋亡[45]。Shen 等[46]在研究中发现,circCDK14 在关节磨损位置下调明显,Smad2 能诱导Sox9 和Ⅱ型胶原蛋白的表达并调节软骨细胞的增殖和分化,circCDK4 的过表达可通过miR-125a-5p/Smad2 轴调节软骨细胞的增殖和凋亡。Zhu 等[47]的研究表明存在circGCN1L1/miR-330-3p/TNF 轴,且在大鼠模型中抑制circGCN1L1 可减少软骨细胞的凋亡。
3.2 circRNA 与软骨细胞自噬的关系
在OA 大鼠模型中,敲除circRHOT1 可促进Ⅱ型胶原和蛋白聚糖的表达,并逆转LC3 和beclin1 的抑制状态,circ RHOT1 可通过海绵化miR-142-5p 增强CCND1 的表达从而抑制软骨细胞的自噬并促进软骨细胞的增殖[48]。circ_0005567 的过表达可减弱IL-1β 诱导的软骨细胞凋亡,但这种作用可以被3-甲基腺嘌呤(自噬抑制剂)清除,这表明circ_0005567 过表达通过诱导自噬抑制软骨细胞凋亡,此外circ_0005567 可与miR-495 竞争性结合,抑制早期自噬标记物ATG14 的表达[49]。Sui 等[50]报道circ_0037658 在IL-1β 诱导的软骨细胞中显著上调,沉默circ_0037658 可以通过调节诸多自噬因子LC3、P62、Beclin1、ATG5 和AIF 以诱导自噬,保护软骨细胞免受IL-1β 的损伤。
3.3 circRNA 与细胞外基质降解的关系
一项研究表明过表达circSERPINE2 可减轻IL-1β 引起的OA 进程,circSERPINE2 可靶向调控miR-495,而miR-495 靶向调控TGFBR2。TGFBR2 可以减弱经IL-1β 诱导的软骨细胞外基质的降解[51]。NAMPT 是一种限速酶,可由受IL-1β 刺激的OA 软骨细胞产生,并增强MMPs 的表达促进细胞外基质的降解,在受IL-1β 刺激形成的OA 软骨细胞中,NAMPT 过表达可阻断miR-149-5p 的再表达,抑制细胞凋亡,促进细胞周期,circRNA_0008956 则可通过miR-149-5p/NAMPT 轴参与细胞外基质的降解[52]。Feng 等[53]在体外细胞模型中发现circRNA_0020093 通过靶向miR-23b 正向调控SPRY1 的表达,降低MMP13 和ADAMTS-5 介导的细胞外基质降解。Jiang 等[54]研究发现,过表达circRNA _0045714 可阻断肿瘤坏死因子-α(TNF-α)诱导的MMP13 和ADAMTS-4 的积聚以及Ⅱ型胶原和聚集蛋白聚糖分解代谢因子的减少,从而防止细胞外基质的降解。
4 结语
OA 是最常见的慢性退行性关节疾病,随着我国逐渐步入老龄化社会,逐年增多的OA 患者不仅严重影响患者的生活质量,还会给社会医疗资源带来巨大挑战[55]。目前OA 缺乏早期诊断和治疗手段,ncRNA 因其参与软骨细胞的多种活动,具有成为新的诊疗标志物的潜力。由关节软骨损伤导致的细胞外基质的分解代谢失衡是OA 的直接原因[56],因此本文从软骨细胞的增殖与凋亡、软骨细胞的自噬和细胞外基质降解3 个方面介绍了ncRNA 对软骨细胞和胞外基质的调控。现有的研究多以细胞实验和大鼠实验为主,缺乏直接临床证据,且多着重于单向lncRNA-miRNA-circRNA 的调控网络的构建,细胞生理功能对ncRNA 的影响鲜有提及,这还不足以完全揭示ncRNA 在软骨退变中的作用机制。目前的研究表明ncRNA 可调节OA 的多种生理病理过程,随着ncRNA 在OA 领域的深入,ncRNA 多靶点多层面的调控机制也会得到更全面地构建。

