血清和组织PLAC1在结肠癌诊断和判断淋巴结转移风险中的临床价值
闫龙超,杨琳,杨明,潘吉勇
(大连市第三人民医院 普通外科一病房,辽宁 大连 116000)
结直肠癌是全球发病和死亡率均高居前5位的消化道恶性肿瘤之一[1],因为缺乏早期症状,超过一半的患者在诊断时已发生淋巴结或远处转移[2]。因此寻求肠癌诊断和判断淋巴结转移风险的生物标志物具有重要的临床价值。织胎盘特异性基因1(placenta-specific 1,PLAC1)是近年来发现的胎盘抗原之一,其正常组织表达有限,在胎盘功能和发育中起着重要作用[3]。据报道,PLAC1在多种癌症中被过度激活,例如在一项乳腺癌研究中97% 的肿瘤活检中都检测到PLAC1阳性表达[4]。鉴于PLAC1组织特异性以及其可能的促癌因子活性,本研究旨在通过前瞻性研究探讨结肠癌组织中PLAC1的表达变化,并进一步明确其在疾病诊断和判断淋巴结转移风险中的临床价值。
1 资料与方法
1.1 生物信息学分析
从TCGA数据库中下载结肠癌RNA-seq表达数据和相应的患者临床资料,包括421个肿瘤组织标本和41个正常结肠组织标本。以每千个碱基的转录每百万映射读取的转录本(transcripts per kilobase of exon model per million mapped reads,TPM)数据衡量基因表达量。基于PLAC1不同表达,对其中421例患者完成生存随访分析。
1.2 一般资料
对2018年3月至2021年3月在我院完成结肠癌根治术的151例病理诊断为结肠癌的患者(结肠癌组)制作了肿瘤组织和癌旁正常组织(距肿瘤切缘>5 cm,且术后经病理证实无癌细胞侵犯)的病理组织学切片,其中男88例,女63例;年龄23~81岁,平均(62.52±14.70岁)。收集患者的相关临床资料,包括性别、年龄、肿瘤部位、直径、浸润深度、分化程度、淋巴结转移、肝转移等。纳入标准:(1)所有患者的肿瘤组织标本均经病理学检查(由1名经过认证的外科医生和病理学专家共同确定)确诊为原发性结肠癌;(2)所有患者术前均未接受放疗、化疗、靶向治疗等抗肿瘤治疗;(3)手术切缘阴性(R1)。排除合并其他恶性肿瘤、多发性结肠息肉、自身免疫性疾病、严重心脏疾病(心力衰竭、急性心肌梗死等)、严重内科疾病(血液系统疾病、急慢性感染、慢性阻塞性肺病、肝功能不全、肾衰竭等)者。另外纳入150例非癌患者的血清样本作为正常组,其中男80例,女70例;年龄18~87岁,平均(61.49±15.20岁)。2组年龄、性别构成比较差异无统计学意义(P>0.05)。本研究属于临床实验性研究,获得了医院伦理委员会批准以及患者和家属的知情同意。
1.3 免疫组化法检测组织PLAC1的表达
取手术切除的新鲜组织标本置于 4% 的甲醛溶液中固定,石蜡包埋后连续切片成厚度为 3~4 μm样本,样本依次经二甲苯脱蜡(2 次,每次 10 min)、梯度酒精水化、柠檬酸缓冲液修复(10 mmol·L-1,pH 6.0,20 min),之后滴加3%过氧化氢,放入微波炉中孵育 10 min灭活内源性过氧化物酶。用10%山羊血清封闭30 min后滴加PLAC1一抗(Abcam 公司,美国)并于4 ℃孵育过夜,PBS漂洗后加辣根酶标记羊抗兔 IgG室温孵育10 min,PBS 漂洗后经 DAB 显色和苏木精复染,晾干后用中性树胶固定。由两名训练有素的研究人员在不知道患者临床信息的情况下,对每个病理玻片随机选取5个高倍镜视野(约1 000个细胞)进行了审查。结果判断:PLAC1 蛋白阳性着色主要分布于细胞质,呈棕褐色或棕黄色。判断标准[5]为:基本不着色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分。计算每个载玻片核心区域PLAC1+细胞数,着色细胞占细胞百分率≤5%为0分,6%~25%为1分,26%~50%为2分,>50%为3分。最后得分为每张切片相同区域的肿瘤细胞着色程度得分与着色细胞百分率的得分相乘,最终得分≤3分为无表达(阴性),≥4分为阳性表达。
1.4 酶联免疫吸附试验检测血清PLAC1水平
在手术前采集患者的血清样本,采用酶联免疫吸附试剂盒(MyBioSource公司,美国,货号:#MBS931690)检测血清PLAC1蛋白水平。血清用生理盐水稀释1∶10,使用重组人PLAC1标准品拟定标准曲线,将血清样本的450 nm处的吸光度值与标准曲线比较计算血清PLAC1蛋白浓度。阳性反应定义为吸光度值超过相对稀释的阴性对照组的平均吸光度值1个标准差。
1.5 统计学处理
使用SPSS 20.0软件包对数据进行统计学分析。血清PLAC1水平不符合正态分布,以中位值(四分位距)表示,两组间比较采用 Mann-WhitneyU检验;计数资料以例(率)表示,比较采用卡方检验。P<0.05为差异具有统计学意义。绘制受试者工作特征(receiver operating characteristic,ROC)曲线,计算曲线下面积(area under ROC curve,AUC)。
2 结 果
2.1 生物信息学分析结果
于2021年3月从TCGA数据库下载RNA-Seq表达数据和患者临床特征资料。患者男227例,女194例;年龄31~89岁;临床分期Ⅰ期17.34%(n=73)、Ⅱ期38.48%(n=162)、Ⅲ期30.64%(n=129)、Ⅳ期13.54%(n=57);13.54%(n=57)的患者发生远处转移,40.62%(n=171)的患者发生淋巴结转移。我们从TCGA数据库共下载了421个肿瘤组织样本和41个正常结肠组织样本,采用 Wilcoxon signed Rank Test法比较,肿瘤组织中PLAC1的表达量明显高于正常组织(P<0.01),且高表达的PLAC1与远处转移(M1vs.M0,P<0.001)、淋巴结转移(N1+vs.N0,P<0.001)、临床分期(Ⅳ期vs.Ⅰ期,P<0.001)有相关性。另外,根据Survminer 软件包得到的0.89临界值,将结肠癌患者依据危险评分分为高危组和低危组。绘制Kaplan-Meier生存曲线,高表达PLAC1患者无病生存率和总生存率相对不良(P<0.05)。见图1。
2.2 结肠癌组织和癌旁正常组织PLAC1蛋白表达情况
结肠癌组织和癌旁正常组织中PLAC1蛋白阳性表达率分别为64.90%(98/151)和18.54%(28/151),与癌旁正常组织相比,肿瘤组织中PLAC1蛋白阳性表达率显著升高(P<0.05)。见图2。
2.3 结肠癌组和正常组血清PLAC1水平比较
正常组和结肠癌组血清PLAC1水平分别为42.51(22.90,62.85)ng·ml-1、86.70(45.50,210.00)ng·ml-1,结肠癌组患者血清PLAC1水平明显高于正常组(Z=-11.071,P<0.05)。对于结肠癌患者,组织PLAC1蛋白阳性者血清PLAC1水平高于组织PLAC1蛋白阴性表达者[151.25(87.00,260.50)ng·ml-1vs.39.90(25.50,61.60)ng·ml-1,Z=-9.760,P<0.05]。此外组织PLAC1蛋白阳性者血清PLAC1水平高于正常组(Z=-34.018,P<0.05),但是组织PLAC1蛋白阴性者血清PLAC1水平与正常组比较差异无统计学意义(Z=-1.003,P=0.378)。
2.4 结肠癌组织和血清PLAC1表达与淋巴结转移的关系
以血清PLAC1水平中位值(86.70 ng·ml-1)为界限,≤86.70 ng·ml-1为低表达,否则为高表达。组织PLAC1高表达与肿瘤直径>5 cm、淋巴结转移及TNM Ⅲ~Ⅳ分期有关(P<0.05);血清PLAC1水平亦与淋巴结转移及TNM Ⅲ~Ⅳ分期有关(P<0.05)。见表1。
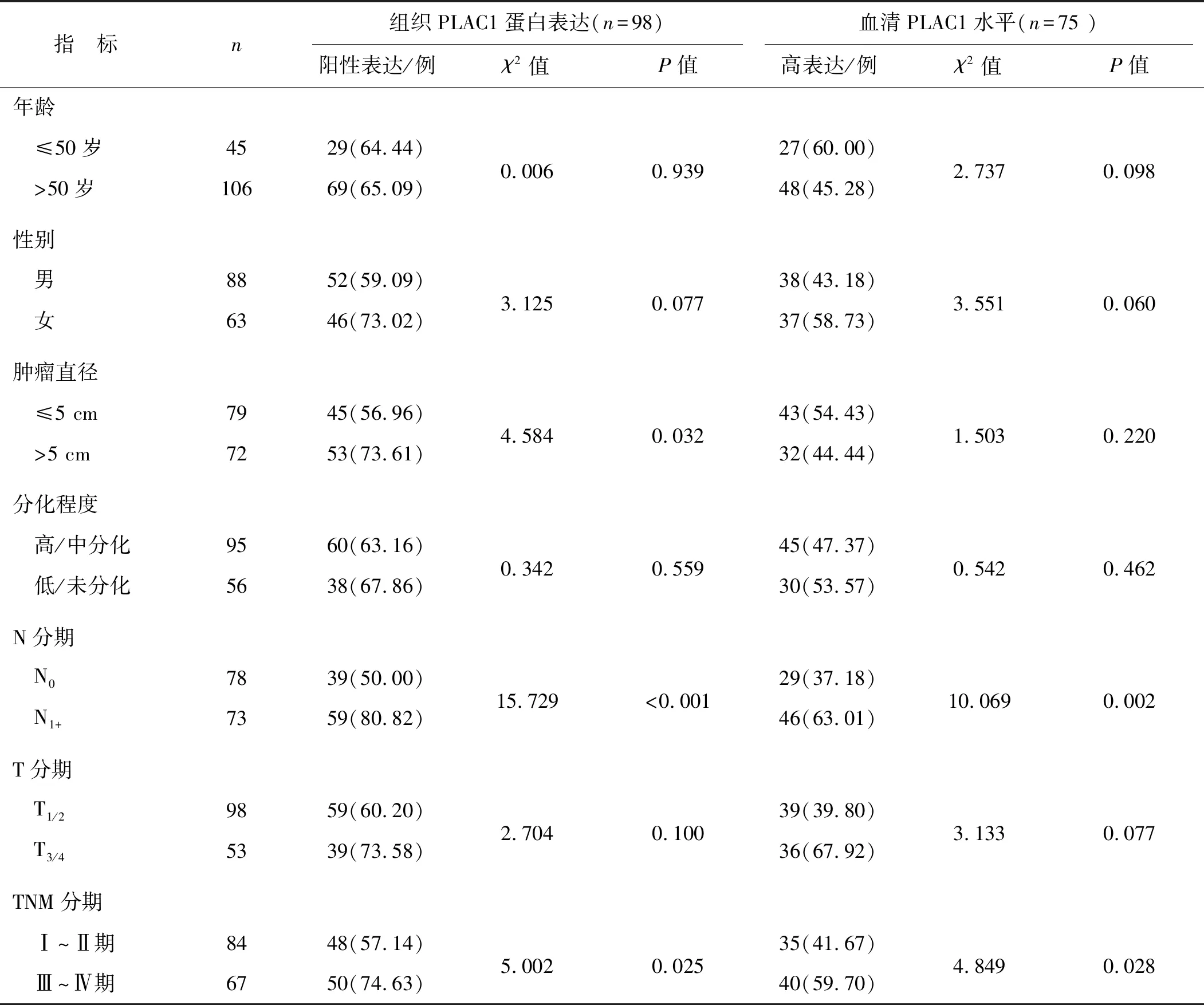
表1 结肠癌患者组织和血清PLAC1表达水平与临床病理特征的关系
2.5 ROC曲线分析血清PLAC1水平用于结肠癌诊断和预测淋巴结转移的临床价值
经ROC曲线分析,血清PLAC1水平诊断结肠癌的AUC为0.962(95%CI:0.934~0.989),灵敏度和特异度分别为94.6%和92.2%。血清PLAC1水平预测结肠癌淋巴结转移的AUC为0.868(95%CI:0.828~0.908),灵敏度和特异度分别为81.5%和76.2%。见图3。
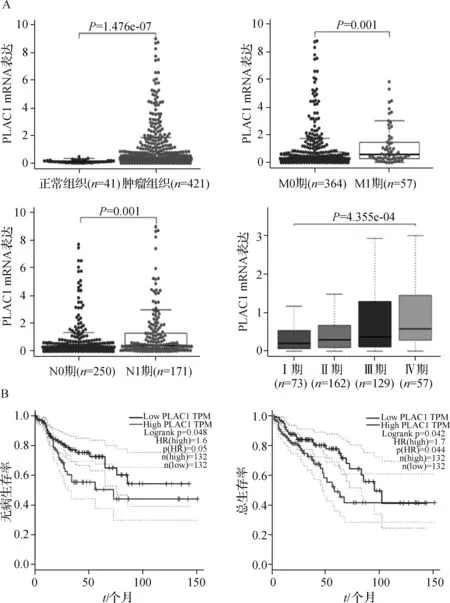
A.PLAC1不同组织、不同M分期、不同N分期、不同TNM分期中的表达差异;B.肿瘤组织中PLAC1表达情况与无病生存率和总生存率之间的关系图1 基于TCGA数据库信息分析PLAC1在正常组织和结肠癌组织中的表达差异
3 讨 论
结肠癌的发生和发展涉及到多种遗传因素的变化,因此患者的预后差异很大,除了是否涉及癌基因突变外,还取决于肿瘤TNM分期、病理类型、分化程度等因素。多年来,许多学者一直在不断寻找与结肠癌的诊断和预后相关的标志物。近年来越来越多的分子靶点逐渐被纳入临床应用,如EGFR/K-RAS/BRAF[6]、PD-1/PD-L1[7]等。然而,长期效应仍缺乏大样本、多中心临床数据的支持。因此,迫切需要具有广泛意义的指标来指导临床诊断和治疗。本研究中我们发现,PLAC1在结肠癌组织中呈高表达,而且与淋巴结转移和TNM分期有关,这与TCGA数据库中得到的生物学信息相一致。
在过去的20年里,免疫疗法在癌症治疗方面取得了前所未有的进展,使医学肿瘤学发生了革命性的变化。然而,癌症免疫治疗的一个主要障碍是识别适当的肿瘤特异性抗原,使靶向治疗能够更小地影响正常细胞[8]。胚胎植入时滋养层细胞植入子宫内膜,与肿瘤生长、迁移和侵袭极为相似。胎盘和肿瘤的发展及生长之间的相似之处,激发了许多研究者去发现癌症的有效免疫治疗抗原[9]。PLAC1是一个xq26链接基因,全长92 641 bp,含3个外显子,第3外显子为编码区,转录单位全长1 126 bp,共编码212个氨基酸。PLAC1编码微绒毛膜蛋白,在胎盘滋养层细胞表面高表达,在睾丸中低表达,但在正常的体细胞组织中不表达,与其他癌症/睾丸抗原相比,在正常组织中表达最为受限[10]。在肿瘤的发生发展过程中,许多在胚胎中正常表达的基因在癌细胞中被重新激活,PLAC1是一类新的在胚胎组织和肿瘤组织中高表达的肿瘤相关抗原。Silva等[11]首次报道了PLAC1 mRNA在包括乳腺癌、结肠癌、肺癌在内的17种不同恶性肿瘤的人类癌细胞系中呈高表达,因此对于乳腺癌和其他肿瘤,PLAC1已经成为基于抗体治疗的合适靶点之一。据报道,PLAC1具有较强的免疫原性,有望成为一些癌症患者区分于健康人群表达特征的潜在靶标[12]。本研究使用免疫组化和ELISA检测证实,PLAC1蛋白在结肠癌组织和患者血清中均呈高表达,并与疾病进展有关。这意味着PLAC1有望成为癌症免疫治疗的潜在靶点。
先前的研究发现,人类乳腺癌细胞中的PLAC1转录受到许多与PPARd和其他核受体相关的辅助激活因子的调节,包括 C/EBPβ和NCOA3,这两种辅助激活因子都与乳腺癌的进展有关[3]。此外Li等[13]研究也证实,PLAC1和Furin相互作用进而降解Notch1信号蛋白,产生Notch1胞内结构域(Notch1 intracellular domain),可抑制下游PTEN分子的活性,说明PLAC1和Furin之间的相互作用促进了乳腺癌的侵袭和转移。这些发现都解释了本研究中结肠癌组织PLAC1高表达与淋巴结转移及恶性化进展有关。淋巴结转移是恶性肿瘤转移的一种主要的转移方式,浸润的肿瘤细胞穿过淋巴管壁,脱落后随淋巴液被带到汇流区淋巴结,并且以此为中心生长出同种肿瘤。另外,血清PLAC1水平与肿瘤组织中PLAC1蛋白表达量一致,高水平的血清PLAC1可以作为一个有用的生物标志物,用于跟踪疾病进展。Ren等[14]学者通过GSEA富集分析证实,PLAC1与MTA3途径、DNA修复、干扰素 α 反应、干扰素 γ 反应、同种异体移植排斥、自身免疫性甲状腺疾病等都密切相关。MTA3通路在调节结肠癌的发生和发展中起重要作用,它可以促进癌细胞增殖、侵袭、迁移和细胞周期进程[15]。此外,在过去的几十年里,DNA修复已经被报道对结肠癌有影响,并且具有较强的预测预后价值。而RNA聚合酶可能会加速癌症的发生,因为它们是细胞癌变的必需因子,促使非编码RNA过表达[16]。上述结果都解释了PLAC1在结肠癌中可能是一个功能性分子,用于跟踪结肠癌患者的疾病进展,而且血清PLAC1作为结肠癌生物标志物的应用值得进一步研究。
综上所述,我们的研究发现PLAC1在结肠癌组织和血清中的表达量显著升高,而且PLAC1高表达与淋巴结转移及TNM分期升高有关,检测血清PLAC1水平对于结肠癌诊断和预测淋巴结转移风险都能够提供一定的可参考信息。

