DEHP与DBP联合染毒对雌性大鼠糖代谢的影响
郭 琛,李丽萍,张亚娟,李 玲,德小明,刘贺荣,杨惠芳
(宁夏医科大学公共卫生与管理学院,银川 750004)
2型糖尿病(type 2 diabetes mellitus,T2DM)的发病率逐年上升,据国际糖尿病联盟(the international diabetes federation,IDF)数据显示,我国是全球糖尿病患者数量最多的国家[1]。作为一种内分泌干扰物—邻苯二甲酸酯类物质(phthalic acid esters,PAEs),又名增塑剂[2-3],常作为添加剂添加到食品包装材料、儿童玩具等各种材料中,其主要作用是增加材料的可塑性和柔韧性[4]。邻苯二甲酸二(2-乙基己基)酯(di-2-ethylhexyl phthalate,DEHP)的使用量约占我国PAEs总使用量的50%,是使用量最高的一种增塑剂,其次是邻苯二甲酸二丁酯(di-n-butyl phthalate,DBP)[5-6]。研究表明[7-8],PAEs有干扰内分泌系统环境雌激素的效应,糖尿病虽与遗传和生活方式有关,但环境内分泌干扰物的作用也不容忽视。研究[9-10]发现,PAEs对生殖异常、性别分化、神经发育和肿瘤等的发生有一定的影响,近年来PAEs对胰岛素抵抗、T2DM等慢性糖代谢紊乱疾病的研究成为热点。
在糖尿病发生发展过程中胰岛β细胞损伤和胰岛素抵抗发挥着重要作用[11],有研究[12]表明,氧化应激导致胰岛β细胞凋亡是胰岛β细胞功能受损的主要原因,而长期低剂量暴露于PAEs可诱发体内过氧化物的聚集而引起损伤[13]。流行病学调查表明[14],PAEs与胰岛素抵抗、T2DM间有一定的相关性,但有关实验研究相对较少,且人类在暴露过程中并非单一介质暴露。为此本研究采用DEHP、DBP以及二者联合染毒,观察对大鼠胰腺组织中凋亡蛋白的影响,以探讨DEHP、DBP以及二者联合染毒对T2DM的作用及其机制。
1 资料与方法
1.1 主要试剂与仪器
DEHP、DBP(国药集团化学试剂有限公司),玉米油(金龙鱼),血糖仪、血糖试纸(艾科灵睿,中国),大鼠胰岛素ELISA测定试剂盒(武汉伊莱瑞特生物科技有限公司,中国),超氧化物歧化酶(super oxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)测试盒(南京建成生物工程研究所,中国),Bax、Bcl-2、Caspase 9、Caspase 3兔抗大鼠一抗(Proteintech,美国),GAPDH内参(Bioss,中国),二抗山羊抗兔(中杉金桥,中国),聚偏二氟乙烯(PVDF)膜(Invitrogen,美国),酶标仪(Bio-Rad,美国)。
1.2 实验动物
选择40只健康清洁级SD雌性大鼠,3周龄,体质量50~70 g,由宁夏医科大学实验动物中心提供,动物合格证号:SCXK(宁)2015-0001。饲养房间温度为(22±3)℃,相对湿度(60±5)%,通风良好,24 h昼夜循环光照条件下饲养,自由饮水、进食。
1.3 分组与处理
将大鼠随机分为4组,分别为对照(玉米油)组、DEHP染毒组(1/40 LD50,750 mg·kg-1)、DBP染毒组(1/40 LD50,500 mg·kg-1)和DEHP+DBP(750+500)mg·kg-1染毒组(联合染毒组),每组10只。将DEHP和DBP溶于玉米油,配制成所需浓度的溶液。每天根据大鼠的体质量计算大鼠的给药剂量,采用灌胃方式染毒,1次/d,每周5 d,连续染毒8周,之后观察和测定相关指标。
1.4 观察指标
1.4.1 大鼠一般状况、体质量 于染毒期间,每周称量大鼠体质量1次,并观察大鼠毛发、皮肤、精神状态以及行为方面有无变化。
1.4.2 器官系数的测定[15]于末次染毒过夜禁食12 h后先称大鼠体质量,后使用10%水合氯醛腹腔注射麻醉大鼠,心尖取血后处死,将血液样本置于低温离心机中离心15 min(3 500 r·min-1)后取上清,保存于-80℃待测;同时取出胰腺,将其放在生理盐水中冲洗,在滤纸上拭干后称量湿重。器官系数(%)=器官质量/体质量×100%。
1.4.3 大鼠空腹血糖、胰岛素水平测定、胰岛素抵抗指数(homeostasis model assessment of insulin resistance,HOMA-IR)和敏感指数计算 大鼠末次染毒后禁食(不禁水)至少12 h将大鼠剪尾,用血糖仪检测大鼠空腹血糖;采用ELISA法检测大鼠血清空腹胰岛素水平,严格按照试剂盒规范进行。并计算稳态模型HOMA-IR和胰岛素敏感指数(insulin sensitivity index,ISI)[16]。HOMA-IR=空腹胰岛素(mIU·L-1)×[空腹血糖(mmol·L-1)/22.5]。ISI=1/Ln[空腹胰岛素(mU·L-1)×空腹血糖(mmol·L-1)]。
1.4.4 血清SOD活力和MDA含量测定 采用SOD、MDA试剂盒测定大鼠血清中SOD活力和MDA含量,严格按照说明书步骤进行操作。
1.4.5 Western blot法测定胰腺组织中Bax、Bcl-2、Caspase 9、Caspase 3蛋白表达水平 取约100 mg胰腺组织,置于冰上加入1 mL的组织裂解液匀浆,12 000 r·min-1,4℃离心10 min取上清,BCA法测定蛋白含量,根据不同分子质量选择相应浓度的SDS-PAGE凝胶,80 V稳定电压电泳(蛋白上样量为60μg),转膜条件采用0.22μm PVDF膜湿转,5%的脱脂牛奶(TBST溶液配制)封闭1.5 h后敷上不同浓度的一抗,4℃过夜,漂洗液清洗3次,二抗(1∶2 000)封闭1.5 h,漂洗液洗涤3次后在避光的条件下曝光,扫描图像后用Image J软件计算各条带的吸光度值。
1.5 统计学方法
采用SPSS 24.0统计学软件进行数据分析,计量资料用均数±标准差(±s)表示,组间比较采用单因素方差分析,两两比较采用LSD-t法。P≤0.05为差异有统计学意义。
2 结果
2.1 DEHP、DBP及联合染毒对大鼠一般情况的影响
随着实验的进行,三组染毒组大鼠被毛无光泽、个别有少量脱毛现象,并在灌胃过程中出现烦躁抵触现象。
2.2 DEHP、DBP及联合染毒对大鼠体质量的影响
各组大鼠体质量随染毒时间的延长而增加,不同时间各组大鼠体质量差异均无统计学意义(P均>0.05),见图1。

图1 DEHP、DBP及联合染毒对大鼠体质量的影响
2.3 DEHP、DBP及联合染毒对大鼠胰腺质量及器官系数的影响
与对照组比较,DEHP、DBP单独染毒及DEHP+DBP联合染毒组雌性大鼠胰腺的质量和器官系数差异均无统计学意义(P均>0.05),见表1。
表1 DEHP、DBP及联合染毒对大鼠胰腺质量及其器官系数的影响(±s)

表1 DEHP、DBP及联合染毒对大鼠胰腺质量及其器官系数的影响(±s)
?
2.4 DEHP、DBP及联合染毒对大鼠空腹血糖、胰岛素水平、HOMA-IR、ISI指标的影响
染毒第8周末,各组大鼠空腹血糖差异均无统计学意义(P均>0.05)。胰岛素水平、HOMA-IR和ISI各组差异均有统计学意义(P均<0.05);与对照组相比,联合染毒组血清胰岛素浓度升高,HOMA-IR增加,ISI降低(P均<0.05),见表2。
表2 各组大鼠空腹血糖、胰岛素水平、HOMA-IR、ISI的比较(±s)
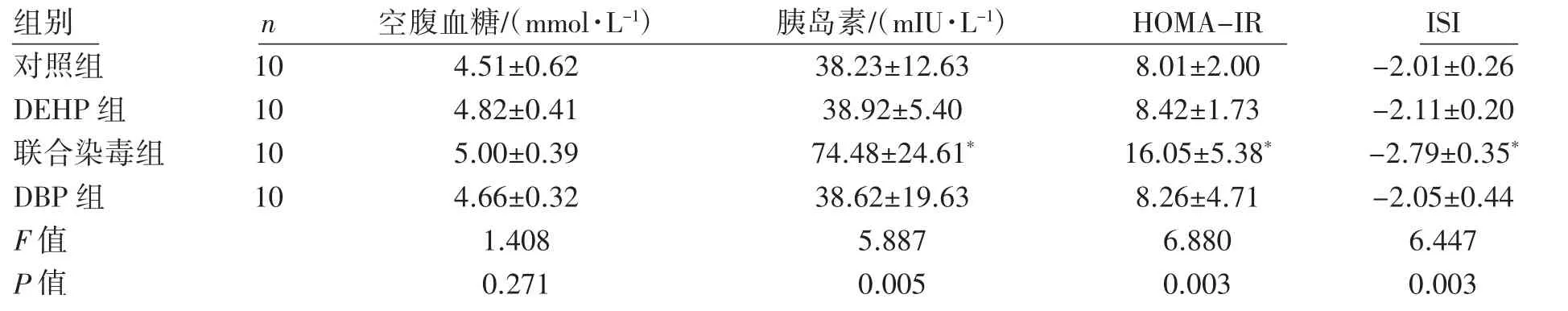
表2 各组大鼠空腹血糖、胰岛素水平、HOMA-IR、ISI的比较(±s)
与对照组相比*P<0.05。
组别 n 空腹血糖/(mmol·L-1) 胰岛素/(mIU·L-1) HOMA-IR ISI对照组 10 4.51±0.62 38.23±12.63 8.01±2.00 -2.01±0.26 DEHP组 10 4.82±0.41 38.92±5.40 8.42±1.73 -2.11±0.20联合染毒组 10 5.00±0.39 74.48±24.61* 16.05±5.38* -2.79±0.35*DBP组 10 4.66±0.32 38.62±19.63 8.26±4.71 -2.05±0.44 F值 1.408 5.887 6.880 6.447 P值 0.271 0.005 0.003 0.003
2.5 DEHP、DBP及联合染毒对大鼠血清中SOD活力和MDA含量的影响
染毒8周后,与对照组相比,DEHP、DBP单独染毒和联合染毒组大鼠血清SOD活力下降、MDA含量升高(P均<0.05),见图2。

图2 DEHP、DBP及联合染毒对雌性大鼠血浆氧化损伤指标的影响(n=10,±s)
2.6 DEHP、DBP及联合染毒对大鼠胰腺组织中凋亡蛋白表达的影响
染毒8周后,与对照组相比,DEHP、DBP单独染毒和联合染毒组均使Bax、Caspase 9、Caspase 3蛋白表达水平增加,Bcl-2蛋白表达水平及Bcl-2/Bax的比值下降(P均<0.05),见图3。
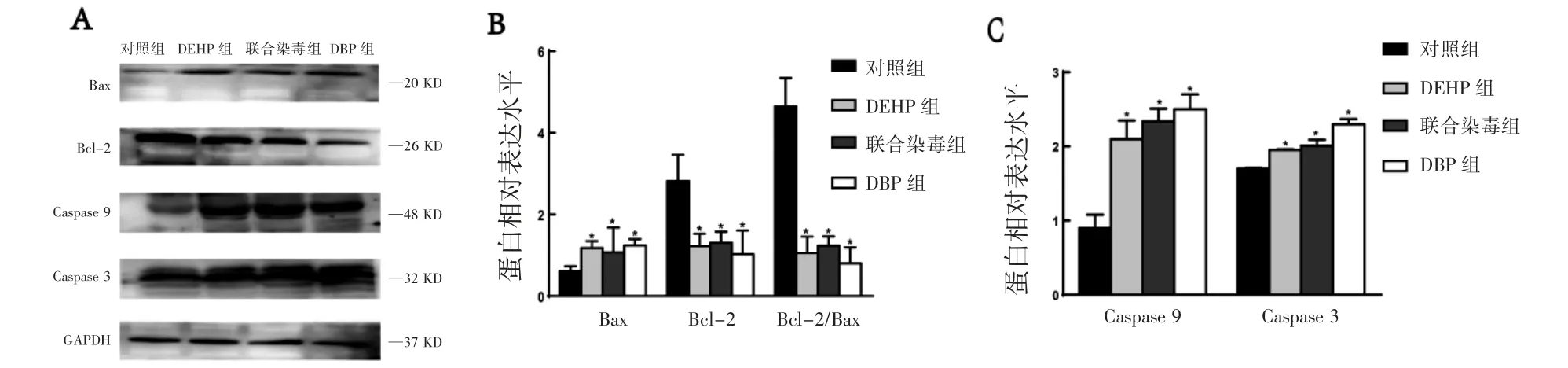
图3 DEHP、DBP及联合染毒对大鼠胰腺组织中凋亡蛋白表达的影响(n=3,±s)
3 讨论
研究发现,环境内分泌干扰物对人类健康造成多种危害,并且多数情况以多种物质混合的形式接触[17],而作为最常见的内分泌干扰物的DEHP和DBP与代谢紊乱有关[18]。本次实验结果表明,DEHP、DBP以及联合染毒对雌性大鼠体质量增长、胰腺组织的质量和器官系数没有影响,提示在此剂量下和染毒期间内DEHP、DBP以及联合染毒对雌性大鼠体质量增长和胰腺组织无明显作用。T2DM主要表现为胰岛素抵抗和胰岛β细胞功能受损。本次研究结果显示,两种药物联合染毒后,胰岛素浓度、HOMA-IR增加,ISI降低,提示DEHP和DBP联合染毒可能会引起雌性大鼠发生胰岛素抵抗。研究[19]表明,在引起糖尿病的过程中起决定作用的是胰岛β细胞功能受损。氧化应激对于诱导β细胞功能异常至关重要。Tanaka等[20]研究表明,分离人胰岛和胰岛β细胞暴露于高葡萄糖浓度会导致细胞内过氧化物水平升高。正常细胞内的促氧化物和抗氧化物维持在平衡状态,有研究[21-22]表明DEHP、DBP可打破机体内氧化-抗氧化的平衡机制,进而使机体进入氧化应激状态。研究[22]发现,DEHP和DBP可诱发机体脂质过氧化水平增强,氧化应激水平增高,从而对机体造成危害。本次实验结果表明,DEHP、DBP单独染毒与两者药物联合染毒均可使SOD活力降低、MDA含量增加。
细胞凋亡是由多基因调控的,在生理或病理情况下细胞程序性死亡[23]。研究[24]表明在线粒体凋亡途径上促凋亡蛋白(如Bax等)和抗凋亡蛋白(Bcl-2等)发挥着重要作用,而Bcl-2/Bax称为“凋亡开关”,决定细胞是否进入凋亡状态[25]。参与细胞凋亡的Caspase家族是一组存在于细胞质中的特异性半胱氨酸蛋白酶,其中凋亡的启动者是Caspase 9,凋亡的主要执行者是Caspase 3[26]。本次实验结果表明DEHP、DBP单独染毒与两者药物联合染毒可使Bax、Caspase 9、Caspase 3蛋白表达增加,Bcl-2蛋白表达下降,Bcl-2/Bax比值下降。
综上所述,DEHP、DBP两种药物联合染毒可能降低SOD活力、增加MDA的含量使胰岛β细胞氧化应激水平增加,诱导胰岛β细胞凋亡。但此结论还需通过后续实验进一步的研究来加以证实。

