TXNRD1在肝细胞癌中活性氧相关细胞凋亡导致多药耐药性中的作用
李大志, 黄俊杰, 郑树森, 章爱斌
浙江大学医学院第一附属医院 a.多器官联合移植重点实验室, b.肝胆外科, 杭州 310000
肝细胞癌(HCC)在世界各地有着很高的发病率和死亡率,特别是在亚洲、非洲和南欧。目前,HCC已经成为全球第五大常见癌症和第三大癌症死亡原因[1]。在我国,HCC的发病率和死亡率分别排在第四位和第二位,且HCC患者预后在临床上仍不尽如人意[2]。对于那些无法手术的患者而言,化学药物治疗的效果常受到药物耐药性的限制,特别是多重耐药性(multi-drug resistance,MDR)[3]。
MDR的发生和发展是一个涉及多种因素的极其复杂的过程。先前研究[4]证实上皮/间质转化、ABC转运蛋白家族的表达、DNA损伤修复和药物外排蛋白的过度表达都与MDR密切相关。代谢扭曲和过度复制引起的过度氧化应激是癌细胞的共同特征[5]。目前,代谢重编程也被认为是癌症的标志。细胞信号通路的异常激活使癌细胞面临更大的氧化应激压力。随着细胞活性氧(ROS)蓄积,癌细胞只有增加抗氧化能力,才能对抗ROS诱导的细胞调亡[6]。硫氧还蛋白(TXN)、硫氧还蛋白还原酶(TXNRD)和还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)构成细胞内硫氧还蛋白系统(Trx),该系统对还原-氧化 (氧化还原) 稳态至关重要。TXNRD是一种含硒酶和NADPH依赖性黄素蛋白,可将氧化的TXN还原为其二硫醇形式以维持细胞氧化还原稳态[7]。NF-E2相关因子2 (Nrf2) 是一种重要的核转录因子,通过Nrf2/ARE通路调节包括TXNRD1 在内的众多细胞保护基因的表达[8]。有趣的是,在各种实体癌如HCC[9]、结肠直肠癌[10]、前列腺癌[11]中, Trx常常被激活并且TXNRD1过表达。此外,TXNRD1 可以作为HCC患者的预后因素[12]。
相关临床研究[13]也证实,癌细胞清除ROS的能力是癌症患者预后的指标之一。临床样本TXNRD1表达的增加与晚期临床分期和较差的患者存活率呈正相关。化疗药物通过破坏靶细胞中的氧化还原稳态,进一步导致细胞死亡以达到治疗效果。可以推测TXNRD1表达高的病例更有可能对化疗药物产生抗药性。TXNRD1抑制剂——金诺芬(AUR),由于其众所周知的安全毒性特征,该化合物被批准用于治疗类风湿关节炎。目前,AUR对于其他疾病(包括癌症、神经退行性疾病)的潜在治疗价值也在探索中[14]。
本研究拟通过siRNA敲低或AUR药物抑制TXNRD1的活性,探究TXNRD1在药物耐药性中发挥的作用,并通过N-乙酰半胱氨酸(NAC)进行ROS耗竭来探索ROS介导耐药性的可能机制。
1 材料与方法
1.1 细胞系和转染 人HCC细胞系BEL/FU和亲本细胞系BEL-7402购买于KeyGen Biotech Co., Ltd.(中国南京)。 BEL/FU细胞和BEL-7402细胞在含有10% FBS(BI, 以色列)的 RPMI-1640(BI,以色列)培养基中于5% CO2和37 ℃下培养。在具有50%细胞密度的 6孔板中进行转染。Lipofectamine 3000试剂(Thermo Scientific,美国)和Opti-MEM根据制造商的说明使用siRNA转染细胞。TXNRD1si-1上游引物:GCAAGACUCUGAAAUUUTT; TXNRD1si-1下游引物:AUAAUUUCGAGAGUCUUGCTT; TXNRD1si-2上游引物:GGA AGAACAUGGCAUCAAGUUTT; TXNRD1si-2下游引物:AACUUGAUGCCAUGUUCUUCCTT。然后,收集细胞用于基因表达测定。
1.2 集落形成试验 通过在6孔板中接种BEL/FU细胞进行集落形成试验。用5-氟尿嘧啶(5-Fu)、多柔比星(DOX)和AUR处理48 h后,将细胞在新鲜培养基中培养14 d。然后,将菌落用结晶紫染色进行计数。
1.3 药物细胞毒性和细胞增殖试验 化疗药物的细胞毒性由CCK-8法测定,计算药物半抑制浓度(IC50值),观察药物的细胞毒性。为了评估细胞增殖,将BEL/FU细胞(2×103个/孔)置于96孔板中,并在0、24、48、72和96 h通过CCK-8试剂(DOJINDO Laboratories,日本)检测,操作依据试剂的操作说明。
1.4 蛋白质印迹 RIPA缓冲液(Thermo Scientific,美国)和BCA 蛋白质检测试剂盒(Thermo Scientific,美国)用于检测蛋白质浓度。将30 μg蛋白质加载到4%~20% SDS-PAGE(Life Technology,USA)上进行分离,然后转移到0.2 μm PVDF膜(Millipore,USA)上, 5%脱脂牛奶封闭2 h后,将膜与适当的一抗 (1∶1000) 在4 °C下孵育过夜。随后,将条带洗涤并与相应的HRP偶联二抗 (1∶5000) 一起孵育。通过 EZ-ECL(Biological Industries, 以色列) 检测蛋白质表达。使用Image Lab软件分析条带密度以量化蛋白质量。
1.5 ROS检测 收获细胞并用PBS洗涤。然后,将细胞重新悬浮在PBS中,并与2 μL CellROX Green Reagent(Thermo Scientific,美国)共孵育30 min。通过流式细胞术测量细胞内ROS水平,结果以荧光强度表示。
1.6 RNA分离和实时定量PCR(RT-PCR) 使用TRIzol试剂(Invitrogen)从细胞系中提取总RNA。 PrimeScript RT-PCR试剂盒(TaKaRa Biotechnology,中国)用于逆转录。 SYBR Green PCR 试剂(TaKaRa)用于使用Bio-Rad PCR仪器(CA,美国)进行RT-PCR。所用引物见表1。

表1 引物序列
1.7 异种肿瘤移植模型测定 为了探究TXNRD1在体内耐药机制中发挥的作用,从杭州子源实验动物科技有限公司购买了4周大的免疫缺陷裸鼠[许可证:SCXK(浙)2019-0004]构建了异种肿瘤移植模型。将5×106个BEL/FU细胞皮下接种到每只小鼠的右胁腹中。 接种3 d后,小鼠接受药物治疗。肿瘤体积的计算公式为:体积=(长×宽×宽)/2。当肿瘤体积大于2000 mm3或者达到观察终点时,处死小鼠。
1.8 伦理学审查 研究中的所有动物实验程序均获得浙江大学医学院第一附属医院实验动物伦理委员会的批准,批号:(2020)实动快审第(7-1)号。
1.9 统计学方法 使用SPSS 21.0软件进行统计分析。计量资料两组间比较采用独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 TXNRD1在HCC组织和多重耐药细胞系BEL/FU中的表达情况 通过癌症基因组图谱(TCGA)数据集分析证实 TXNRD1在癌组织中高表达,与正常肝组织相比,HCC组织中TXNRD1的mRNA水平显著上调(P<0.001)(图1a)。病理分级Ⅲ、Ⅳ级患者的TXNRD1表达水平高于病理分级Ⅰ、Ⅱ级的患者(P=0.006)(图1b)。与正常细胞系LO2相比,HCC细胞系的TXNRD1在mRNA水平均明显上调(P值均<0.01)(图1c),蛋白表达水平与mRNA表达趋势一致(P值均<0.05)(图 1e)。BEL/FU细胞系和BEL-7402细胞系中5-Fu和DOX的IC50值具有明显差异(P值均<0.001)(图1f、g)。BEL/FU细胞中的TXNRD1较亲本BEL-7402细胞在mRNA水平上调(P=0.004)(图1d),蛋白表达水平与mRNA表达趋势一致(P<0.05)(图1h)。蛋白免疫印迹结果显示,BEL/FU细胞系中的Nrf2水平较亲本BEL-7402细胞系在胞质蛋白中无明显差异(P=0.693),而胞核蛋白中水平较高(P<0.05)(图1i)。
2.2 TXNRD1抑制使BEL/FU细胞对5-Fu和DOX敏感 为了探究TXRND1的功能,利用 siRNA沉默TXNRD1在BEL/FU细胞中的表达。在设计的siRNA中,TXNRD1-1 (si-1#) 和TXNRD1-2 (si-2#) 在抑制TXNRD1表达方面最有效,且可特异性敲低TXNRD1的mRNA水平(P值均<0.001),而不影响TXNRD2和TXNRD3的mRNA水平(P值均>0.05)(图2a)。对不同细胞系中TXNRD1蛋白的表达进行检测,结果也证实了si-1#和si-2#明显抑制了TXNRD1蛋白的表达(P值均<0.05)(图2b)。si-1#和si-2#细胞在5-Fu (1000 μmol/mL)和DOX(5 μmol/mL)干预下,细胞活力显著低于si-Ctrl(P值均<0.05)(图2c、d)。在5-Fu (1000 μmol/mL)和DOX(5 μmol/mL)的处理下,si-1#和si-2#细胞克隆形成均较si-Ctrl明显减少(DOX:P值均<0.001;5-Fu:P值分别为0.043、0.015)(图2e)。

注:a,正常肝组织和HCC组织中TXNRD1的mRNA水平(TCGA数据集); b,不同病理分级患者的TXNRD1表达水平;c,正常肝细胞LO2和HCC细胞中TXNRD1的mRNA水平;d,BEL/FU和BEL-7402细胞系中TXNRD1的mRNA水平;e,HCC细胞系和LO2中TXNRD1的蛋白质水平;f、g,BEL/FU和BEL-7402细胞系中5-Fu、DOX的IC50值;h,BEL/FU和BEL-7402细胞系中TXNRD 1的蛋白水平;i,BEL/FU和BEL-7402细胞系中的Nrf2表达水平。CP,细胞质蛋白,NP,核蛋白。
2.3 siRNA敲低TXNRD1通过破坏细胞内氧化还原稳态重塑药物敏感性 ROS抑制剂NAC是常用的ROS清除剂。经体外流式细胞术检测,si-1#和si-2#细胞的ROS水平较si-Ctrl明显升高(P值均<0.001),经过NAC (0.5 mmol/L)处理24 h后,细胞的ROS水平均有所下降(P值均<0.001)(图3a)。当BEL/FU细胞中的TXNRD1被si-1#和si-2#敲低时,经5-Fu(1000 μmol/mL)作用24 h后,细胞凋亡比例明显增加(P值均<0.001);同期进行NAC(0.5 mmol/L)干预,可以降低BEL/FU细胞凋亡比例(P值均<0.001)(图3b)。经DOX (5 μmol/mL)作用24 h后,细胞凋亡比例明显增加(P值均<0.001);同期进行NAC(0.5 mmol/L)干预,可以降低BEL/FU细胞凋亡比例(P值均<0.001)(图3c)。蛋白免疫印迹结果证实,si-Ctrl细胞内Caspase-3、Survivin蛋白的表达水平及Bcl-2 /Bax比率均较BEL/7402细胞、si-1#和si-2#细胞升高(P值均<0.05)(图4)。

注:a,BEL/FU细胞系si-Ctrl、si-1#、si-2#中TXNRD1、TXNRD2、TXNRD3的mRNA水平;b,BEL/FU细胞系未处理组、si-Ctrl、si-1#、si-2#中TXNRD1的蛋白质水平;c、d,BEL/FU细胞系si-Ctrl、si-1#、si-2#应用DOX、5-Fu药物后的OD450 nm吸光度曲线;e,BEL/FU细胞系si-Ctrl、si-1#、si-2#应用DOX、5-Fu药物后的细胞克隆集落形成。

注:a,BEL/FU细胞系si-Ctrl、si-1#、si-2#、si-1#+NAC、si-2#+NAC细胞内ROS含量; b,BEL/FU细胞系si-Ctrl、si-1#、si-2#应用5-Fu或5-Fu联合NAC后细胞凋亡比例;c,BEL/FU细胞系si-Ctrl、si-1#、si-2#应用DOX或DOX联合NAC后细胞凋亡比例。

图4 BEL/7402和BEL/FU细胞系中细胞凋亡相关的蛋白质表达
2.4 AUR是BEL/FU细胞的有效药物增敏剂 AUR对TXNRD1具有抑制作用。BEL/FU细胞和BEL-7402细胞对AUR的药物敏感性(IC50值)差异无统计学意义(P=0.153)(图5a)。经AUR (0.3 μmol/L) 处理后BEL/FU细胞系中5-Fu与DOX的IC50值明显下降(P值均<0.01)(图5b、c)。BEL/FU细胞在AUR(0.3 μmol/L)与5-Fu(1000 μmol/mL)不同分组处理条件下细胞活力变化如图所示(图5d)。在AUR(0.3 μmol/L)联合DOX(5 μmol/mL)处理组细胞克隆形成较DMSO、DOX(5 μmol/ml)组明显减少(P值均<0.001)(图5e);在AUR(0.3 μmol/L)联合5-Fu(1000 μmol/mL)处理组细胞克隆形成较DMSO、5-Fu组(1000 μmol/mL)明显减少(P值均<0.001)(图5f)。相同浓度下BEL /FU细胞经AUR联合5-Fu处理后细胞凋亡比例较5-Fu处理组明显升高(P<0.001),AUR联合DOX较DOX处理组也明显升高(P<0.001)(图6、7)。

注:a,BEL/7402、BEL/FU细胞系对药物AUR的IC50; b,BEL/FU细胞系在应用AUR前后对5-Fu的IC50;c,BEL/FU细胞系在应用AUR前后对DOX的IC50;d,BEL/FU细胞系在应用DMSO、AUR、5-Fu、AUR+5-Fu药物后的OD450 nm吸光度曲线;e,BEL/FU细胞系在应用DMSO、DMSO+DOX、DMSO+AUR、AUR+DOX药物后的细胞克隆集落形成;f,BEL/FU细胞系在应用DMSO、DMSO+5-Fu、DMSO+AUR、AUR+5-Fu药物后的细胞克隆集落形成。
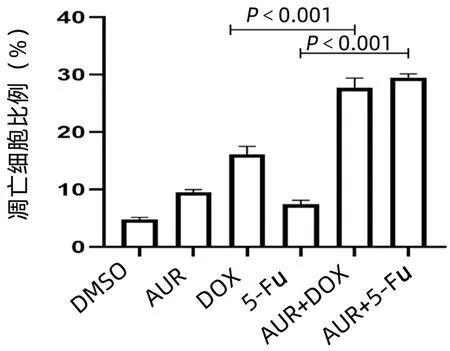
图7 不同分组BEL/FU细胞的调亡比例比较
2.5 AUR可有效改善BEL/FU细胞体内5-Fu耐药性 通过将BEL/FU细胞接种在免疫缺陷小鼠的皮下,构建异种移植模型,对AUR的体内治疗效果进行评估。用DMSO、AUR(6 mg·kg-1·d-1,皮下注射)、5-Fu(25 mg·kg-1·d-1,皮下注射)或药物联合处理对接种BEL/FU细胞的异种移植物小鼠进行分组并进行处理观察9 d。不同分组在观察终点的肿瘤大小如图8a所示,不同分组的肿瘤生长曲线如图8b所示。观察终点时,AUR处理组与DMAO处理组相比,肿瘤治疗无统计学差异(P=0.063),AUR联合5-Fu组较单一5-Fu处理组抑制肿瘤生长的能力明显提升(P<0.001)(图8c)。观察终点时,AUR联合5-Fu组较单一5-Fu处理组肿瘤质量明显缩小(P<0.001)(图8d)。观察期间各组小鼠体质量变化曲线如图8e所示。
3 讨论
感染、紫外线、烟草、酒精等外界因素的干扰会导致细胞内ROS水平升高,而这些因素亦是导致癌症的因素。以往的研究[15]表明,癌症的发生、进展、血管生成和转移与ROS密切相关。由于癌细胞的代谢活性增强和信号通路的异常激活,使它们具有比正常细胞更高的基础ROS水平[16]。因此,癌细胞需要更完善和可靠的ROS消耗途径来应对由细胞内较高ROS水平引起的氧化应激,以避免细胞凋亡[17]。更重要的是,传统的抗肿瘤药物和放疗作为经典的抗肿瘤方法会增加癌细胞中的ROS水平。这些干预措施会导致DNA损伤、细胞周期停滞甚至细胞凋亡,但癌细胞强大的抗氧化系统可以保持细胞内氧化还原稳态,因此这些治疗措施难以达到理想的效果。
5-Fu与DOX作为临床化疗药物的常见选择,耐药现象的出现往往使化疗不能取得理想的治疗效果。笔者先前的研究[18-19]也证实,源自BEL-7402细胞系的BEL/FU细胞对5-Fu和DOX具有稳定的耐药性,为了研究耐药相关的分子机制,笔者选取了实验室保存的肝癌细胞BEL-7402的5-Fu与DOX多重耐药株BEL/FU细胞,并发现TXNRD1在BEL/FU细胞中表达升高;通过siRNA下调TXNRD1蛋白的表达水平后,BEL/FU细胞对药物5-Fu与DOX的敏感性明显增加。结合先前研究结果,笔者认为在肝癌细胞中TXNRD1表达上调可能通过增强DNA的损伤修复能力从而增加了细胞对药物5-Fu与DOX的耐受性;而TXNRD1的抑制则干扰了dNTPs库,从而干预了DNA的损伤修复,或者通过 Bcl-2/Caspase信号通路诱导细胞凋亡,从而增强了细胞对药物的敏感性。

注:a,经DMSO、AUR、5-Fu、AUR+5-Fu处理后,BEL/FU成瘤大体图片; b,经DMSO、AUR、5-Fu、AUR+5-Fu处理后,BEL/FU肿瘤体积变化曲线;c,经5-Fu、AUR+5-Fu处理后,BEL/FU肿瘤观察终点时体积; d,经DMSO、AUR、5-Fu、AUR+5-Fu处理后,BEL/FU肿瘤观察终点时质量;e,经DMSO、AUR、5-Fu、AUR+5-Fu处理后,裸鼠体质量变化曲线。
AUR是一种临床上用于治疗风湿性关节炎的药物,能够有效抑制TXNRD1的活性。许多研究表明AUR在癌症治疗中具有良好的耐受性和安全性。单独干预TXNRD1和/或与传统的抗肿瘤方法(药物治疗、放疗等)结合来干扰癌细胞中氧化还原稳态是一个可行的策略。这一发现不仅见于实体瘤,如乳腺癌[20]、肝癌[21],也见于血液系统肿瘤[22]。本研究结果证实TXNRD1是干预耐药癌细胞氧化还原稳态的合适靶点,这为对化疗药物耐药的患者提供了一个新的选择。TXNRD1表达水平与HCC预后之间的密切关系表明它可作为治疗靶点[23]。此外,癌细胞的基础 ROS水平高于正常细胞,使它们更容易受到这种干预。此外,TXNRD1的肝细胞特异性敲除不影响肝脏生长和再生率[24],即AUR作为 TXNRD1抑制剂不影响肝脏正常功能,而是选择性靶向癌细胞。
抗氧化剂广泛存在于食用的各种饮食原材料中。但每天摄入的抗氧化剂如何影响癌症的发病机制仍有待探索。更重要的是,以往关于抗氧化剂摄入量对癌症患者影响的研究结论还需要进一步证实[25]。目前,关于抗氧化剂补充剂与癌症之间关系的大型随机临床试验也产生了相互矛盾的结果[26]。比如补充抗氧化剂如维生素E已被证明会促进前列腺癌的发展,这表明抗氧化剂会增加患癌症的风险[27]。
Trx在癌细胞中调节耐药性的途径有很多,并且相互关联[28]。考虑到肿瘤细胞对药物的反应是一个环境依赖的过程,受微环境、细胞类型和状态等多种因素的调控。需要进一步的研究来证实AUR作为新兴的TXNRD1拮抗剂与恶性肿瘤化疗药物之间的相互作用机制。
综上所述,化疗药物引起的细胞内ROS水平升高会损害癌细胞,耐药细胞中TXNRD1的表达上调缓解了ROS的蓄积压力并维持了细胞内氧化还原稳态,从而阻断与细胞凋亡相关的细胞死亡过程,导致药物耐药性的产生。
利益冲突声明:本研究不存在研究者、伦理委员会成员、 受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:章爱斌负责文章整体构思和设计;李大志负责数据分析,撰写论文;黄俊杰参与撰写及修改论文;郑树森、章爱斌负责指导撰写文章并最终定稿。

