云南玉米穗腐病致病菌鉴定与共生群落分析
吴 畏, 田宇昂, 白宇汐, 梁琳悦, 余 洋, 梁鹏宽,蒋中华, 石海春, 柯永培, 孙 群
(1.四川大学生命科学学院 生物资源与生态环境教育部重点实验室,四川 成都 610064; 2.四川大学生命科学学院,四川 成都 610064; 3.四川省农业科学院 国家农业微生物成都观测实验站,四川 成都 610066;4.四川农业大学农学院,四川 温江 611130)
0 引 言
玉米是一种重要的经济作物,如果因病害大规模减产将可能威胁国家粮食战略安全。而玉米穗腐病是一种广泛发生的玉米病害,在亚洲、欧洲、美洲等主要玉米种植区都有报道[1]。一般玉米品种该病发病率为5%~10%,部分易感品种发病率超过50%[2]。该病会使患病玉米的果穗、籽粒等腐烂,种子的发芽率和幼苗的成活率降低[3-4]。该病据报道有多种致病菌,主要为真菌,如镰孢菌 (Fusariumspp)、曲霉菌 (Aspergi1usspp)、根霉菌 (Rhizopusspp) 等,在不同区域主要致病菌有差异[5-7],并且也可以导致玉米茎腐病的发生[1,8]。
在中国,引起玉米穗腐病的主要致病菌为镰孢菌,其中拟轮枝镰孢菌 (Fusarium verticillioides) 和禾谷镰孢复合种 (Fusarium graminearumclade) 为广泛分布的致病种;但在部分省份玉米种植区,串珠镰孢菌 (Fusarium moniliforme)、层出镰孢菌(Fusarium proliferatum) 和尖胞镰孢菌 (Fusarium oxysporum) 等也占有一定优势[3,9-17]。另外,镰孢菌属不同的种产毒能力和毒素类型有差异[18],对不同玉米品种的侵染能力也不同[15,19-20],所以防治穗腐病需先明确种植区当地的优势致病菌。2019年云南省玉米总产量920万吨[21],玉米穗腐病可能对当地玉米生产造成的损失不容忽视。然而对云南地区玉米穗腐病的发生情况缺乏报道[13],其主要致病菌尚不清楚,因此需要对当地玉米穗腐病的主要致病菌进行鉴定。本研究在云南玉米穗腐病害严重地区采集染病玉米样本,所采集样本品种均为某云南大面积播种的高产品种;品种接种鉴定显示对大斑病、小斑病、南方锈病等常见作物疾病有较高抗性,但易感穗腐病。因此对该玉米品种发生穗腐病的患病情况进行鉴定,可以表征云南玉米穗腐病害严重地区玉米感病的情况。
另外,传统的研究主要利用分离纯化然后培养鉴定的方式来确定致病菌,但是由于大量微生物难以在培养基上纯化培养,这种方法往往会低估环境中的生物多样性[22],也无法明确致病菌及其共生群落的构成。近年来,以环境中微生物宏基因组DNA 信息为基础,通过PCR-RFLP[23]、PCR-SSCP[24]、高通量测序[25]等方法来研究环境中微生物的组成成为一种更加便捷、全面、准确的研究方式。另外,由于玉米穗腐病的主要致病菌为真菌[1,5],并且真菌的核基因组 rDNA的内转录区间ITS (internal transcribed spacer) 序列长度适中、进化速率较快,常用于真菌种属鉴定、分型和多态性研究[26];所以通过对群落DNA的ITS序列进行测序,获得的信息可以用来研究玉米穗腐病主要致病菌及其共生真菌群落组成。
本研究通过分离纯化、形态学鉴定、致病性测定等传统的鉴定验证方法和基于Pacbio Sequel三代测序平台的SMRT (Single Molecule Real-Time)测序技术的群落组成谱分析两种方式,来研究云南省玉米穗腐病害严重地区玉米所患穗腐病主要致病菌及其共生群落组成;并通过文献来源的玉米穗腐病致病菌鉴定数据进行空间插值分析来研究中国穗腐病致病菌的分布从而了解该病主要致病菌的流行特征。
1 材料与方法
1.1 玉米样品
发生穗腐病的玉米样品于2019年采集自云南省楚雄彝族自治州禄丰县 (海拔:1 659 m;经纬度:25°N,102°E),共 10 份,均为完整的新鲜玉米棒。
1.2 主要致病菌的分离纯化和形态学鉴定
剥离少量发病部位 (玉米籽粒和穗轴) 的玉米材料,75%酒精浸泡10 s,用0.1%升汞消毒5 min,用无菌水冲洗2次,放置于马铃薯葡萄糖琼脂(PDA) 平板上,于18 ℃下培养7 d,挑取菌落边缘菌丝于新的PDA平板保存。利用稀释法进行单胞分离[27-28]。将分离的菌株接种于PDA平板上,18 ℃下培养14 d,观察菌落形态,并在光学显微镜下观察菌丝和孢子特征,与相关文献中穗腐病致病菌的描述进行比较。
1.3 主要致病菌的致病性测定
将分离培养于PDA平板上的菌株用打孔器(直径5 mm) 取菌饼分别接种到相同品种新鲜玉米的穗、籽粒和穗轴,18 ℃套袋培养14 d,观察发病情况。设置空白对照和重复组。取发病部位的玉米材料,用75%酒精浸泡10 s,再用0.1%升汞消毒3~5 min,用无菌水冲洗2次,放置于PDA平板上,于18 ℃下培养7 d,观察再次分离得到的菌株和原来接种的菌株是否存在形态学上的差异。
1.4 真菌总DNA提取、ITS序列的扩增和测序
分别从玉米籽粒和穗轴患病部位各取两份菌落样本 (取自籽粒的菌落样本编号为:Z1,Z2;取自穗轴的菌落样本编号为:B1,B2)。按照E.Z.N.A.®Fungal DNA Mini Kit (OMEGA bio-tek,美国) 试剂盒的步骤说明,提取菌落中的真菌总DNA。对提取到的总DNA采用紫外分光光度计进行浓度和纯度检测,并采用0.8%琼脂糖凝胶电泳进行DNA完整性检测。使用ITS序列引物ITS1 (TCCGTAGGTGAACC TGCGG) 及ITS4 (TCCTCCGCTT ATTGATATGC)对获得的DNA模板进行序列扩增。PCR反应体系为 25 μL,包括 12.5 μL Premix Taq,1 μL 引物 ITS1(10 μmol/L),1 μL 引物 ITS4 (10 μmol/L),1 μL 模板 DNA,由灭菌 ddH2O 补至 25 μL。95 ℃ 预变性3min,95 ℃ 变性 30 s,57 ℃ 退火 30 s,72 ℃ 延伸2 min,反应循环数为30,最后72 ℃延伸8 min。采用Pacbio Sequel三代测序平台对扩增后的DNA片段进行SMRT (Single Molecule Real-Time) 测序。采用perl脚本根据序列两端的barcode序列进行分样,并去除barcode,再根据引物序列将反向互补序列转置为正向序列。测序公司为上海派森诺生物科技有限公司。
1.5 生物信息学和数据分析
1.5.1 序列过滤及操作分类单元 (OTU) 聚类
序列过滤及聚类这一过程使用Vsearch(v2.13.4_linux_x86_64) 和 cutadapt (v2.3) 软件进行序列过滤和聚类。首先切除序列的引物片段,弃去未匹配引物的序列;之后拼接序列并进行质控;去除重复序列。在98%相似度水平对去重后的序列聚类,去除嵌合体;再使用perl脚本(https://github.com/torognes/vsearch/wiki/VS EARCH-pipeline),过滤质控后序列集中的嵌合体,从而获得高质量序列;在97%相似度水平对高质量序列聚类,并分别输出代表序列和OTU表。最后,去除OTU表格中的singletons OTU及其代表序列。
1.5.2 生物信息学分析
物种分类学注释利用QIIME2 (2019.4) 软件和UNITE数据库 (Release 8.0,https://unite.ut.ee/)。采用 QIIME2的 classify-sklearn算法 (https://github.com/QIIME2/q2-feature-classifier),对每个 OTU的代表序列,在QIIME2软件中使用默认参数,使用预先训练好的Naive Bayes分类器进行物种注释。使用去除singleton后的OTU特征表,实现各样本在门和属分类水平上的组成分布的可视化,并以柱状图呈现分析结果。在每个样本中筛选序列数>5的OTU,将这些OTU的代表序列与nr/nt数据库进行BLAST比对,将同一样本筛选出的代表序列和数据库中相似度最高的序列利用MEGA7 (v7.0.26) 共同构建Neighbor-Joining进化树,并以每个样本筛选出的OTU对应的全部序列数占总序列数比例作柱状图来呈现各样本在种水平上的主要物种的组成分布。
利用QIIME2 (2019.4) 对OTU的丰度表进行抽平,抽平深度设为最低样本序列量的95%。通过对抽平后的OTU表格进行统计,获得每个样本中的微生物群落在各分类水平的具体组成表。利用QIIME2 (2019.4) 进行Alpha多样性以及稀释曲线分析,利用R脚本的VennDiagram包绘制OTU的Venn图。
1.6 中国玉米穗腐病致病菌分布分析
从30篇已发表的文献中获取中国21个省份(包含全部玉米主产区) 的5 483个穗腐病致病菌的分离鉴定结果[2-3,9-17,19-20,29-45],计算每种致病菌在各省份于全部致病菌中所占比例,并绘制饼状图;利用 ArcMap (v10.1) 进行 IDW (Inverse Distance Weighted) 空间插值分析,分析主要致病菌在中国各地区的分布。
2 结果与分析
2.1 主要致病菌的形态学鉴定和致病性测定结果
2019年从云南省楚雄彝族自治州禄丰县采集玉米感病样本,病穗呈现出腐烂状,患病部位籽粒腐烂,叶片表面可见白色菌丝体 (图1a)。从多个玉米样本患病部位 (籽粒和穗轴) 分离纯化获得的菌株在PDA培养基上18 ℃培养14 d,菌落平均直径为31 mm,菌丝呈丝绒状,在培养过程中菌落表面逐渐由白色变为灰紫色 (图2a),培养基背面从无色变为橙黄色、紫色,最终接近黑色。在光学显微镜下观察,小型分生孢子数量多,多链生,呈椭圆形或卵形,6~9 μm× 2.5~3 μm;无厚垣孢子;产孢细胞单瓶梗或复瓶梗 (图 2c,d)。经与郭成[2],丁梦军[11],张婷[40]以及许佳宁[31]的鉴定结果比较,其形态各项指标与拟轮枝镰孢菌相符。

图1 玉米穗腐病的田间采样标本 (a),致病性测定中表现出的穗部腐烂和籽粒、穗轴上的菌落 (b-d)
将分离得到的菌株接种于同一品种玉米的穗、籽粒和穗轴后,在穗部出现腐烂现象 (图1b),籽粒上在接种部位沿籽粒间缝隙出现白色絮状带紫红色的菌落 (图1c),穗轴出现紫红色粉状菌落 (图1d),与采集样本症状相似。将这些菌落中的菌株再次分离接种于PDA培养基,培养一定时间后所得菌落形态与之前分离的菌株一致 (图2b),可以认定为同种致病菌。因此,可以确认分离得到了导致样本玉米发生穗腐病的主要致病菌。
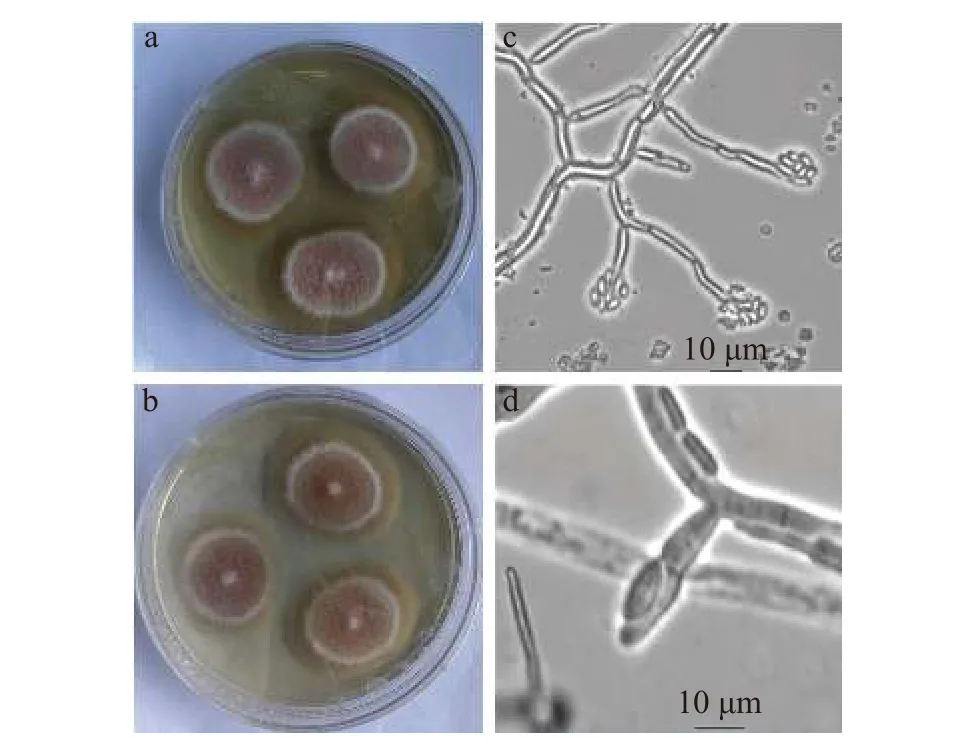
图2 分离菌株 (a) 和致病性测定中再次分离菌株 (b) 在PDA平板上的菌落形态,光学显微镜下小孢子 (c)以及产孢细胞 (d) 形态
2.2 序列过滤与质量控制
4 个样本 (B1、B2、Z1、Z2) 总体高质量序列数目比例达75.80%,在97%相似度水平对高质量序列聚类,总共得到150个OTU (表1)。单个样本中有效序列丰度大于1%的OTU数目较少,分别是6(B1)、7 (B2)、4 (Z1)、4 (Z2)。4 个样本的覆盖度都达到了0.994以上,稀释曲线 (图3a)、Simpson曲线(图3b) 及Shannon 曲线 (图3c) 均显示曲线已经趋于最大值并达到平坦,表明样本测序数据量足够大,已经包含了几乎所有的序列多样性,足够反映4个样本中绝大部分待测真菌物种的遗传信息。除Z1的OTU数目较少外,B1、B2和Z2的OTU数目没有显著性差异;但是Z1和Z2的序列丰度大于1%的OTU均少于B1和B2,说明玉米籽粒患病部位比穗轴患病部位主体菌群的多样性更低。
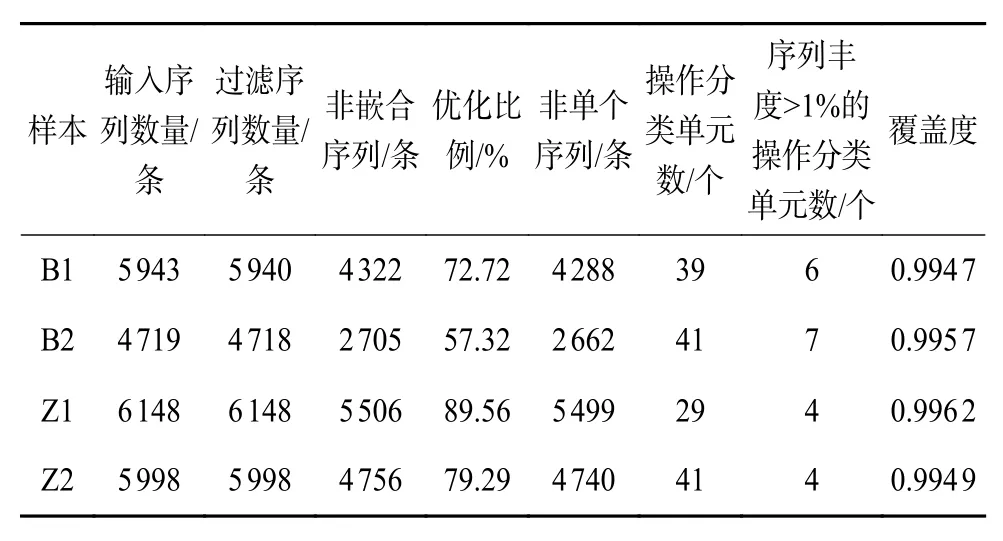
表1 从穗轴和籽粒所取菌落样本 (穗轴: B1、B2,籽粒: Z1、Z2) 的序列信息
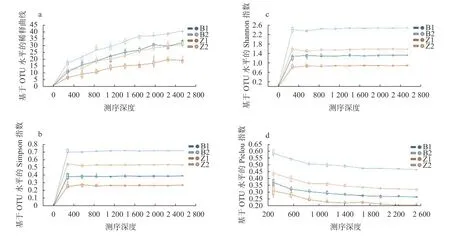
图3 从穗轴和籽粒所取菌落样本 (穗轴: B1、B2,籽粒: Z1、Z2) 的稀释曲线 (a)、Simpson 曲线 (b)、Shannon 曲线 (c) 和Pielou’s evenness曲线 (d)
2.3 主要致病菌及其共生真菌群落主成分分析
由主成分分析 (principal component analysis,PCA) 可知 (图4a),取自患病籽粒的样本Z1和Z2距离接近,和取自患病穗轴的样本B1、B2距离较远,且B1和B2间距离较远。上述情况说明患病籽粒处真菌群落相似性高,且与患病穗轴处真菌群落差异较大;而患病穗轴处真菌群落组成可能受所处环境、位置等因素的影响较大。
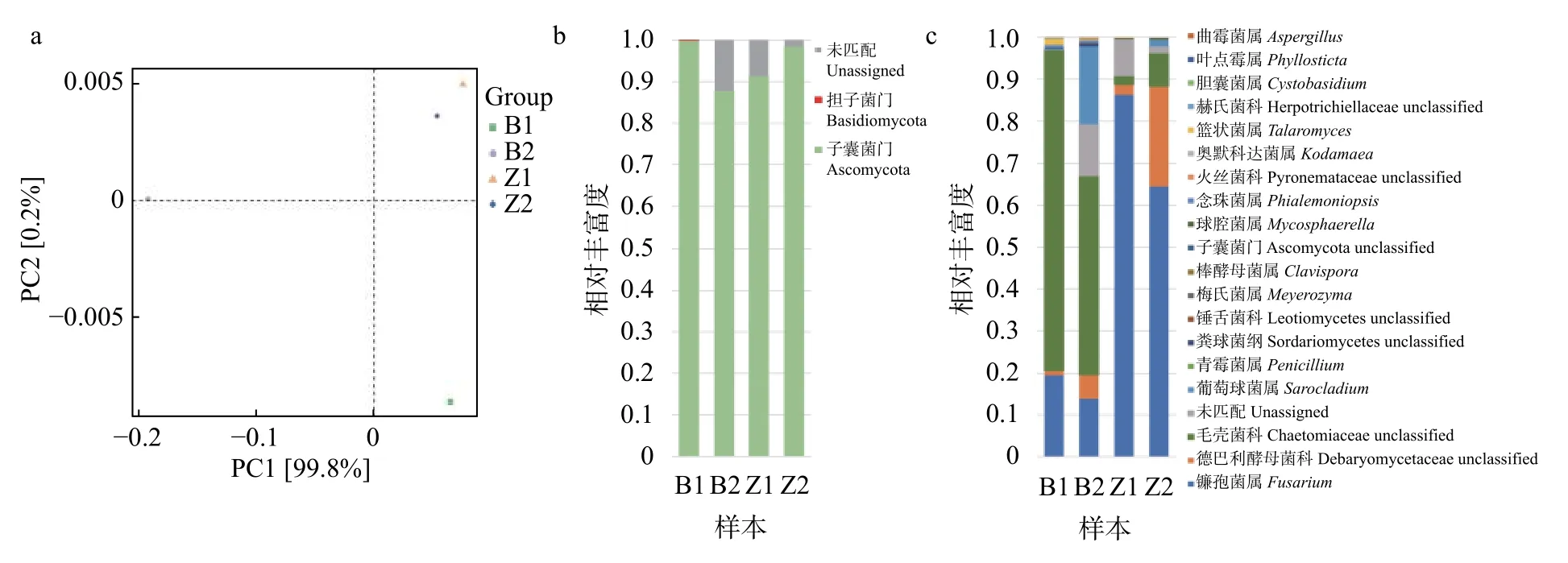
图4 从穗轴和籽粒所取菌落样本 (穗轴: B1、B2,籽粒: Z1、Z2) 基于OTU水平的主要致病菌及其共生真菌群落主成分分析 (a),以及门 (b) 和属 (c) 水平的主要致病菌及其共生真菌群落结构
2.4 基于门、属水平的主要致病菌及其共生真菌群落结构分析
经过序列相似性大于97%水平上的OTU聚类,所有样本中可识别的真菌可分为2个门 (图4b)。其中主要为子囊菌门 (Ascomycota),在B1,B2,Z1,Z2中的丰度分别为 99.842%,87.816%,91.377%,98.418%。担子菌门 (Basidiomycota) 所占比例极少,只在B1中检出,丰度为0.070%。
在属水平上4个样本中的真菌共鉴定出19个属 (图4c)。B1中鉴定出15属,丰度大于1%的有4个,由大至小依次为毛壳菌科 (Chaetomiaceae Unclassified) (76.464%)、镰孢菌属 (Fusarium)(19.581%)、篮状菌属 (Talaromyces) (1.384%) 以及德巴利酵母菌科 (Debaryomycetaceae Unclassified)(1.068%)。B2中鉴定出15属,丰度大于1%的有4个,依次为毛壳菌科 (Chaetomiaceae Unclassified)(47.468%)、葡萄球菌属 (Sarocladium) (18.592%)、镰孢菌属 (Fusarium) (13.884%) 以及德巴利酵母菌科(Debaryomycetaceae Unclassified) (5.736%)。Z1中鉴定出11属,丰富度大于1%的有3个,依次为镰孢菌属 (Fusarium) (86.313%)、德巴利酵母菌科(Debaryomycetaceae Unclassified) (2.413%) 和毛壳菌科 (Chaetomiaceae Unclassified) (2.215%)。Z2 中鉴定出15属,丰富度大于1%的有4个,依次为镰孢菌属 (Fusarium) (64.517%),德巴利酵母菌科(Debaryomycetaceae Unclassified) (23.774%),毛壳菌科 (Chaetomiaceae Unclassified) (7.991%),以及葡萄球菌属 (Sarocladium) (1.543%)。
在B1,B2中,毛壳菌科的丰富度占绝对优势;而在Z1,Z2中,镰孢菌属的丰富度占绝对优势。对于4个样本而言,镰孢菌属、巴利酵母菌科和毛壳菌科均占优势 (丰度>1%)。此外,诸如青霉属(Penicillium), 粪 壳 菌 纲 (Sordariomycetes Unclassified),盘菌亚门 (Leotiomycetes Unclassified)以及子囊菌门 (Leotiomycetes Unclassified) 皆以不同比例 (丰度<1%) 存在于样本中。剩余属则数目极少 (丰度<0.1%)。另外也存在部分特殊情况,例如在B1中丰富度较高的篮状菌属 (1.384%) 在B2与Z1中丰富度均较低 (丰度<1%) 甚至不存在于Z2中。
2.5 基于种水平的主要致病菌及其共生真菌群落结构分析
4 个样本 (B1、B2、Z1、Z2) 各自筛选出的主要OTU分别在利用ITS序列构建的进化树上 (图5)与拟轮枝镰孢菌 (Fusarium verticillioides)、弯曲单胞瓶霉 (Phialemonium curvatum)、季也蒙毕赤酵母(Meyerozyma caribbica)、Cornuvesica falcata、Sarocladium kiliense、艾米斯托克篮状菌(Talaromyces amestolkiae) 聚为一群,由此可以将这些OTU对应的全部序列归入对应的种,计算各个种 (主要种) 的相对比例。根据4个样本中真菌主要种的相对比例 (图6),可以看出真菌主要种在4个样本中的存在比较稳定。其中拟轮枝镰孢菌、弯曲单胞瓶霉、季也蒙毕赤酵母在4个样本中都有一定量分布;Cornuvesica falcata在除B1 (图6a) 外的3个样本中有一定分布;Sarocladium kiliense在B2和Z2 (图6b,d) 中有一定分布。特别的是:艾米斯托克篮状菌仅在来自玉米穗轴的样本 (B1,B2)(图6a,b) 有一定分布;弯曲单胞瓶霉在来自玉米穗轴的样本 (B1,B2) (图6a,b) 中的相对比例显著高于来自玉米籽粒的样本 (Z1,Z2) (图6c,d);拟轮枝镰孢菌在来自玉米籽粒的样本 (Z1,Z2) (图6c,d)中的相对比例显著高于来自玉米穗轴的样本 (B1,B2) (图6a,b)。总之,主要种在不同患病部位的真菌群落组成相似,但是相对比例有较大差异。特别的是,弯曲单胞瓶霉作为在环境中广泛分布的单胞瓶霉属 (Phialemonium) 的一种真菌[46],在来自玉米穗轴的样本 (B1,B2) 中的丰度高于主要致病菌拟轮枝镰孢菌,可能由于拟轮枝镰孢菌的侵染干扰了局部微生物群落平衡导致其在患病部位的大量增殖。
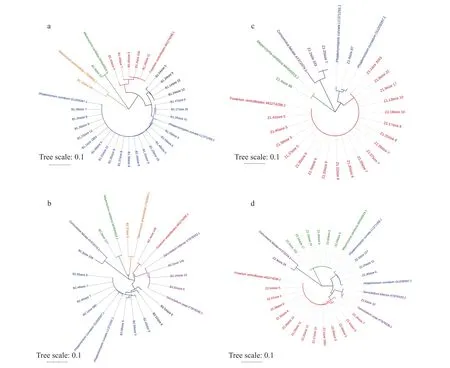
图5 从穗轴所取菌落样本B1 (a)、B2 (b) 和从籽粒所取菌落样本Z1 (c)、Z2 (d) 中主要OTU构建的系统进化树 (图中相同颜色归为同一个种)
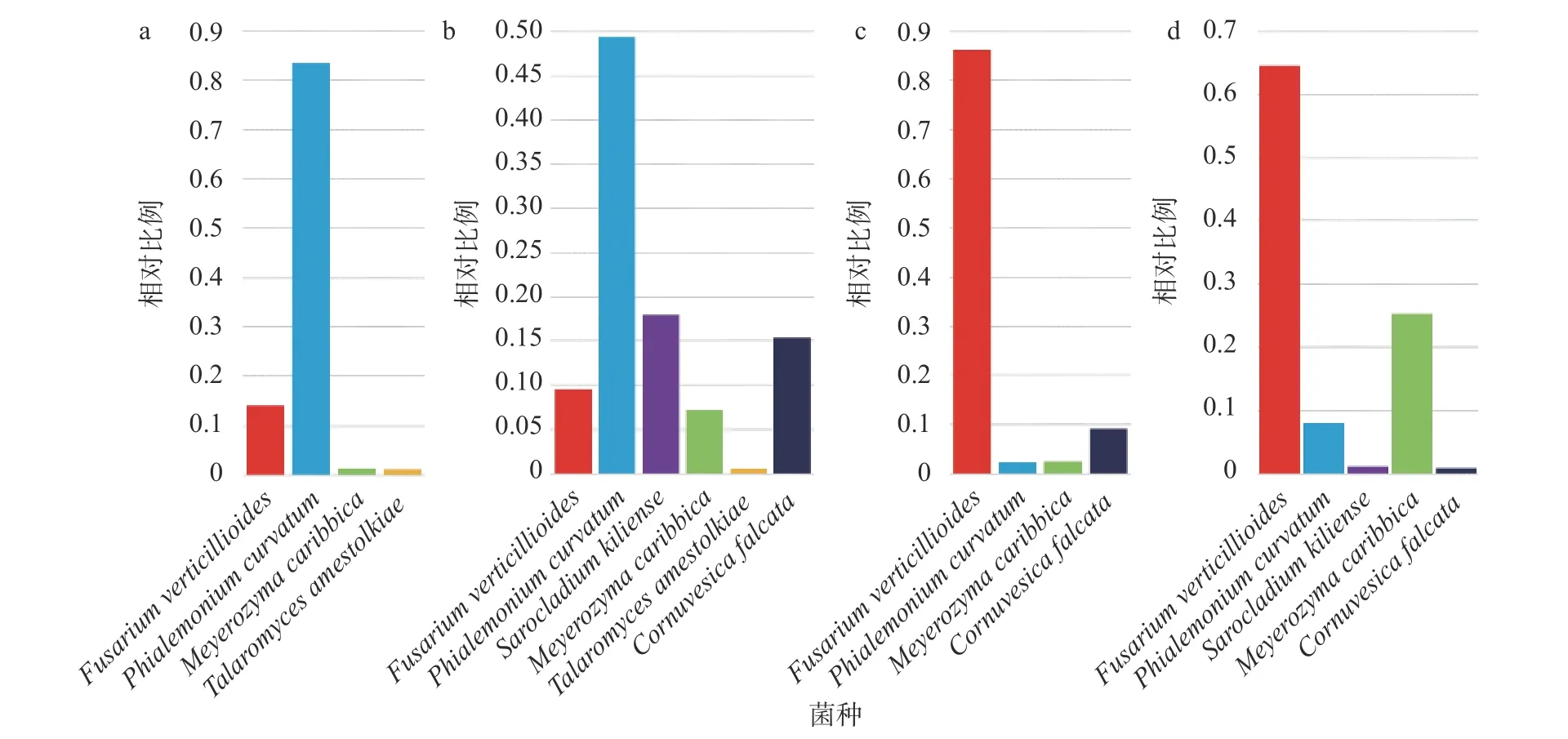
图6 从穗轴所取菌落样本B1 (a)、B2 (b) 和从籽粒所取菌落样本Z1 (c)、Z2 (d) 中主要真菌 (种水平) 的相对比例
2.6 主要致病菌及其共生真菌群落的Alpha多样性和Venn图分析
Alpha多样性指数可以用来表征各样本内真菌群落多样性 (表2)。其中Chao1、Observed species指数为预估群落丰度的指数,数值越大,则说明样本内菌群丰度越高;Simpson、Shannon指数则用来表征群落多样性,指数越大,群落多样性越高;以Pielou’s evenness指数表征均匀度;以 Good’s coverage指数表征覆盖度,其数值越高,则样品中序列被测出的概率就越高,检测结果对样本中微生物的真实情况的代表性越高。
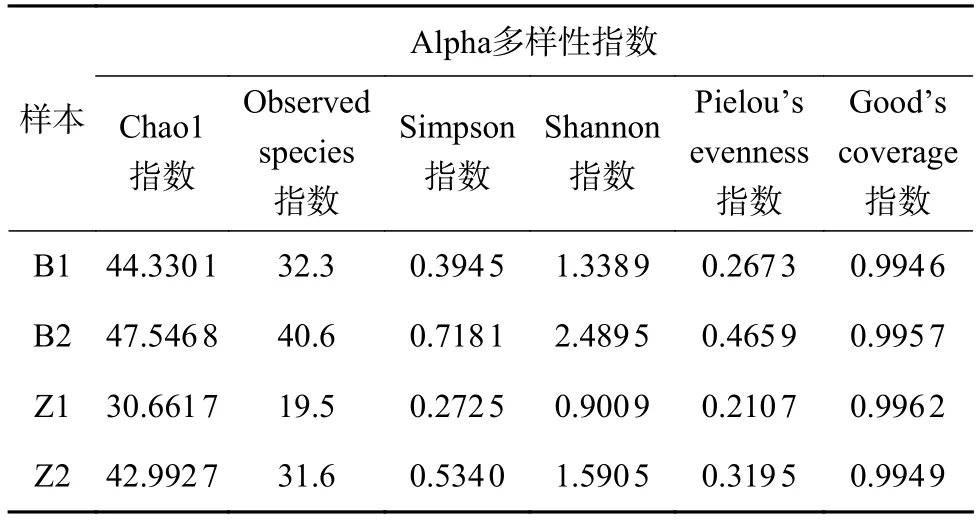
表2 从穗轴和籽粒所取菌落样本 (穗轴: B1、B2,籽粒: Z1、Z2) 的Alpha多样性指数
Alpha多样性分析结果表明,从同一患病部位(籽粒或穗轴) 获取的两个样本 (Z1和Z2,B1和B2)间的真菌群落丰度和多样性都有显著差异,这可能是取样位置等因素的不同带来的差异;在同一丰度水平 (Chao1、Observed species指数均接近) 的两个样本B1和Z2之间,Z2的Simpson、Shannon指数均高于B1,说明取自籽粒患病部位的真菌群落多样性高于穗轴,即主要致病菌的共生真菌群落组成在不同患病部位具有差异。
由 Venn图 (图 7a),在 4个样本主要的 61个OTU中,仅有10个共有OTU,占比为16.39%;除Z1外,Z2、B1、B2分别有 6、8、7个独有 OTU。说明不同植株不同患病部位 (籽粒或穗轴) 的真菌群落组成整体相似度不高。由Venn图各区域属水平的OTU丰度组成 (图7b) 可以看出,四个样本共有OTU丰度最高的为镰孢菌属,与主要致病菌为拟轮枝镰孢菌的结论相符。
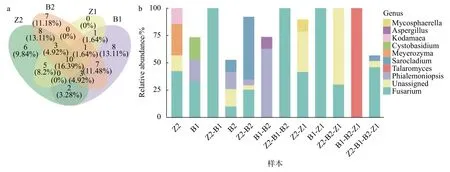
图7 从穗轴和籽粒所取菌落样本 (穗轴: B1、B2,籽粒: Z1、Z2) 中主要致病菌及其共生真菌群落的Venn图 (a) 及Venn图不同区域的OTU丰度柱状图 (b)
2.7 中国玉米穗腐病主要致病菌的分布
中国主要玉米产地 (省份) 玉米穗腐病的主要致病菌为镰孢菌属,且涉及具体种数目多 (>15),但是大部分仅在有限的地区零星分布 (图8a)。其中在较多省份有较高比例的种有 (图8b-f):拟轮枝镰孢菌 (Fusarium verticillioides)、串珠镰孢菌 (Fusarium moniliforme) 、禾谷镰孢复合种 (Fusarium graminearumclade)、层出镰孢菌 (Fusarium proliferatum) 和尖胞镰孢菌 (Fusarium oxysporum)。拟轮枝镰孢菌和禾谷镰孢复合种在中国主要玉米产地均有分布;前者在中国北方和海南省占有优势地位,后者在山西、陕西、黑龙江、云南等省份占有较大比例。串珠镰孢菌、层出镰孢菌和尖胞镰孢菌在中国的分布相对局限;串珠镰孢菌主要分布于四川省和山西省,层出镰孢菌主要分布于中国中部省份,尖孢镰孢菌主要分布于重庆市和云南省。另外,青霉 (Penicilliumspp)、毛霉 (Rhizomucorspp)、曲霉 (Aspergillusspp)、木霉 (Thichodermaspp) 等也在有限的地区少量分布。上述结果表明镰孢菌属各种在中国呈现出一定的区域性分布趋势,总体上拟轮枝镰孢菌、禾谷镰孢复合种在中国主要玉米产区占优势,与之前的结论一致[9-10,13,33,35-36,44],但是在中国北方地区优势更明显;在中国中部和南方地区镰胞菌属致病种整体多样性更高,串珠镰胞菌、层出镰胞菌等集中分布。
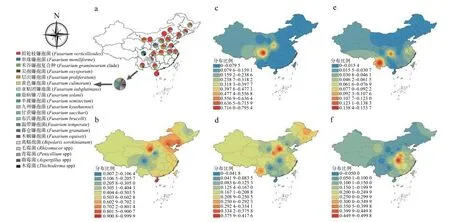
图8 中国玉米穗腐病致病菌分布 (a),以及拟轮枝镰孢菌 (b)、串珠镰孢菌 (c)、禾谷镰孢菌 (d)、尖孢镰孢菌 (e)、层出镰孢菌 (f) 在中国的分布
3 结束语
本研究通过形态学鉴定和三代测序群落结构分析鉴定出云南省发生严重玉米穗腐病害地区的玉米穗腐病主要致病菌为拟轮枝镰孢菌,并解析了其共生真菌群落结构。拟轮枝镰孢菌共生真菌群落多样性较高但弯曲单胞瓶霉、季也蒙毕赤酵母、Cornuvesica falcata、Sarocladium kiliense、艾米斯托克篮状菌等少数真菌在不同患病部位稳定存在,可能与其存在稳定的互利关系。另外,镰孢菌属优势种的分布可能与玉米品种和气候条件有关[32,42]。本研究通过搜集到的文献数据进行分析发现,虽然拟轮枝镰孢菌在中国几乎所有玉米产区都可以分离出,但仍有倾向于分布在中国北方地区 (如辽宁、甘肃等省份)的趋势,这与拟轮枝镰孢菌偏好干燥炎热的气候的结论一致[47];而其在相对湿热的云南省分布并在部分地区发生严重的穗腐病害,可能是当地易感穗腐病的玉米品种的广泛播种和现代发达的物流导致其在大范围地域间远距离扩散的结果。除此之外,由于玉米茎腐病和穗腐病致病菌组成高度相似且同源[8,48],这两种病害的差异可能是相似的致病菌和共生微生物群落空间分布不同导致的,因此本研究的结果对进一步研究穗腐病、茎腐病等病害的主要致病菌和其共生群落组分间的互作奠定了基础,并对玉米穗腐病、茎腐病等病害在云南当地乃至全国的防治工作以及相应抗病玉米的选育有指导意义。

