烟草OSCA基因家族鉴定及非生物胁迫诱导表达模式分析
邓智超 田冬冬 宋青松 郭存 文利超 王奇 初雨蒙 刘涛 郭永峰


摘 要:高渗门控钙渗透通道(OSCA,hyperosmolal-gatedcalcium-permeable channel)是一种Ca2+非选择性阳离子通道,OSCA家族含有钙依赖性通道DUF221结构域。为了进一步了解烟草OSCA基因家族特征和功能,本研究从栽培烟草K326基因组中鉴定到23个OSCA家族基因,并对NtOSCA家族系统进化关系、基因结构与蛋白结构域、启动子、不同组织器官及干旱和盐胁迫下表达模式进行分析。根据进化关系,NtOSCA基因家族被分为4个亚家族,并且同一亚家族成员间蛋白及基因结构相似。启动子分析结果表明,NtOSCA家族基因启动子中存在着多种不同的胁迫响应元件,其中干旱响应元件和脱落酸响应元件较多。进一步组织表达分析结果表明,NtOSCA基因家族成员在不同组织的表达量不同。干旱和盐胁迫表达模式分析表明,20个NtOSCA基因在干旱胁迫下表达量上调,15个NtOSCA基因在盐胁迫下表达量上调。这说明OSCA基因家族在烟草抗旱和抗盐胁迫中具有重要作用。
关键词:烟草;OSCA;家族分析;表达分析;干旱胁迫;盐胁迫
Abstract: Hyperosmolal-gated calcium-permeable channel (OSCA) is a Ca2+ nonselective cation channel found in Arabidopsis thaliana. The OSCA family members contain a calcium-dependent channel DUF221 domain. In order to further understand the characteristics and functions of OSCA gene family members in tobacco, 23 OSCA genes were identified from the genome of cultivated tobacco K326. Phylogenetic relationships, gene structures and protein domains, promoters, expression patterns in different tissues and organs, and response to drought and salt stresses of the NtOSCA family genes were analyzed. According to the evolutionary relationship, the NtOSCA gene family was divided into four subfamilies, and the protein and gene structure of the same subfamily members were similar. The results of promoter analysis showed that there were many different stress response elements in the promoters of NtOSCA family genes, among which the drought response elements and abscisic acid response elements were the most abundant. Further tissue expression analysis showed that the expression levels of NtOSCA family genes were different in different tissues. The expression pattern analysis of drought and salt stress responses showed that the expression levels of 20 NtOSCA genes were up-regulated under drought stress, and 15 NtOSCA genes were up-regulated under salt stress. These results indicated that OSCA gene family members played an important role in drought and salt stress resistance of tobacco.
Keywords: tobacco; OSCA; genome-wide analysis; expression analyses; drought stress; salt stress
植物对非生物胁迫的响应方式主要包括信号感知、调控、传递,以及应答基因的表达调控[1]。研究表明,Ca2+是植物响应生物和非生物胁迫信号转导过程中重要的第二信使,在信号感知过程中,特别是在渗透变化过程中,Ca2+浓度升高[2]。高渗门控钙渗透通道(OSCA,hyperosmolal-gatedcalcium- permeable channel)是一种Ca2+非选择性阳离子通道,被认为是一种受渗透/机械应力刺激的渗透传感器,在植物感知外界渗透胁迫和激活多种信号转导途径中起着至关重要的作用。拟南芥OSCA蛋白表现出高渗诱导的Ca2+增加,進一步被鉴定为渗透传感器,并且被证实能够抵御干旱胁迫[3]。
随着植物全基因组测序的进行,拟南芥、水稻[4]、玉米[5]、大豆[6]和番茄[7]的OSCA基因家族分别鉴定到15个、11个、12个、21个和12个基因。玉米中的ZmOSCA2.4在拟南芥中过表达显著提高了抗旱性并且降低衰老相关基因的表达[5];拟南芥AtOSCA1.3在免疫信号传递过程中控制气孔关闭[8];拟南芥AtOSCA1.8和小麦TaOSCA1.4基因与干旱胁迫关系密切[9];蒺藜苜蓿[10]和水稻[11]OSCA家族蛋白含有钙依赖性通道DUF221结构域,HOU等[12]研究发现该结构域可能通过渗透调节来减轻干旱或盐胁迫造成的损害。
烟草是一种具有高经济效益的作物,在生育期中经常受到干旱、盐碱等非生物胁迫的影响导致产量品质下降,但烟草中的OSCA基因家族还未见报道。因此,本研究利用生物信息学方法鉴定并分析烟草K326 OSCA基因家族的基因结构、蛋白结构域和启动子,在不同组织器官中及在干旱、盐胁迫下的表达模式,探索NtOSCA基因家族成员的进化关系,筛选响应干旱和盐胁迫的候选基因,为进一步明确NtOSCA基因功能和烟草抗逆品种培育奠定基础。
1 材料与方法
1.1 材料和处理
试验材料为普通烟草品种K326,由中国农业科学院烟草研究所保存。烟草种子消毒后播种于MS固体培养基上,在人工气候室中培养至4片真叶后,移至MS液体培养基作为对照,以含有300 mmol/L甘露醇的MS液体培养基模拟干旱胁迫处理,以含有100 mmol/L NaCl的MS液体培养基作为盐胁迫 处理,培养0、1、3和6 h后分别取6株液氮保存。
1.2 烟草OSCA家族基因成员鉴定及序列特征分析
从茄科基因组数据库(https://solgenomics.net/)中获取普通烟草(Nicotiana tabacum)的蛋白序列和核酸序列。从TAIR(www.arabidopsis.org)数据库中下载拟南芥所有的OSCA蛋白序列,从Pfam數据库(http://pfam.xfam.org/)中对拟南芥OSCA基因家族成员进行分析,发现其均含有DUF221结构域,所以将含有该结构域的基因作为烟草OSCA基因家族的候选基因。从Pfam数据库中下载OSCA基因家族的HMM模型文件(PF02714),利用HMMER程序检索OSCA基因家族成员,E值设为1e-20,提取结构域序列,利用CLUSTAL2.1进行多序列比对,构建烟草特异的OSCA蛋白保守结构域隐马尔科夫模型序列,使用HMMER程序再次检索烟草核酸序列,得到的结果文件,E值设为0.01,筛除其中重复的序列,剩余的即为烟草OSCA基因家族成员。
利用在线网站Expasy(http://www.expasy.org/tools/protparam.html)中的ProtParam来计算烟草OSCA家族蛋白长度(Protein length)、分子量(Molecular weight)、等电点(Isoelectric point)、脂肪族氨基酸含量(AI)、疏水性指数(GRAVY)等理化性质。
1.3 亚细胞定位预测及连锁群定位
利用在线网站Softberry(http://linux1.softberry.com)中的ProtCompv.9.0软件进行分析。从烟草基因组注释文件(GFF文件)中提取基因的染色体位置。
1.4 烟草OSCA蛋白进化分析
从Uniprot数据库(https://www.uniprot.org)下载拟南芥、大豆、番茄的OSCA蛋白序列,利用MEGA7对拟南芥、大豆、番茄和烟草的OSCA蛋白进行进化树构建,序列比对采用ClustalW方法,删除比对结果中结构域外不保守的部分,进化树构建使用最大自然法,bootstrap设为1000。结果使用Fig Tree将进化树的图像可视化。
1.5 烟草OSCA蛋白保守结构域及基因结构分析
使用在线网站MEME(http://meme-suite.org/)对NtOSCA蛋白进行保守Motif预测,Motif长度设为6~100,检索到的最大Motif数量为10,其他参数选择默认值。使用在线网站Evolview(https://www.evolgenius.info/evolview/#login)对蛋白结构域进行可视化。根据烟草OSCA基因家族成员gDNA和CDS序列,分析基因结构,利用TBtools软件对基因结构进行可视化。
1.6 ;表达模式分析
从EDWARDS等[13]于2010年发布(http://www.ebi.ac.uk/arrayexpress/experiments/E-MTAB-176/)的烟草基因表达图谱中选取早期衰老叶、中期衰老叶、后期衰老叶、成熟叶、幼叶、茎、成熟根、幼根、种子和未开花蕾10个样品的数据,贯穿从种子萌发到植株衰老的整个生命周期。检索烟草OSCA家族成员匹配的样品编号,通过样品编号获取对应的基因表达谱数据。将数据整理后利用Cluster3.0软件和JavaTreeView工具绘制热图。
1.7 RNA提取和Real-time PCR分析
用康维RNA提取试剂盒提取对照、干旱处理和盐处理4个时间段的烟草幼苗整株RNA,将1 µg RNA反转录后获得cDNA。将稀释20倍的cDNA
作为Real-time PCR的模板,设置PCR程序为:预变性95 ℃ 10 s;循环反应95 ℃ 10 s,60 ℃ 30 s共40个循环;溶解曲线分析采用95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s。
数据采用2-∆∆CT方法进行计算和分析,以NtActin作为内参基因,与其他数据进行对比并综合计算。显著性分析选择ANOVA方法,显著性水平为0.05。该研究所用引物如表1所示,每个样品3次重复。
2 结 果
2.1 烟草OSCA基因家族鉴定
通过Hmmer search在烟草中鉴定出23个OSCA基因,将其命名为NtOSCA1.1-4.0。在烟草的24条染色体中,有9条染色体含有OSCA基因,其中12号和17号染色体最多,各有3个,3号染色体有2个,1号、10号、15号、19号、22号和23号各有1个,其余都定位在Scaffold上。
从表2可见,NtOSCA家族蛋白平均长度是708 aa,最短的是NtOSCA3.1(400 aa),最长的是NtOSCA2.4(939 aa);蛋白平均分子量80 719.7 Da,范围在45 467.71~105 853.49 Da;等电点的平均值为8.93,其中最高的是NtOSCA1.7(9.7),最低的是NtOSCA4.0(6.36);平均脂肪族氨基酸指数为102.25,最小的是NtOSCA1.12(92.38),最大的是NtOSCA2.5(109.76);平均疏水性指数为0.186,除NtOSCA1.12(-0.09)表现为亲水性外,其余全部表现为疏水性,其中NtOSCA2.3(0.338)疏水性最高。通过分析发现NtOSCA蛋白都具有多个跨膜结构域,并且都定位在细胞膜上,部分NtOSCA家族成员同时定位在高尔基体上。
2.2 NtOSCA家族系统进化分析
通过对拟南芥、大豆、番茄和烟草的OSCA基因家族成员构建进化树(图1),来揭示NtOSCA 基因家族的进化关系。根据前人对拟南芥OSCA基因家族的研究,OSCA基因家族可以划分为4个亚家族,分别为Group Ⅰ、Ⅱ、Ⅲ、Ⅳ。拟南芥、大种的分化。NtOSCAs在4个亚家族的分布不均,其中Group Ⅰ亚家族中最多,有12个成员,Group Ⅳ亚家族的成员最少,只有NtOSCA4.0,但这个基因却在进化過程中被保留了下来,且在不同物种中保守,说明这个基因可能对植物有比较重要的作用。
2.3 基因结构与蛋白结构域分析
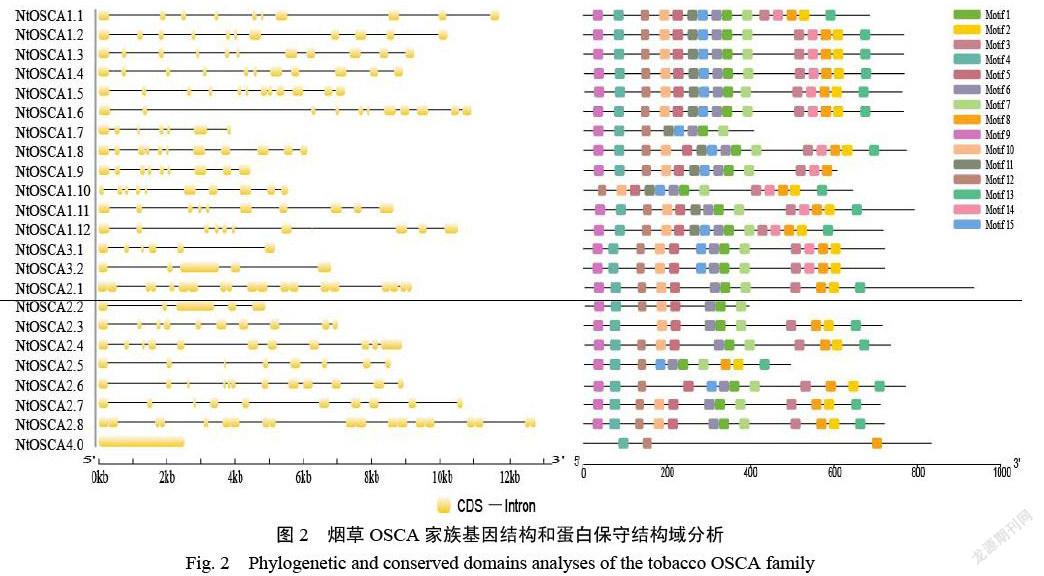
对NtOSCA基因家族进行基因结构分析(图2),来进一步探索其保守性和进化关系。通过对外显子和内含子的分析发现,NtOSCA基因成员的内含子数量范围在0~19,同一亚家族成员的内含子数量相似,Group Ⅰ亚家族成员内含子的平均数量为9个,Group Ⅱ亚家族平均为11个,Group Ⅲ亚家族平均为5个,Group Ⅳ亚家族没有内含子。同一亚家族的NtOSCA家族成员具有相似或相同的外显子数,例如Group Ⅰ亚家族的NtOSCA1.1到NtOSCA1.6的外显子长度和数量极为相似,NtOSCA1.1有10个外显子,NtOSCA1.5有12个,其他成员都是11个。这说明NtOSCA基因家族在进化关系上极为保守,这种保守性与它密切的进化关系是相吻合的。
通过对NtOSCAs蛋白结构域分析(图2),找到了15个Motif,其中Motif 2、3、7、8和17构成了DUF211。Motif分析发现所有的NtOSCA蛋白都具有Motif 8,Motif 12,除了NtOSCA4.0外,其他的差异性不大,但在不同亚家族间存在个别差异,例如Motif 15主要存在于Group Ⅰ和Ⅲ亚家族,在其他亚家族中极少分布:Motif 13分布在Group Ⅰ和Ⅱ亚家族,其他家族没有。并且NtOSCA蛋白Motif的位置和顺序高度一致,这说明NtOSCAs蛋白结构高度保守。
2.4 烟草OSCA启动子分析
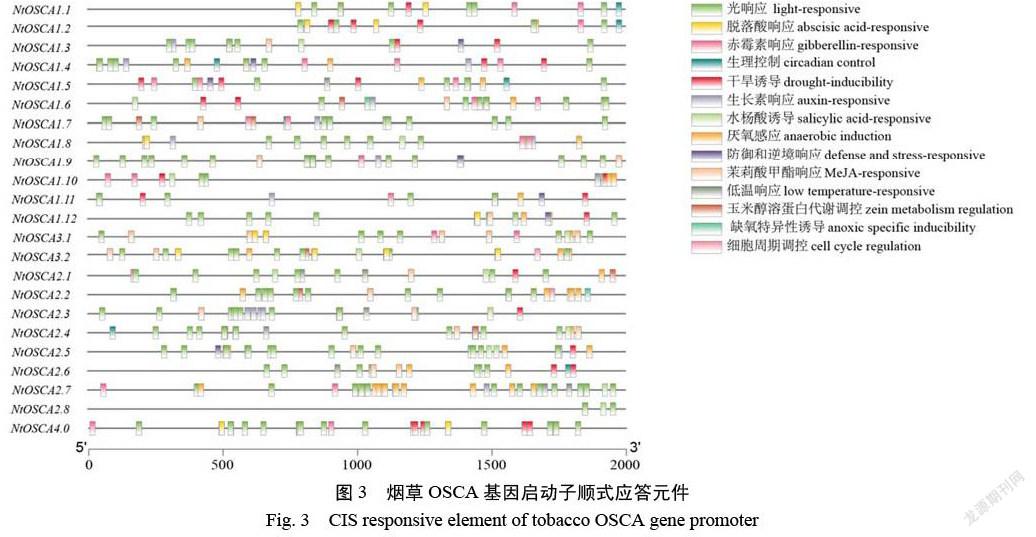
为了进一步揭示NtOSCA基因家族在非生物胁迫中的作用,对NtOSCA基因家族成员上游2000 bp的启动子序列进行分析,找到大量与抗逆相关的顺势作用元件,例如脱落酸响应元件、干旱响应元件、生长素响应元件、水杨酸响应元件和低温响应元件(图3)。对这些元件进行统计,发现不同基因启动子的顺式作用元件差异很大,即使是同一个亚家族也有明显的差异,尤其是水杨酸响应元件和低温响应元件,例如NtOSCA第一亚家族中有4个成员缺少水杨酸响应元件,只有2个成员具有低温响应元件。除NtOSCA2.1中没有脱落酸响应元件,NtOSCA1.7中没有干旱响应元件外,大部分基因都存在干旱响应元件和脱落酸响应元件。这也说明NtOSCA基因家族可能与干旱胁迫以及盐胁迫有着密切的关系。
2.5 烟草OSCA基因表达量分析
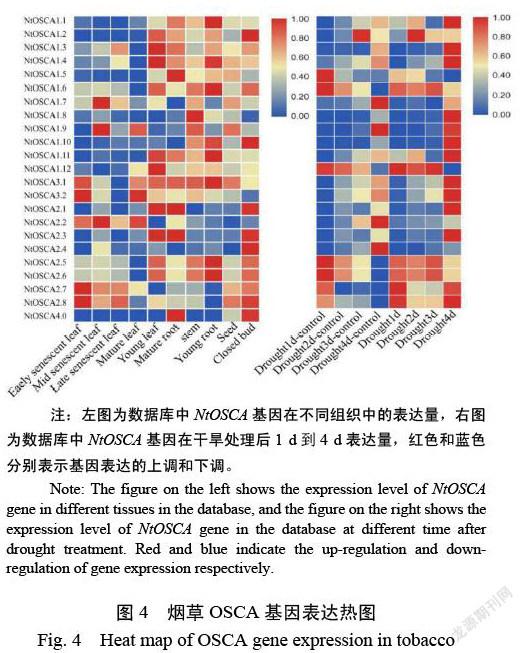
根据数据库中NtOSCA基因在不同组织中的表达量和干旱处理下的表达量绘制了热图。结果表明(图4),NtOSCA基因在根、茎、叶、花、种子以及根和叶的不同发育时期中均有表达,NtOSCA第一亚家族在成熟叶片和衰老叶片表达量较低,在幼叶、根和花等器官中表达较高;NtOSCA第二亚家族在花中表达量较高,个别成员在幼根(NtOSCA2.5,NtOSCA2.6)和幼叶(NtOSCA2.1,NtOSCA2.3)中表达量较高,说明第二亚家族与烟草的发育和器官分化有密切关系。NtOSCA4.0在花和茎中特异性表达,说明它可能与花器官的形成有关。
通过对烟草基因组数据库中干旱处理的数据进行分析发现,NtOSCA第一和第三亚家族的大部分成员在干旱处理4 d时表达量上调,NtOSCA1.4在2 d时表达量最高。第三亚家族的两个成员在第2 d时开始上调,在第4 d时达到最高。NtOSCA2.2和NtOSCA2.4在干旱胁迫下表达下调,NtOSCA4.0在数据库中没有数据。
2.6 烟草OSCA基因家族在干旱和盐胁迫下表达分析
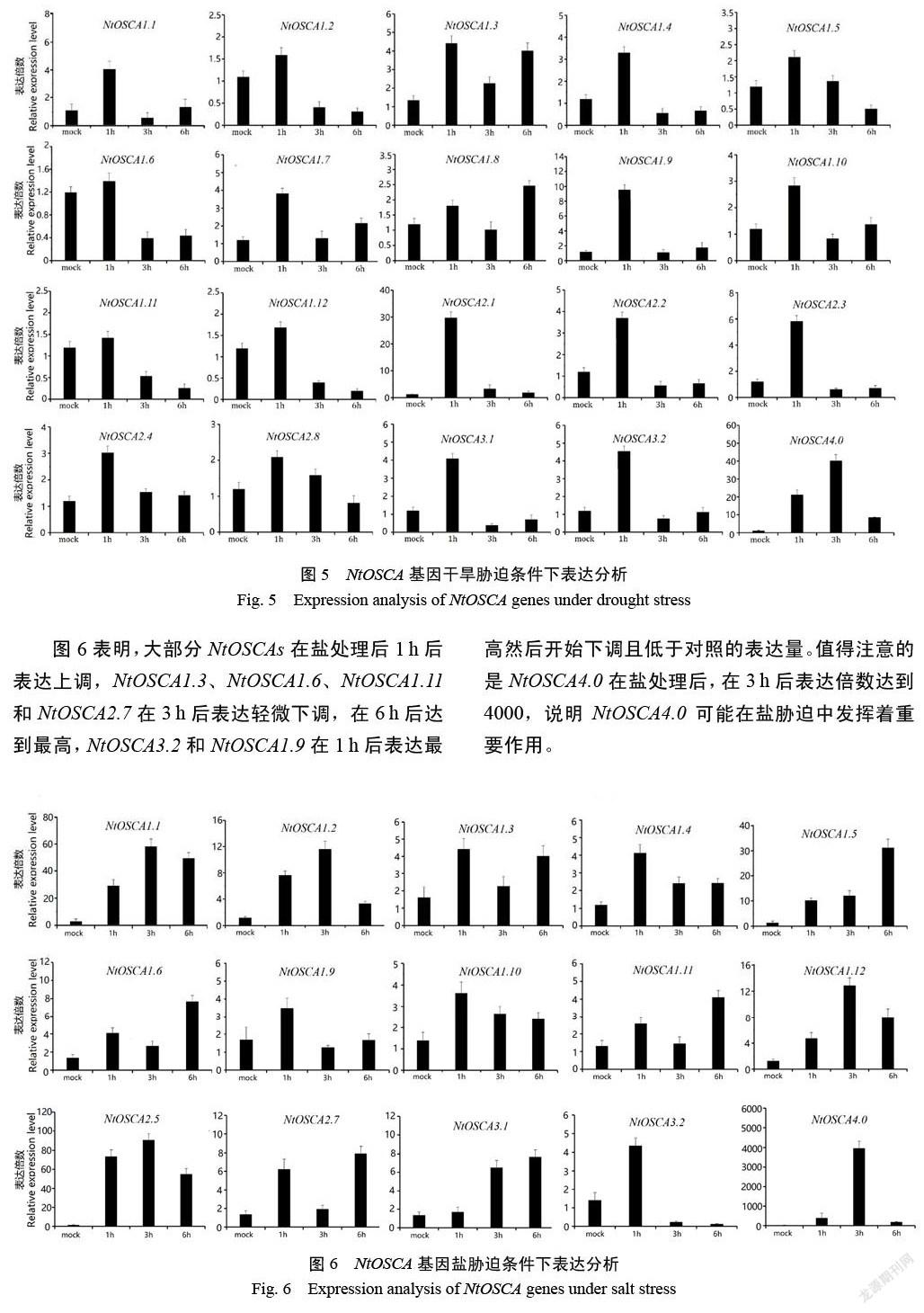
图5表明,大部分NtOSCA成员受干旱诱导,且同一亚家族表达模式相似。第一亚家族的大部分成员,在处理1 h后表达上调,在3 h时表达下调,且低于对照的表达量, NtOSCA1.3和NtOSCA1.8在6 h后表达又有所回升。第二、三亚家族除了NtOSCA2.8外都在1 h后表达最高,然后开始下降。NtOSCA4.0在3 h后表达最高。
图6表明,大部分NtOSCAs在盐处理后1 h后表达上调,NtOSCA1.3、NtOSCA1.6、NtOSCA1.11和NtOSCA2.7在3 h后表达轻微下调,在6 h后达到最高,NtOSCA3.2和NtOSCA1.9在1 h后表达最高然后开始下调且低于对照的表达量。值得注意的是NtOSCA4.0在盐处理后,在3 h后表达倍数达到4000,说明NtOSCA4.0可能在盐胁迫中发挥着重要作用。
3 讨 论
OSCA蛋白是一种Ca2+非选择性阳离子通道,在渗透压力调节过程中发挥重要作用,本研究在普通栽培烟草K326中鉴定到23个高渗门控钙渗透通道基因,并对其进行了组织特异表达分析。组织特异表达分析结果发现,NtOSCA基因在根、茎、叶、花、种子以及根和叶的不同发育时期中均有表达,说明NtOSCA基因家族可能对植物的各个时期发育均有着重要的作用。
王傲雪等[7]發现多数SlOSCA基因响应干旱、盐、低温、ABA胁迫,THOR等发现[14]拟南芥Ca2+透性通道OSCA1.3在免疫信号传递过程中控制气孔关闭。ZmOSCA2.4[8]、OsOSCA1.1和OsOSCA2.2[15]在拟南芥中过表达提高了植株对干旱的抵抗能力,ZmOSCA4.1苗期耐旱性较好[16]。本研究发现,在干旱胁迫和盐胁迫下测定烟草OSCA家族成员的表达,发现NtOSCA基因家族在干旱胁迫下的大部分成员在干旱和盐胁迫下1 h后均表达上调,且烟草OSCA家族启动子区域也含有大量胁迫响应元件,其中干旱胁迫响应元件最多,NtOSCA4.0最多有8个,可推测烟草OSCA基因家族也具有抗逆功能,并且OSCA基因家族在不同物种间功能是保守的。顾小雨等[17]发现抑制PbrOSCA2.6和PbrOSCA3.2表达后花粉管对渗透胁迫的敏感性下降,烟草NtOSCA3.1、NtOSCA3.2、NtOSCA2.5和NtOSCA2.6在花中表达量较高,并且在干旱胁迫下表达上调,可能也与干旱胁迫下的花粉管发育有关。NtOSCA4.0在干旱和盐胁中的表达量都很高,因此NtOSCA4.0可能参与多种非生物胁迫,在逆境胁迫中发挥重要作用。后续应对不同基因的功能进行下一步的研究。
4 结 论
本研究通过生物信息学的方法,从普通烟草K326中鉴定出了23个NtOSCA基因,划分为4个亚家族,并且都含有保守结构域DUF211。表达模式分析表明,NtOSCA基因家族在幼叶、根和花器官表达较高,干旱胁迫下20个NtOSCA基因表达量上调,盐胁迫下15个NtOSCA基因表达量上调。以上结果表明NtOSCA家族成员在植物抵御干旱胁迫和盐胁迫中发挥着重要的作用。
参考文献
[1]WOLF G N, FRANZ-X B. Survival in hostile environments: strategies of renal medullary cells[J]. Physiology (Bethesda, Md.), 2006, 21: 171-180.
[2]YUAN F, YANG H. OSCA1 mediates osmotic-stress-evoked Ca2+ increases vital for osmosensing in Arabidopsis[J]. Nature, 2014, 514(7522): 367-371.
[3]LEONIE S, JÖRG K. Calcium-a central regulator of pollen germination and tube growth[J]. Biochimica et biophysica acta, 2013. 1833(7):1573-1581.
[4]LI Y, YUAN F, WEN Z, et al. Genome-wide survey and expression analysis of the OSCA gene family in rice[J]. BMC Plant Biology, 2015. 15(1): 261.
[5]CAO L, ZHANG P, LU X, et al. Systematic analysis of the maize osca genes revealing zmosca family members involved in osmotic stress and zmosca2.4 confers enhanced drought tolerance in transgenic arabidopsis[J]. International Journal of Molecular Sciences, 2020. 21(1): 351.
[6]李建伟,杨珺凯,贾博为,等. 大豆基因组中OSCA基因家族的进化和表达分析[J]. 中国油料作物学报,2017,39(5):589-599.
LI J W, YANG J K, JIA B W, et al. Evolution and expression analysis of OSCA gene family in soybean[J]. Chinese Journal of Oil Crop Sciences, 2017, 39(5): 589-599.
[7]王傲雪,张可为,张瑶,等. 番茄OSCA基因家族鉴定及不同胁迫条件下表达分析[J]. 东北农业大学学报,2019,50(1):19-28.
WANG A X, ZHANG K W, ZHANG Y, et al. Identification of tomato OSCA gene family and expression analysis under different stress conditions[J]. Journal of Northeast Agricultural University, 2019, 50(1): 19-28.
[8]KATHRIN T, JIANG S, MICHARD E, et al. The calcium-permeable channel OSCA1.3 regulates plant stomatal immunity[J]. Nature, 2020.569-573.
[9]吕广德. 小麦taosca1.4基因的克隆、标记开发和功能分析[D]. 泰安:山东农业大学,2015.
ZHU G D. Cloning, molecular markers and function of the fene taosca1.4 in common wheat[D]. Taian: Shandong Agricultural University, 2015,
[10]杨杞,牛肖翠,王瑞刚,等. 蒺藜苜蓿DUF221基因家族全基因组鉴定及盐响应相关基因筛选[J]. 分子植物育种,2019,17(16):5255-5262.
YANG Q, NIU X C, WANG R G, et al. Genome-wide Characterization of DUF221 Gene Family in Medicagotruncatula and Screening for Salt Response Genes[J]. Molecular Plant Breeding, 2019, 17(16): 5255-5262.
[11]GANIE S A, PANI D R, MONDAL T K. Genome-wide analysis of DUF221 domain-containing gene family in Oryza species and identification of its salinity stress-responsive members in rice[J]. PLOS ONE, 2017. 12(8): e0182469.
[12]HOU C, TIAN W, KLEIST T, et al. DUF221 proteins are a family of osmosensitive calcium-permeable cation channels conserved across eukaryotes[J]. Cell Research, 2014. 24: 632–635.
[13]EDWARDS K D, BOMBARELY A, STORY G W, et al. TobEA: an atlas of tobacco gene expression from seed to senescence[J]. BioMed Central, 2010. 11(1): 142.
[14]THOR K, JIANG S, MICHARD E, et al. The calcium-permeable channel OSCA1.3 regulates plant stomatal immunity [J]. Nature. 2020; 585(7826): 569-573.
[15]ZHAI Y, WEN Z, FANG Z, et al. Functional analysis of rice OSCA genes overexpressed in the arabidopsis osca1 mutant due to drought and salt stresses[J]. Transgenic research, 2021, 30(6): 811-820.
[16]DING S, FENG X, DU H, et al. Genome-wide analysis of maize OSCA family members and their involvement in drought stress [J]. PeerJ. 2019 Apr; 7: e6765
[17]顧小雨. 梨OSCA基因家族分析及pbrosca2.6和pbrosca3.2的功能验证[D]. 南京:南京农业大学, 2017.
GU X Y. OSCA family analysis and functional validation of PBROSCA2.6 and pbrosca3.2 in pyus[D]. Nanjing: Nanjing Agricultural University, 2017.
2753501186374

