先天性心脏病胎儿的染色体微阵列分析*
钟艳娟,卢 建,吴佳佳,吴泽珊,陈剑虹
1.广东省惠州市第一妇幼保健院产前诊断中心,广东惠州 516001;2.广东省妇幼保健院胎儿遗传医学中心,广东广州 510000
先天性心脏病(CHD)是胎儿时期心血管发育异常而形成的先天畸形,是导致新生儿及婴幼儿死亡的主要原因之一。全世界每年大约有135万例先天性心脏病患儿出生[1],而我国新生儿先天性心脏病发病率为 7‰~8‰[2],连续多年位居出生缺陷第一位。研究表明,产前超声发现的CHD胎儿中,18%~22%合并染色体异常或致病性染色体拷贝数变异(CNV)[3]。因此,避免合并染色体异常以及致病性CNV的CHD患儿出生,成为降低出生缺陷的一项重要举措。目前,染色体核型分析仍是产前诊断的主要检测方法,但是无法检测到5 Mb以下染色体片段的重复和缺失。染色体微阵列分析(CMA)是近年发展起来的高分辨率分子技术,能在全基因组水平进行扫描,对于染色体微缺失、微重复等不平衡重排有明显优势。根据芯片设计与检测原理的不同,CMA技术可分为两大类:基于微阵列的比较基因组杂交(aCGH)技术和单核苷酸多态性微阵列(SNP array)技术。通过aCGH技术能够很好地检出CNV,而SNP array 技术除了能够检出CNV外,还能够检测出大多数的单亲二倍体(UPD)和三倍体,并且可以检测到一定水平的嵌合体。而设计涵盖aCGH+SNP array检测探针的芯片,可同时具有aCGH和SNP array芯片的特点[4-5]。2013年,美国妇产科学会(ACOG)及美国母胎医学学会(SMFM)发表临床指南,指出在产前超声检查显示结构异常的胎儿中,推荐用CMA替代传统的染色体核型分析技术[6]。本研究通过应用CMA,在全基因组水平分析CHD胎儿的遗传学病因,探索CMA技术在CHD胎儿致病基因中的临床应用价值。现报道如下。
1 资料与方法
1.1一般资料 选择2018年5月至2020年5月于广东省惠州市第一妇幼保健院超声科经2位有产前诊断资质的超声专家确诊胎儿为CHD的病例,由经过专业培训及具备相应资质的临床遗传医师对孕妇及家属进行遗传咨询,充分告知介入性产前诊断手术的感染风险、胎儿丢失率,详细讲解CMA技术以及染色体核型分析的优势、局限性和可能的结果等,孕妇及其家属自愿选择进行产前诊断,并签署手术知情同意书。纳入研究的孕妇共216例,其中检测羊水标本211例,脐血标本5例,均同时进行染色体核型分析及CMA,本研究经过医院医学伦理委员会审批通过。
1.2方法
1.2.1分组 在216例CHD胎儿中,根据结构畸形情况分成3组:单一心脏结构畸形组(Ⅰ组)、多发心脏结构畸形组(Ⅱ组)、心内合并心外结构畸形组(Ⅲ组)。Ⅰ组胎儿只有1处心血管畸形,Ⅱ组胎儿具有2处及以上心血管畸形,Ⅲ组胎儿心内合并心外结构异常,包括神经系统、泌尿系统、消化系统以及胎儿宫内生长受限(FGR)、羊水过多、羊水过少等。
1.2.2染色体核型分析 在无菌操作条件下,将抽取的羊水或脐血装入无菌离心管内离心收集羊水或脐血细胞,采用贴壁细胞培养法培养,收获、制片和G显带,全自动扫描仪扫描、拍照。依据人类细胞遗传学国际命名体制(ISCN2009)标准进行G显带染色体核型分析诊断。
1.2.3CMA检测 收集的胎儿羊水或脐血标本及时送至广东省妇幼保健院胎儿遗传医学中心进行检测。该中心使用美国Afffymetrix公司生产的Cytoscan 750k芯片对全基因组已知基因区域进行扫描,数据分析参照DECIPHER、ISCA、OMIM、DGV、UCSC等数据库资料。判断所检出CNV的性质,根据相应的标准分为:(1)致病性CNV;(2)临床意义不明确的CNV(VOUS );(3)良性CNV。
1.2.4CMA结果验证 对CMA检出为致病性CNV的胎儿标本,采用实时荧光定量PCR技术进行验证,当检测结果提示VOUS时,应进一步检测胎儿父母的CNV,排除家族性良性变异,给予家属客观的遗传咨询意见。
1.3随访 对所有CHD胎儿病例进行电话随访,分娩新生儿随访至1岁,记录妊娠结局、产后超声复查情况、出生后手术治疗效果以及生长发育情况。
1.4统计学处理 采用SPSS22.0统计软件进行数据分析,计数资料以例数或百分率表示,组间比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结 果
2.1基本信息 纳入研究的216例CHD胎儿中,Ⅰ组91例,占42.13%;Ⅱ组66例,占30.56%;Ⅲ组59例,占27.31%。孕妇年龄19~41岁、中位年龄27岁,孕周18~30周、中位孕周为26周。夫妻双方无明显遗传病家族史,孕妇不合并严重内外科疾病。
2.2染色体核型分析结果 216例CHD胎儿中,检测出19例染色体异常,检出率为8.80%,其中,Ⅰ组检测出6例 (6.59%),Ⅱ组检测出6例 (9.09%),Ⅲ组检测出7例(11.86%),3组异常检出率比较,差异无统计学意义(P>0.05),见表1。19例染色体异常包括:4例21-三体综合征;4例18-三体综合征;2例13-三体综合征;1例45,X;1例47,XXY;4例染色体缺失,分别是46,XN,del(13)(p11.1)、46,XN,del(3)(q24q25)、46,XX,del(X)(q26.3-q28)、46,XN,del(10)(q26.3);1例染色体重复,46,XN,dup(6)(q23.3-q25.3);1例染色体平衡易位46,XN,t(3;7)(p34;q12)mat,1例5号染色体倒位,46,XN,inv(5)(p15.3q13)mat。其余197例染色体正常,其中包括6例染色体多态性;2例46,XN,inv(9);1例46,X,inv(Y);2例46,XN,1qh+;1例46,XN,16qh+,均对父母进行外周血染色体核型分析,判断来源于正常表型的父母其中一方,归入正常染色体。
2.3CMA检测结果 216例CHD胎儿标本均进行CMA检测,共检测出31例致病性CNV,检出率为14.35%,在19例染色体核型分析异常病例中,12例为染色体非整倍体,4例染色体缺失,1例染色体重复,CMA检测出相同结果;1例染色体平衡易位及1例染色体5号倒位,CMA未检测出异常。3组胎儿CMA检测提示致病性CNV检出率分别为:Ⅰ组检测出8例(8.79%),Ⅱ组检测出9例(13.64%),Ⅲ组检测出14例(23.73%),3组差异无统计学意义(P>0.05),见表1、2;在197例染色体正常的CHD胎儿中,CMA额外检测到14例异常,将CHD胎儿的遗传学病因检出率提高了7.11%。此外,CMA再检测出13例VOUS,VOUS检出率为6.02%(13/216),进一步对父母外周血进行CMA检测,提示其中9例来源于正常表型父母其中一方,最终判断为家族性变异,归为良性CNV,4例为新发变异,分别是:1例在5号染色体5q11.2位置发生重复,片段大小约2.0 Mb;1例在16号染色体16q23.3-q24.1位置发生缺失,片段大小约647 kb;1例在染色体11q13.2-q13.3位置发生缺失,片段大小1.6 Mb;1例在4号染色体4q27位置发生缺失,片段大小约547 Kb,这些CNV临床意义目前无法明确。
2.4随访 对216例CHD胎儿的妊娠结局及产后生长发育情况进行随访,128例分娩(59.26%),86例终止妊娠(39.81%),失访2例(0.93%)。CMA检测提示31例致病性CNV,全部终止妊娠,其中包括12例染色体非整倍体。4例新发的VOUS中,1例胎儿为单纯室间隔缺损,1例胎儿为右位主动脉弓,孕妇选择保留胎儿,追踪至出生后1岁,目前生长发育正常;另外1例为法洛四联症、1例左心发育不良,孕妇选择终止妊娠。见表2。
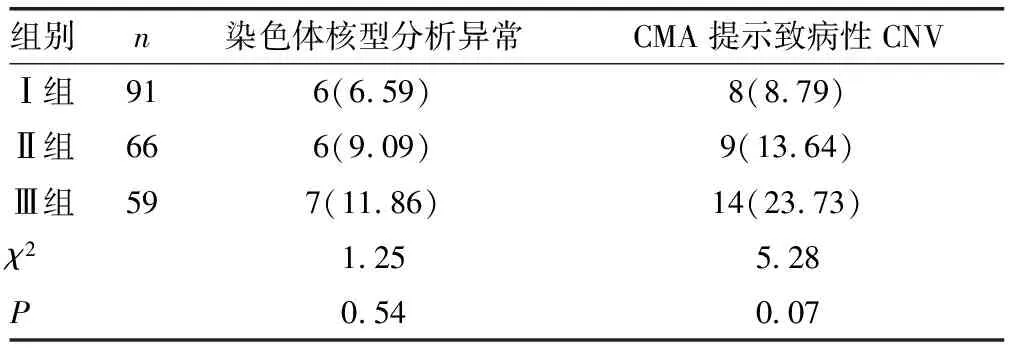
表1 CHD胎儿染色体核型分析及CMA检测情况比较[n(%)]
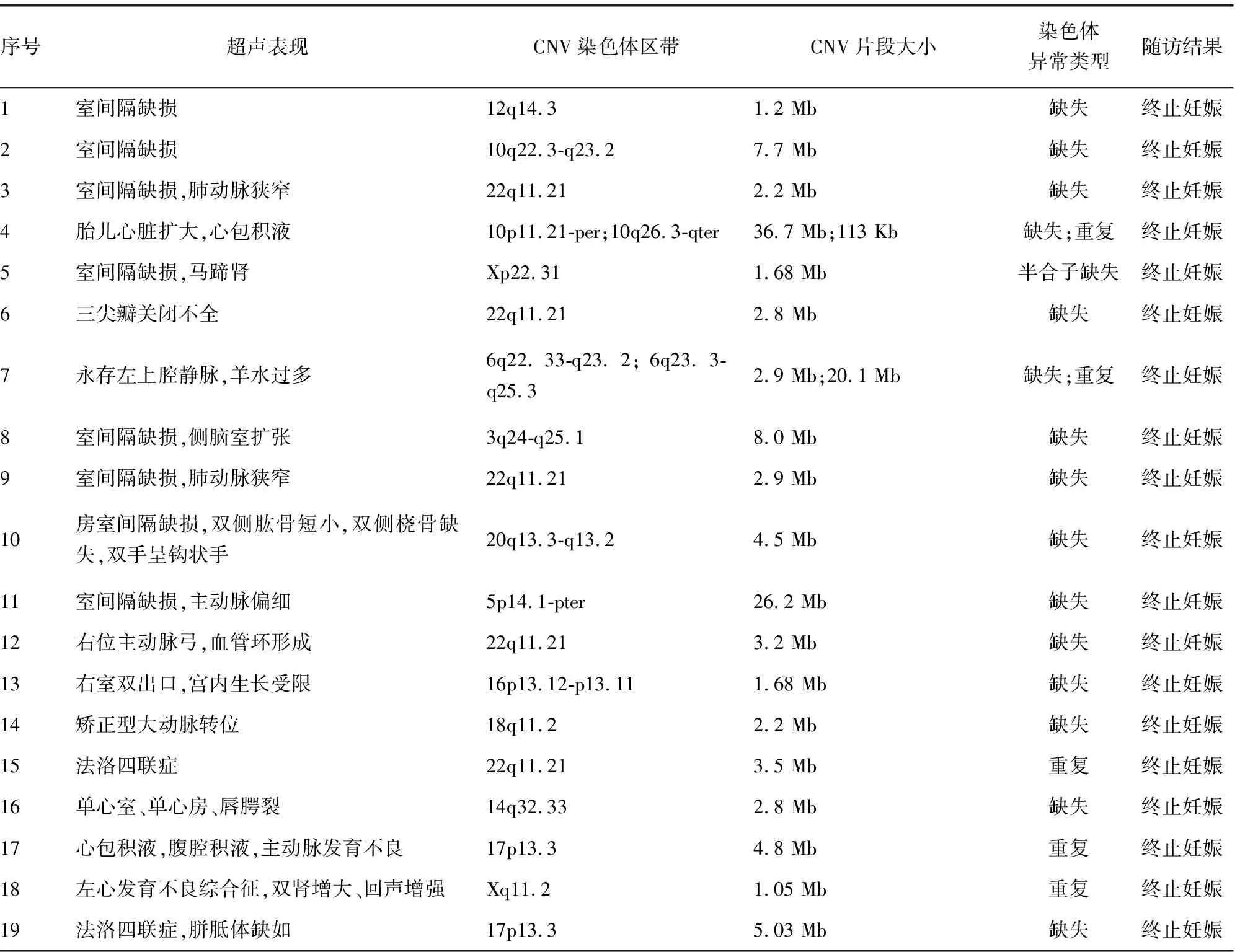
表2 CHD胎儿CMA检测致病性CNV的相关情况及随访结果
3 讨 论
本研究216例CHD胎儿中,检测出19例染色体异常,检出率为8.80%,同时进行CMA检测,共检测出31例致病性CNV,检出率为14.35%,在197例染色体正常的CHD胎儿中,CMA额外检测到14例异常,将CHD胎儿的遗传学病因检出率提高了7.11%,这与国内外相关报道基本相符。一项国内研究报道,在CHD胎儿中染色体异常的检出率为10.2%(18/176),对88例染色体核型分析结果正常的CHD胎儿进行CMA检测,致病性CNV检出率额外增加到16%(14/88)[7],国外多项研究表明,在患有CHD的新生儿中,应用CMA技术可于10%左右的患儿中检出致病性CNV[8-9],另一项回顾性分析显示,580例染色体核型分析结果正常的CHD患儿应用aCGH 技术检测,显示致病性CNV的检出率为7.9%[10]。因此,CHD胎儿的遗传学病因,除了与染色体数目及结构的异常相关,还包括染色体微缺失、微重复,而传统的染色体核型分析只能检出大于10 Mb的大片段缺失及重复,增加CMA检测可以明显提高CHD胎儿遗传学病因的检出率。
在216例CHD胎儿中,根据结构畸形情况分成3组:单一心脏结构畸形组、多发心脏结构畸形组、心内合并心外结构畸形组,这3组病例的染色体异常检出率与CMA提示致病性CNV的检出率比较,差异均无统计学意义(P>0.05),与国内相关报道相符[11-12]。因此,无论是单一的心脏结构畸形,还是多发心脏结构畸形,无论是否合并心外畸形,均与染色体异常相关,针对所有心脏结构畸形的胎儿,均应告知孕妇及家属胎儿染色体异常风险,并且建议行介入性产前诊断,为评估CHD胎儿的远期预后提供科学依据。
本研究在216例CHD胎儿中,发现4例22q11.2微缺失综合征,异常诊断率为1.85%,据国内一项研究报道,在204例心血管异常的产前标本中,检出6例22q11.2微缺失综合征,诊断率为2.94%[13]。该区域缺失可导致心脏畸形、异常面部形态、胸腺发育不全、腭裂和低血钙等临床表现,也称为DiGeorge综合征,发病率为1/4 000[14-15]。该遗传综合征患儿预后不良,无法根治,因此,CMA技术从出生后患儿的检测走向胎儿的产前诊断,其临床应用价值更高。
由于CMA技术能够快速准确地确定胎儿染色体异常的位置及片段大小,分辨率高,检测效率快,目前多项研究推荐将CMA技术作为产前超声结构异常胎儿遗传学病因的一线检测方法[16-17]。但是,由于CNV在人类基因组中的分布非常广泛,约占基因组序列的12%[18],导致临床在应用CMA技术的过程中,对CNV的判断和临床意义的解释面临许多困难。在产前诊断中使用CMA检测,经常出现无法判读和解释的VOUS。一项对143例室间隔缺损胎儿标本的研究中,CMA检测出17例VOUS(11.9%),通过进一步对父母进行CMA检测,显示12例遗传自正常表型父母,为良性CNV,但仍有5例(3.5%)为新发,无法判读临床意义[19]。本研究中,VOUS检出率为6.02%(13/216),进一步对父母外周血进行CMA检测,提示其中9例来源于正常表型父母其中一方,最终判断为家族性变异,归为良性CNV,4例为新发变异。因此,即使对父母进行CMA检测,仍然无法对所有VOUS的临床性质做出确切的判断,应根据胎儿的超声表现,谨慎考虑胎儿去留,避免不必要的终止妊娠。
任何检验技术均有其自身的局限性,CMA无法检出平衡性染色体重排,如平衡易位、倒位和大多数基因位内点突变[20]。本研究中,有1例染色体平衡易位及1例染色体5号倒位,CMA未检测出异常。
综上所述,CMA技术在CHD胎儿产前诊断中的应用,可增加遗传学病因的检出率,在临床应用中,应结合超声表现及染色体核型分析结果,做出全面的结果判读和解释。本研究的不足之处在于部分复杂性心脏畸形以及合并多系统畸形的病例拒绝进行产前诊断,而选择直接终止妊娠,导致病例结构的偏倚,未来需进一步收集多中心病例,可以做出更客观的数据分析。

