OHSS模型大鼠卵巢组织中自噬、凋亡和氧化应激相关蛋白的表达及意义
张光云,黄旋,陈莉,姚兵*
(1. 南京师范大学生命科学学院,南京 210023;2. 中国人民解放军东部战区总医院生殖医学中心,南京 210002)
卵巢过度刺激综合征(OHSS)是辅助生殖治疗过程中控制性促排卵时常见的一种医源性并发症,以卵巢增大、血清高激素水平、血管通透性增加、第三体腔积液及相关的病理生理过程为主要特征。轻度OHSS的发生率约占1/3,中重度的发生率为3.1%~8%[1],其发病机制主要与人绒毛膜促性腺激素(HCG)作用下血管活性因子增多导致的血管内皮屏障破坏相关[2-4]。
有研究报道,自噬、氧化应激与卵巢功能密切相关[5-8]。自噬是细胞在应激条件下防止损伤并促进细胞存活;多种环境和化学刺激等导致活性氧大量产生,氧化应激可以激活自噬,自噬通过负反馈作用保护细胞。氧化应激、自噬同时对细胞凋亡有调节作用。
研究采用孕马血清促性腺激素(PMSG)联合HCG建立OHSS模型[9]。前期研究发现,OHSS超生理水平的激素释放与卵巢颗粒细胞增殖相关[10]。另外文献报道称纠正卵巢氧化应激可以预防和治疗OHSS[11]。但是,氧化应激、自噬、凋亡在OHSS发生发展中的具体作用尚未见报道。本实验旨在观察OHSS模型中氧化应激、自噬及细胞凋亡的作用并探讨其可能调节机制。
材料与方法
一、研究对象
1.实验动物:22日龄雌性Sprague-Dawley清洁级大鼠20只(东部战区总医院实验动物中心),体重(60±10)g。饲养于18℃~25℃、相对湿度 40%~60%、昼夜比为12 h∶12 h 的环境中,自由摄食饮水。本研究涉及的实验大鼠研究包括大鼠的样本收集等过程均得到东部战区总医院伦理学会的批准和指导(伦理批号:20140729),所有操作过程符合AAALAC和IACUC指南规定。
2.主要试剂:PMSG及HCG(宁波第二激素厂),大鼠血清雌二醇(E2)、孕酮(P)、睾酮(T)水平检测采用全自动化学发光免疫分析法(Backman Coulter,Inc.,Brea CA,USA),大鼠FSH(CK-E30623R)、LH(CK-E30597R)、活性氧(ROS)(SEB971Hu)、超氧化物歧化酶(SOD)(SES134Hu)ELISA试剂盒(Cloud-Clone,USA),一抗兔源LC3(#12741)、Atg3(#3415)、Beclin-1(#3495)、Nrf2(#12721)、Cleaved Caspase-3(#9664)、P-ERK1/2(#4695)及ERK1/2抗体(#4370)(CST,USA),一抗Bax(ab69643)、Bcl-2(ab194583)及p53(ab1431)(Abcam,UK),一抗p62(sc-48389)(SANTA,USA),β-actin抗体(CST,USA)。
二、研究方法
1.动物分组:大鼠随机分为对照组、模型组,每组10只,以大鼠日龄为实验记录时间。对照组(CTL组):第22~23天每天注射等体积(0.3 ml)0.9%生理盐水,第24天注射PMSG 10 U(10 U/0.3 ml),第26天注射 HCG 10 U(10 U/0.3 ml);模型组(卵巢过度刺激综合征组,OHSS组):第22~25天每天连续腹腔注射PMSG 50 U(50 U/0.3 ml),在第26 天注射HCG 150 U(150 U/0.3 ml)。实验结束后处死大鼠,眼眶取血,2 000 转/min离心10 min,收集血清,分离卵巢组织,右侧-80℃冻存备用,左侧固定于4%多聚甲醛备用。
2.卵巢组织学检查:卵巢组织4%多聚甲醛固定24 h后,经过梯度酒精脱水、二甲苯透明、浸蜡等处理后进行石蜡包埋备用。5 μm厚度连续切片,行苏木素-伊红(HE)染色后光镜观察。各级卵泡计数:对整个卵巢组织进行连续切片,于最大切面为待检平面,前后每隔5张取一张固定于载玻片中(共10张),进行卵泡计数。HE染色后,对卵巢切片中初级卵泡(PF)、窦状卵泡(AF)、排卵前卵泡(POF)、闭锁卵泡(Atret.F)、黄体(CL)等各级卵泡分别进行计数,为防重复计数,计数时只计核着色的卵泡,并进行统计分析。
3.血清生殖激素水平检测:由东部战区总医院中心实验科检测血清E2、P、T水平,E2、P、T的检出限分别为65.8~714.4 pmol/L、0.6~3.8 nmol/L和0.34~2.55 nmol/L,批内和批间系数变量分别为5.13%和6.23%,8.18%和7.89%,以及2.71%和5.65%。采用ELISA试剂盒检测血清FSH、LH水平。
4.免疫组织化学染色:将卵巢组织切片,60℃烤片后经过程序性酒精脱蜡、水化,柠檬酸钠缓冲液中进行抗原修复(高火1 min,中火2 min,低火7 min),利用3% H2O2失活内源过氧化氢酶,打孔液(PBS∶Tween 20∶Triton 100=1 000∶10∶5)室温处理15 min,正常型山羊血清(AR900)湿盒内室温封闭1 h,1% BSA配制兔源LC3抗体(1∶200)湿盒中4℃过夜,冲洗后室温孵育二抗(1∶200)1 h,加DAB工作液显色、苏木素复染核1 min,再次清洗、分化,乙醇脱水。显微镜下对切片进行观察拍照。
5.卵巢组织ROS、SOD含量测定:按照试剂盒操作说明,进行ROS浓度及SOD酶活性检测,检测范围分别为62.5~4 000 pg/ml、0.156~10 ng/ml;最低检测浓度分别为27.7 pg/ml、0.055 ng/ml;批内与批间变异系数分别小于10%和15%。
6.Western blot检测卵巢组织相关蛋白的表达:采用RIPA蛋白裂解液裂解卵巢组织并提取总蛋白,BCA法对蛋白浓度进行定量,加入上样缓冲液后煮沸10 min。而后进行聚丙烯酰胺凝胶电泳、湿转法将蛋白转印至PVDF膜上,5%BSA室温封闭1 h,加入5%BSA稀释(一抗1∶1 000稀释)过的Atg3、Beclin-1、LC3、p62、Nrf2、Bax、Bcl-2、p53、Cleaved Caspase-3、P-ERK1/2、ERK1/2及β-actin抗体于4℃孵育过夜,TBST清洗三遍后加入二抗(1∶2 000稀释),室温孵育1 h,TBST洗膜三次后采用ECL发光液,于Tanon-5200成像系统扫描进行成像,保存扫描图像进行分析。
三、统计学分析
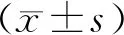
结 果
一、卵巢过度刺激对大鼠生长曲线及卵巢大体形态的影响
比较CTL组和OHSS组大鼠体重变化,结果显示两组大鼠体重无显著差异(P>0.05)(图1 A);与CTL组相比,OHSS组卵巢体积及重量显著增加[(0.341 9±0.081 4)g vs.(0.064 3±0.015 0)g,P<0.001)],OHSS组卵巢组织中可见较多血体(图1B);另外,OHSS组卵巢器质比(卵巢重量/体重,g/g×100%)显著增加[(0.313 1±0.085 6)vs.(0.056 7±0.015 1),P<0.001](图1C)。

A:生长曲线;B:卵巢重量及大体形态;C:卵巢器质比。与CTL组比较,*P<0.001。
二、卵巢过度刺激对卵巢结构和血清生殖激素水平的影响
1.卵巢过度刺激对卵巢结构的影响:HE染色结果显示,OHSS组大鼠卵巢中黄体数目显著增多(图2A)。各级卵泡计数结果显示,OHSS组总卵泡数目较CTL组显著增加[(60.87±4.36)个vs.(52.07±4.96)个,P<0.05],其中初级卵泡(PF)、窦状卵泡(AF)、排卵前卵泡(POF)、闭锁卵泡(Atret.F)数目均显著减少,黄体数目则显著增加[(51.47±3.05)个vs.(8.87±4.78)个,P<0.001)](图2)。

A:卵巢组织HE染色;B:卵泡总数目;C:各级卵泡数目。PF:初级卵泡;AF:窦状卵泡;POF:排卵前卵泡;Atret.F:闭锁卵泡;CL:黄体。图中箭头所示为黄体。与CTL组比较,#P<0.05,*P<0.001。
2.卵巢过度刺激对大鼠血清生殖激素的影响:OHSS组大鼠血清中FSH、LH水平较对照CTL组显著增加(P<0.05),E2、P、T水平也显著增加(P<0.001)(图3)。
与CTL组比较,#P<0.05,*P<0.001。
三、卵巢过度刺激对卵巢自噬的影响
LC3 Ⅱ/LC3 Ⅰ比值变化反映自噬的程度,Beclin-1和Atg3是自噬的标志蛋白。蛋白免疫印迹及灰度值分析结果显示:与对照CTL组相比,OHSS组大鼠卵巢组织中LC3 Ⅱ/LC3 Ⅰ比值显著增加(P<0.05),自噬相关蛋白Beclin-1和Atg3的表达水平也较对照组显著增高(P<0.05);凋亡相关通路pERK1/2蛋白表达水平显著上调(P<0.001)(图4A~C)。免疫组化结果表明,在OHSS大鼠卵巢组织中LC3主要分布于黄体组织,且表达水平显著高于对照CTL组(图4D)。

A:两组大鼠卵巢组织自噬相关蛋白(Atg3、Beclin-1、LC3 Ⅱ/LC3 Ⅰ)的Western blot图;B:凋亡相关通路蛋白pERK1/2、ERK1/2的Western blot图;C:蛋白条带灰度值分析图;D:卵巢组织LC3的免疫组织化学染色结果。与CTL组比较,#P<0.05,*P<0.001。
四、卵巢过度刺激对卵巢氧化应激及凋亡的影响
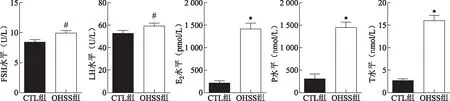
1.两组大鼠卵巢组织氧化应激水平变化比较:ELISA法检测卵巢组织中ROS水平,结果显示OHSS组卵巢ROS水平显著高于CTL组(P<0.05),而发挥清除氧自由基作用的SOD水平显著低于CTL组(P<0.05)(图5A、B)。Western blotting及蛋白条带灰度值分析结果显示,与CTL组相比,具有抗氧化作用、保护细胞免受应激损伤的转录因子Nrf2在OHSS组卵巢组织中表达水平显著增高(P<0.001)(图5C、D)。
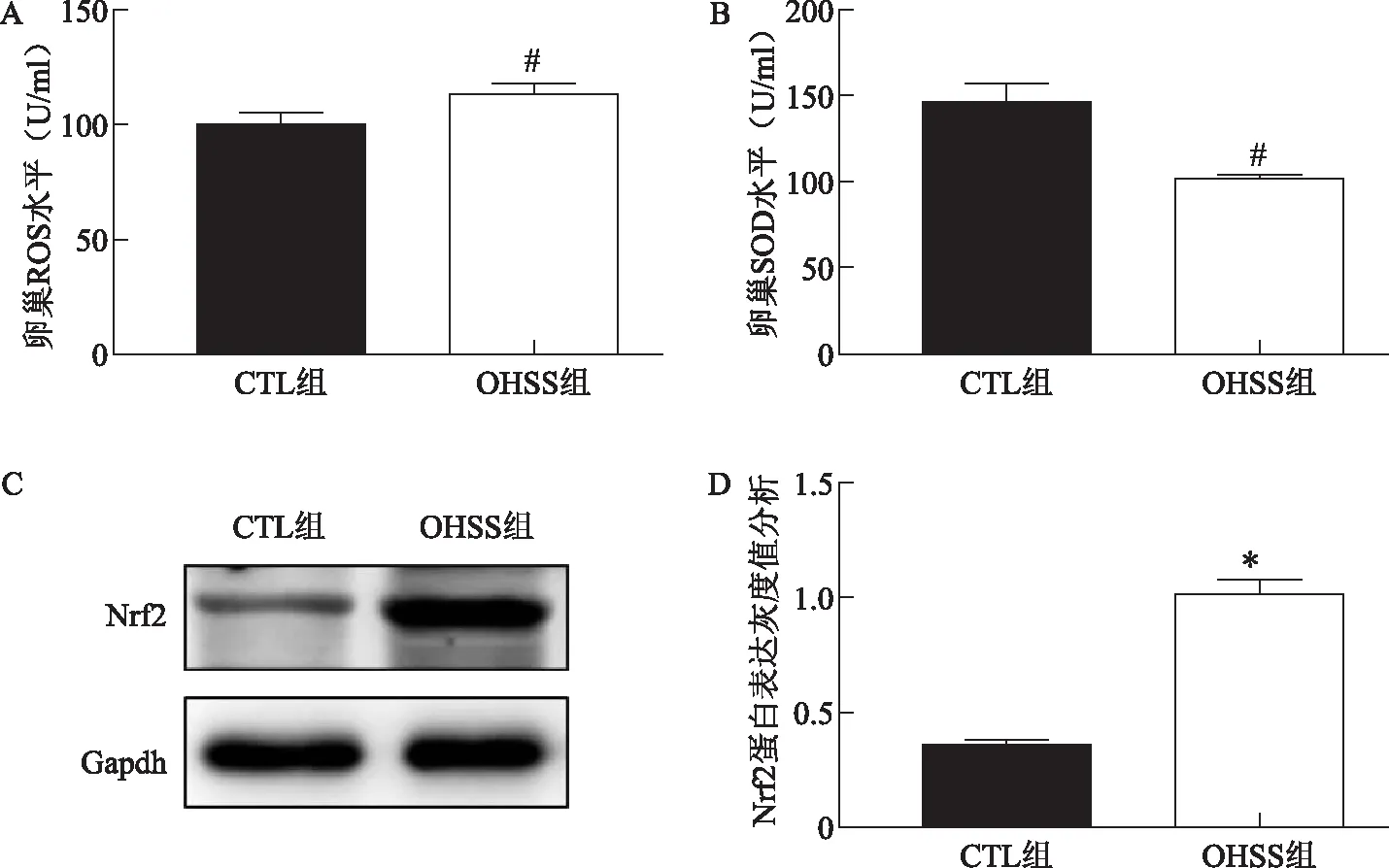
A、B:两组大鼠卵巢组织氧化应激水平比较;C、D:两组大鼠卵巢组织Nrf2蛋白的Western blot结果图及蛋白条带灰度分析。与CTL组比较,#P<0.05,*P<0.001。
2.两组大鼠卵巢组织凋亡相关蛋白的比较:活性氧的增加容易引起细胞凋亡增加。与CTL组相比,OHSS组卵巢内促凋亡蛋白Bax表达显著减少(P<0.05),而抗凋亡蛋白Bcl-2的表达显著增加(P<0.05);p53蛋白、活性caspase-3表达水平同样显著减少(均P<0.05)(图6)。
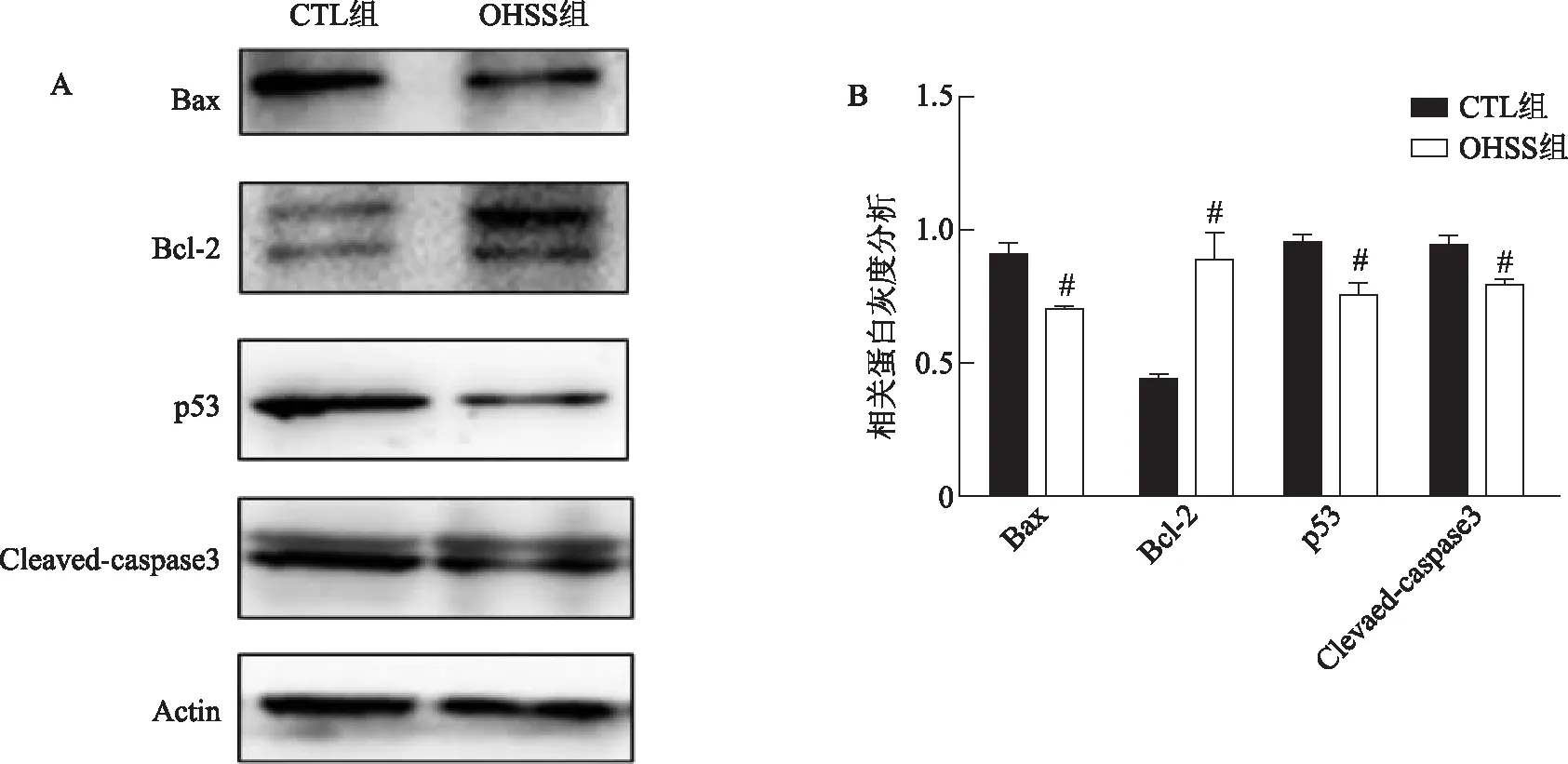
A:两组大鼠卵巢组织凋亡相关蛋白(Bax、Bcl-2、p53、Cleaved-caspase3)的western blot结果;B:两组大鼠卵巢组织凋亡相关蛋白的蛋白条带灰度值分析。与CTL组比较,#P<0.05。
讨 论
本研究采用PMSG联合HCG构建OHSS模型大鼠[9]。结果发现OHSS组大鼠卵巢组织形态及结构发生显著改变,卵巢组织自噬水平、氧化应激水平显著增加,而抗氧化能力及细胞凋亡相关蛋白均显著下降。本研究首次提出自噬、氧化应激及凋亡在OHSS发生中的作用及相关调节机制。
卵巢体积增大、生殖激素水平增高、血管通透性增加是OHSS的主要表现。本研究发现,OHSS模型组卵巢体积、重量均显著增加,血清生殖激素水平也显著升高;HE染色结果显示,卵巢组织形态学改变主要表现为黄体、血体数目的增加、各级生长卵泡和闭锁卵泡数目的减少。前期研究发现,OHSS模型大鼠卵巢组织中黄体细胞增殖显著增加。本研究还发现,OHSS组大鼠卵巢中促凋亡蛋白均显著减少。卵泡的生长发育与颗粒细胞的增殖与凋亡显著相关,颗粒细胞凋亡促进卵泡闭锁的发生[7,12]。本研究结果显示,OHSS大鼠卵巢组织中闭锁卵泡显著减少,且与促凋亡相关蛋白减少、抑制凋亡蛋白增加结果一致。因此,OHSS大鼠卵巢形态学和血清生殖激素高水平的改变可能与卵巢内细胞增殖增加、凋亡减少有关。
在生理水平上,ROS作为细胞信号的次级信使,在卵泡发生、减数分裂和排卵中起着重要的调节作用[13];在老龄鼠卵巢组织内ROS产生增加,与卵泡发育、炎症、凋亡密切相关[14]。应激条件下,自噬发挥防止细胞损伤并促进细胞存活的保护功能;ROS可以激活自噬,自噬通过负反馈作用保护细胞,从而维持颗粒细胞的稳定[15-17]。细胞凋亡和自噬之间存在着密切的联系,一些调节凋亡的基因也可以调节自噬;反之,调节自噬的基因对凋亡也有影响。在自噬发生的最初阶段,可以清除细胞内一些有害的的代谢产物,如ROS、错误折叠的蛋白等,进而减少凋亡[18]。本研究发现,OHSS大鼠卵巢组织中ROS水平增高、自噬水平增加,同时凋亡相关蛋白表达减少。推测卵巢过度刺激可能通过调节卵巢中氧化应激,诱导自噬水平升高,并进一步减少细胞凋亡,促进卵巢黄体的形成并产生大量激素。
Nrf2具有广泛的细胞保护作用,是目前认为最重要的抗氧化通路,在应激状态下Nrf2迅速积累,进入细胞核内调节抗氧化基因表达并发挥保护细胞的作用[19-20]。本研究中OHSS大鼠卵巢组织中Nrf2蛋白水平显著增高,推测卵巢过度刺激可能上调Nrf2表达发挥其细胞保护作用,清除ROS、降低自噬水平,进而减少卵巢细胞凋亡。
综上所述,自噬、氧化应激在OHSS卵巢组织结构和功能改变中发挥重要作用。卵巢过度刺激可能通过诱导活性氧增加并导致自噬增加,自噬、Nrf2蛋白同时发挥抗氧化作用、抑制细胞凋亡的作用,最终导致OHSS大鼠血清生殖激素水平显著增加,黄体组织增多、闭锁卵泡等生长卵泡减少。细胞自噬是一个复杂的过程,以抑制或者诱导自噬为理论依据的临床应用,需要更加详细的体外及体内研究证据。

