肝素修饰酶6-O-磺基转移酶的高产量表达
杨灵康 陈卓 郭盈希

摘要 在化学酶法合成肝素过程中,肝素修饰酶6-O-磺基转移酶(6-OST)在肝素分子中N-乙酰基葡糖胺的C6羟基上进行硫酸化,以达到与肝素相似的硫酸化水平。构建的重组蛋白MBP-6-OST-3的纯化结果表明有较多杂蛋白条带,且蛋白浓度较低。利用定点突变原理设计引物,通过PCR扩增得到突变质粒pMAL-c2X-6-OST-3-linker-His。将突变质粒转化至大肠杆菌Rosetta-gamiB(DE3),实现了MBP-6-OST-3-His蛋白的表达。利用镍柱亲和层析系统将MBP-6-OST-3-His蛋白纯化,并通过SDS-PAGE电泳分析蛋白表达情况。该研究获得了具有高表达、高纯度的MBP-6-OST-3-His蛋白,这为获得高纯度的6-OST-3提供了可靠的方法以及为其应用于化学酶法合成肝素的研究提供了理论基础。
关键词 肝素;6-O-磺基转移酶;定点突变;大肠杆菌;蛋白表达
中图分类号 Q939.9 文献标识码 A
文章编号 0517-6611(2022)05-0081-04
doi:10.3969/j.issn.0517-6611.2022.05.021
开放科学(资源服务)标识码(OSID):
High-yield Expression of Heparin-modifying Enzyme 6-O-sulfotransferase
YANG Ling-kang,CHEN Zhuo,GUO Ying-xi
(School of Food Science and Engineering,Hefei University of Technology,Hefei,Anhui 230009)
Abstract In chemoenzymatic synthesis of heparin,the enzyme 6-O-sulfotransferase (6-OST) sulfated C6 hydroxyl of N-acetylglucosamine to achieve a sulfation level similar to that of heparin.The purification results of the constructed recombinant protein MBP-6-OST-3 showed contaminated protein bands,and the protein concentration was lower.In this paper,the principle of site-directed mutagenesis was used to design primers,and the mutant plasmid pMAL-c2X-6-OST-3-linker-His was obtained by PCR amplification.The mutant plasmid was transformed into Escherichia coli Rosetta-gamiB (DE3) to express MBP-6-OST-3-His protein.The MBP-6-OST-3-His protein was purified by a nickel column affinity chromatography system,and the protein expression was analyzed by SDS-PAGE electrophoresis.In this study,the MBP-6-OST-3-His protein with high expression and high purity was obtained,which provided a reliable method for obtaining high-purity 6-OST-3 and a certain theoretical basis for its application in the study of chemical enzymatic synthesis of heparin.
Key words Heparin;6-O-sulfotransferase;Site-directed mutagenesis;Escherichia coli;Protein expression
作者简介 杨灵康(1994—),男,安徽池州人,硕士研究生,研究方向:生物化学。
收稿日期 2021-06-07
肝素是一种线性的、高度硫酸化的糖胺聚糖,由葡萄糖醛酸(主要是艾杜糖醛酸)以1→4糖苷键与葡萄糖胺重复二糖单元组成[1-2]。肝素通常是临床上广泛使用的凝血抑制剂[3]。肝素广泛分布于动物细胞表面和细胞外基质中。肝素原料药可以从包括猪肠和牛肺在内的哺乳动物组织中提取,其中,猪的肠黏膜是肝素生产的最常用来源之一[4-5]。然而,动物源肝素生产供应链生产过程长,提取步骤多,易受污染。2008年的肝素钠污染事件,导致100余名患者因注射了被污染的肝素而死亡,原因是由于肝素掺入了过度硫酸化的硫酸软骨素[6]。因此,确保肝素安全来源是有意义的,需要建立安全可靠的肝素體外合成方法[7]。
目前,合成非动物来源肝素具有代表性的一种方法是化学酶促法。利用肝素前体多糖作为合成肝素的起始碳骨架,在体外通过N-脱乙酰基酶/N-磺基转移酶、C5-异构化酶、2-O-磺基转移酶(2-OST)、6-O-磺基转移酶(6-OST)和3-O-磺基转移酶(3-OST)催化,以3′-磷酸腺苷-5′-磷酸硫酸(PAPS)提供磺基,合成具有活性的肝素[8]。尽管化学酶法生产肝素具有广阔的前景,但仍存在很多挑战,其中包括几种肝素修饰酶的制备[9]。
6-OST是化学酶法合成肝素的一种肝素修饰酶。6-OST将PAPS中的磺基转移到氨基葡萄糖残基的6-OH位置以形成6-O-磺基氨基葡萄糖,是化学酶法合成肝素过程中必不可少的步聚[10]。6-OST已成功在大肠杆菌中进行重组表达。Chen等[11]将小鼠6-OST-3(Pro121-Pro450)的催化结构域克隆到载体pMAL-c2X中,并在带有质粒pGro7的origami-B细胞中表达,该质粒表达大肠杆菌的伴侣蛋白GroEL和GroES,但酶产量小于10 mg/L。因此,作为6种肝素生物合成酶之一,合成高产量的6-OST是用于化学酶法生产生物工程肝素的必要前提。
为获得高纯度的6-OST-3蛋白,该研究通过PCR扩增得到带有HIS-TAG的突变质粒pMAL-c2X-6OST-3-linker-His,并在大肠杆菌Rosseta-gami B细胞中进行蛋白表达。通过镍柱亲和层析系统进行蛋白纯化,获得了高纯度MBP-6-OST-3-His蛋白。该结果为获得高纯度的6-OST-3提供方法,并为后续将其应用于化学酶法合成肝素等研究提供了理论基础。
1 材料与方法
1.1 材料
表达载体pMAL-c2X-6OST-3由合肥工业大学食品与生物工程学院微生物与酶工程实验室保存;大肠杆菌菌株DH5α、Rosetta-gamiB(DE3)购于Invitrogen公司;PrimeSTAR GxL DNA聚合酶购于TaKaRa公司;SanPrep柱式质粒DNA提取试剂盒、柱式PCR产物纯化试剂盒、柱式DNA胶回收試剂盒购于上海普洛麦格生物产品有限公司。
1.2 方法
1.2.1 pMAL-c2X-6-OST-3-linker-His的构建与转化。根据定点突变原理,首先设计1对引物,以pMAL-c2X-6OST-3为模版通过聚合物链式反应(PCR)扩增带有3个His密码子的突变质粒,上下游引物分别为5′-GGCAGCAGCCATCATCATAAAATCGAAGAAGGTAAACTGGT-3′和5′-ATGATGATGGCTGCTGCCCATATGCTATGGTCCTTGTTGG-3′,再以突变后的质粒为模板,设计另1对引物,通过PCR反应扩增另外3个His密码子,上下游引物分别为5′-CATCATCACAGCAGCGGCAAAATCGAAGAAGGTAAACTGGTA-3′和5′-GCCGCTGCTGTGATGATGATGATGATGGCTGCTGCC-3′。因此,经2次PCR扩增后可直接得到突变质粒pMAL-c2X-6-OST-3-linker-His,PCR反应使用PrimeSTAR GxL DNA聚合酶,条件为:95 ℃ 5 min,95 ℃ 30 s,50 ℃ 30 s,72 ℃ 13 min,共16个循环,72 ℃延伸30 min。PCR产物经PCR产物纯化试剂盒纯化后,进行切胶回收,随后将PCR产物转化至DH5α感受态细胞,利用抗性平板(氨苄青霉素)筛选阳性克隆。
1.2.2 pMAL-c2X-6-OST-3-linker-His验证。对抗性平板筛选出的阳性克隆进行菌落PCR验证,PCR验证引物分别为5′-ATTCAACTTCACCCTCAAGGA-3′及5′-CCAGTGCCAAGCTTTTAGG-3′。反应条件为:95 ℃ 3 min,95 ℃ 5 s,50 ℃ 15 s,72 ℃ 15s,共30个循环,72 ℃延伸10 min。通过琼脂糖凝胶电泳检测目的条带大小以进行验证。选择条带大小符合的阳性克隆进行培养,通过质粒提取试剂盒将突变质粒pMAL-c2X-6-OST-3-linker-His提取并送样至通用生物公司进行质粒测序。将测序正确的质粒转化至Rosetta-gamiB(DE3)感受态细胞,以用于后续蛋白诱导的表达。
1.2.3 MBP-6-OST-3-His蛋白诱导表达。挑取大肠杆菌Rosetta-gamiB(DE3)/pMAL-c2X-6OST-3-linker-His单克隆,加入至含有3 mL LB的培养基中,37 ℃过夜振荡培养。次日将菌液转接于2 L LB培养基中,37 ℃振荡培养约3 h至生长对数期,使得OD 600值约为0.6。再向瓶中加入终浓度为0.2 mmol/L的诱导剂异丙基硫代半乳糖苷(IPTG),并于22 ℃振荡培养过夜。
1.2.4 MBP-6-OST-3-His蛋白纯化。将2 L过夜培养的细菌培养液进行收集,并于高速离心机中以5 000 g转速离心15 min,离心后收集细菌沉淀。用60 mL Buffer A(25 mmol/L Tris,500 mmol/L NaCl,30 mmol/L Imidazole,pH 7.5)将菌体重悬,并加入终浓度为100 μmol/L的苯甲基磺酰氟(PMSF)。充分混匀后,利用超声波破碎菌体细胞(工作时间5 s,暂停时间5 s,功率50%,运行时间30 min)。将细胞破碎液收集,于高速离心机中以12 000 r/min的转速,在4 ℃条件下离心20 min。离心后以收集上清,并通过0.45 μm滤膜过滤以去除杂质。利用镍亲和层析柱进行蛋白纯化。用10倍柱体积的Buffer A以1 mL/min的流速充分平衡镍亲和层析柱,将过滤后的粗蛋白溶液以同样流速上样后,用Buffer A(25 mmol/L Tris,500 mmol/L NaCl,30 mmol/L Imidazole,pH 7.5)洗脱杂蛋白,用Buffer B(25 mmol/L Tris,500 mmol/L NaCl,250 mmol/L Imidazole,pH 7.5)洗脱目的蛋白,分管收集洗脱液,通过SDS-PAGE电泳分析目的蛋白。收集浓度较高的蛋白洗脱液,用透析袋([MWCO]为14 kD)在2 L透析液Buffer C(25 mmol/L Tris,500 mmol/L NaCl,pH 7.5)中进行透析。将透析的蛋白6-OST-3收集于离心管,保存于-80 ℃。通过SDS-PAGE电泳分析目的蛋白,并利用Image J软件对目的蛋白进行定量。
2 结果与分析
2.1 MBP-6-OST-3蛋白诱导表达
将小鼠6-OST-3(Pro121–Pro450)的催化结构域克隆到载体pMAL-c2X中,并在带有pGro7质粒的origami-B(DE3)细胞中进行诱导表达,该质粒表达大肠杆菌的伴侣蛋白GroEL和GroES,结果见图1。图1中,泳道1为上样蛋白,泳道2为洗杂时蛋白,泳道3为洗脱目的蛋白。从图1可见,表达MBP-6-OST-3时,该蛋白虽然可溶性好,但蛋白洗脱后仍有较多杂条带,且蛋白浓度低,纯化后6-OST-3的產量仅为6.1 mg/L,蛋白的产量低。因此,需要对MBP-6OST-3进行改造以提高蛋白浓度和纯度。该研究拟在MBP-6OST-3质粒中加入HIS-TAG,并使用镍柱亲和层析对该蛋白进行纯化,从而提高蛋白的产量及纯化效率。
2.2 pMAL-c2X-6-OST-3-linker-His的构建
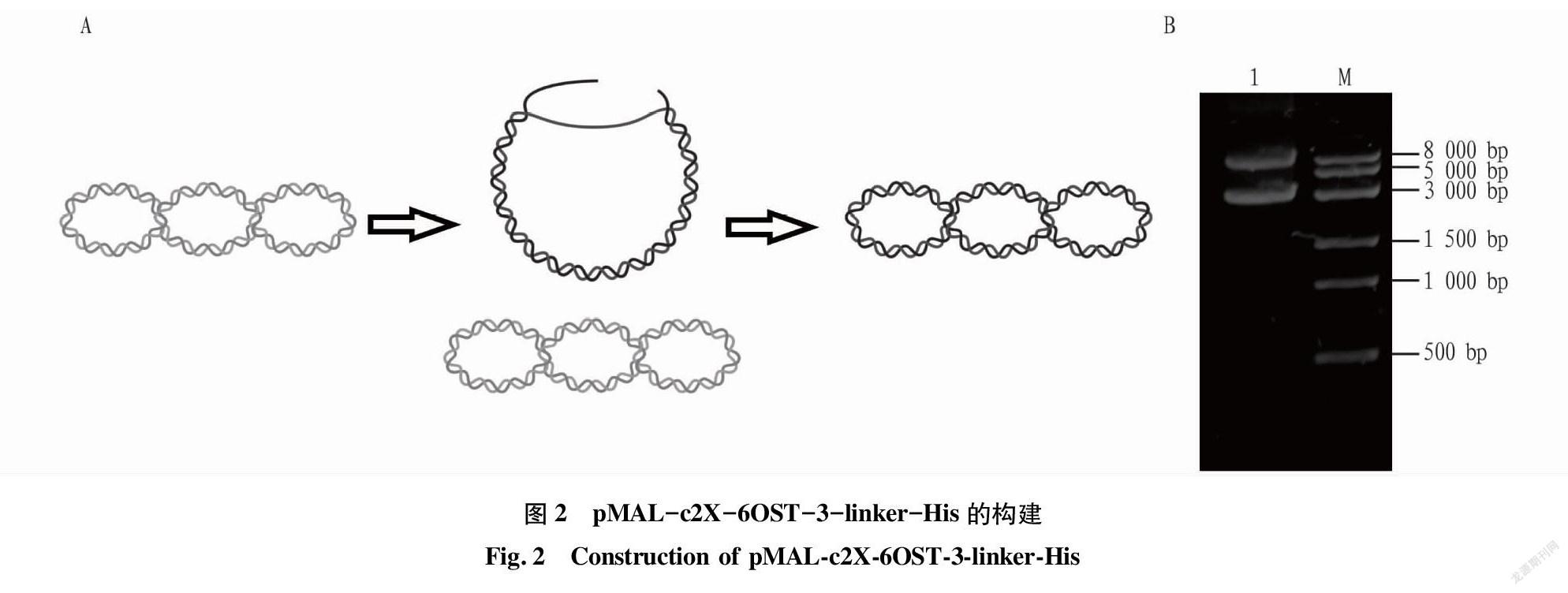
为获得高表达的6-OST,以质粒pMAL-c2X-6-OST-3为模板,通过2次PCR扩增后,可直接得到突变质粒pMAL-c2X-6-OST-3-linker-His。如图2A所示,由于在PCR扩增中新产生的DNA链组成的突变质粒有缺口,因而形成开环质粒,电泳迁移速度较超螺旋质粒更慢[12]。将突变质粒转化至DH5α感受态细胞后,开环质粒在细胞内缺口发生连接,重新恢复成超螺旋状态。用琼脂糖凝胶电泳检测扩增产物,结果见图2B,泳道1为扩增的质粒,可以看到2条带,分别为8 000 bp及3 000 bp附近,这是由于质粒存在开环和超螺旋2种形态所致。将这2个片段分别进行切胶回收及纯化,并分别转化至DH5α感受态细胞中,通过氨苄青霉素(Ap)抗性平板筛选阳性克隆,利用质粒提取试剂盒提取,并将突变质粒进行送样测序以进行验证。
2.3 pMAL-c2X-6-OST-3-linker-His的验证
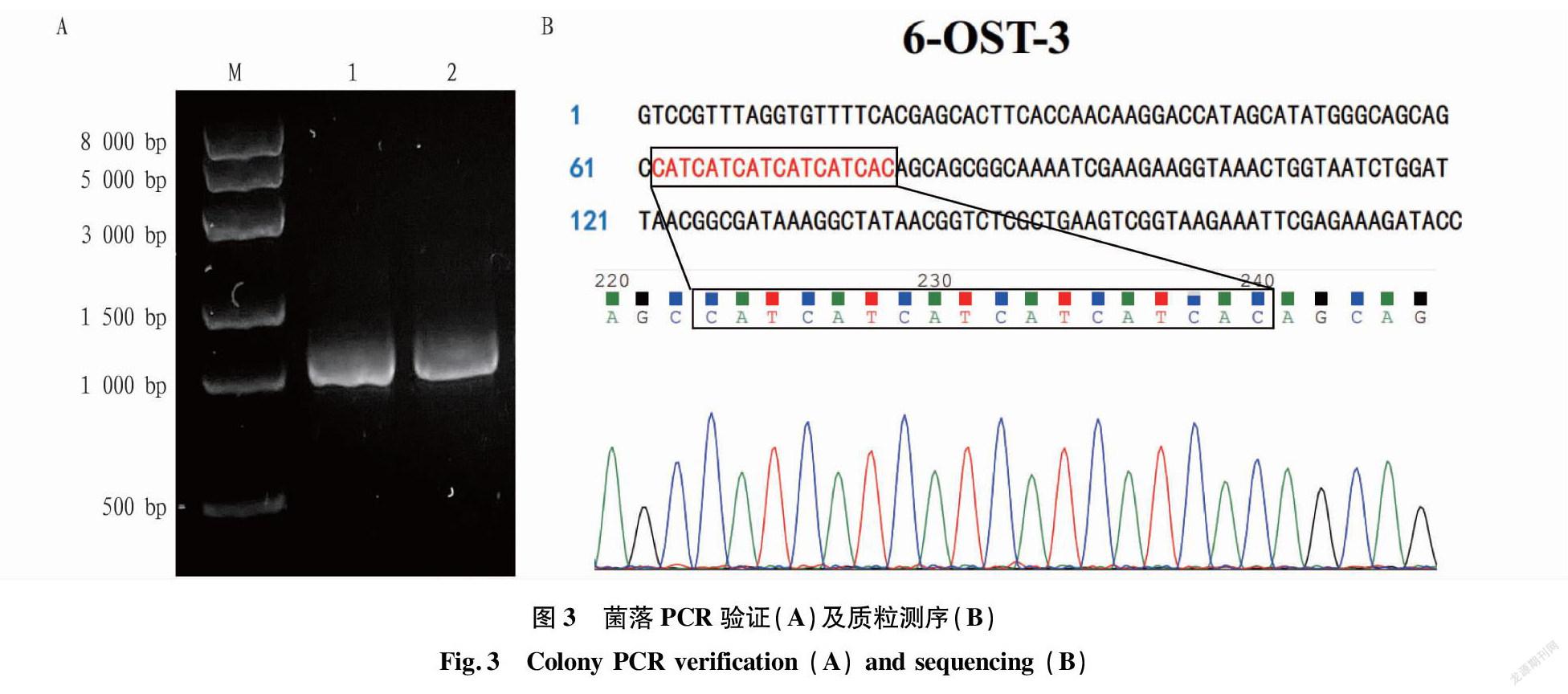
对构建的突变质粒pMAL-c2X-6-OST-3-linker-His转化后,进行菌落PCR验证,结果见图3。图3A为菌落PCR验证,泳道1、2为DH5α/pMAL-c2X-6-OST-3-linker-His菌落PCR验证的结果,DNA片段大小均符合理论值(990 bp)。随后将这2个阳性克隆进行质粒提取,并送样测序。由图3B可见,根据序列比对结果及测序波形图,可以发现突变质粒pMAL-c2X-6-OST-3-linker-His序列中的CATCATCATCATCATCAC为HIS-TAG的碱基序列,可确认测序质粒为正确的突变质粒。
2.4 MBP-6-OST-3-His表达与纯化
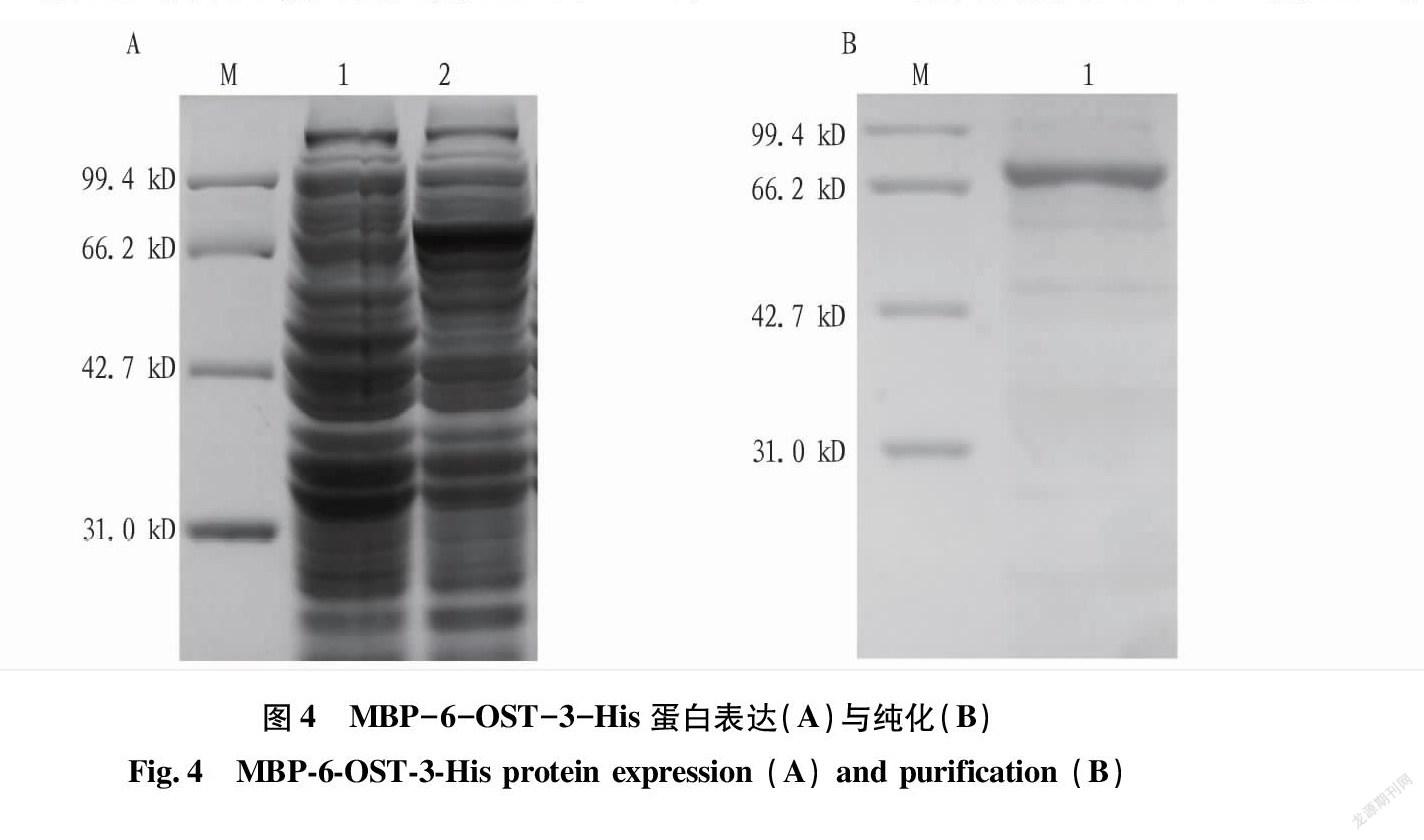
将DNA测序结果显示为正确的突变质粒转化到大肠杆菌Rosetta-gamiB(DE3)表达菌株中,用IPTG于22 ℃条件下诱导过夜。取500 μL诱导前、诱导后的菌液离心,用Buffer A重悬,通过SDS-PAGE电泳检测目的蛋白的表达情况,结果见图4。图4A中泳道M为蛋白Marker,泳道1为诱导前的蛋白,泳道2为诱导后的蛋白。结果表明,泳道2在81 kD附近有较为明显的蛋白条带,这与MBP-6-OST-3-His的蛋白分子量大小一致。为了得到纯化的蛋白MBP-6-OST-3-His,利用镍柱亲和层析系统进行蛋白纯化,并将目的蛋白浓度较高的蛋白洗脱液进行透析,收集在离心管中,保存于-80 ℃冰箱。对所得透析液进行SDS-PAGE电泳分析,结果见图4B,泳道M为蛋白Marker,泳道1为纯化后的蛋白,只有1条带,为目的蛋白MBP-6-OST-3-His,且纯化效果较好。利用Image J软件对纯化后的目的蛋白MBP-6-OST-3-His进行定量,MBP-6-OST-3-His蛋白浓度为153.8 mg/L,远高于MBP-6-OST-3纯化后蛋白浓度。这说明MBP-6-OST-3质粒加入HIS-TAG后,蛋白纯化效率和产量得到了显著提升。
3 结论
该研究为获得高产量的6-OST-3蛋白,向MBP-6-OST-3质粒中加入HIS-TAG,从而构建突变质粒pMAL-c2X-6-OST-3-linker-His,将突变质粒转化至大肠杆菌Rosetta-gamiB(DE3)菌株中进行蛋白表达。首先以pMAL-c2X-6OST-3质粒为模板,经2次PCR扩增后得到突变质粒pMAL-c2X-6-OST-3-linker-His。由于突变质粒在扩增后有缺口,从而呈现为开环质粒状态,区别于从细胞提取的非突变超螺旋质粒。此外,通过PCR扩增,将质粒进行突变,经过切胶回收纯化后可直接转化至DH5α感受态细胞中,这比通过酶切酶连加入外源DNA的传统方法更加迅速便捷。最后,将突变质粒转化至宿主大肠杆菌Rosetta-gamiB(DE3)菌株中进行蛋白表达,经过镍柱纯化可以得到高浓度、高纯度的MBP-6-OST-3-His。该结果为获得高纯度的6-OST-3提供了可靠方法,以及为后续将其应用于化学酶法合成肝素等研究提供了一定的理论基础。
参考文献
[1]
GREEN J V,ORSBORN K I,ZHANG M L,et al.Heparin-binding motifs and biofilm formation by Candida albicans[J].J Infect Dis,2013,208(10):1695-1704.
[2] LIU J,LINHARDT R J.Chemoenzymatic synthesis of heparan sulfate and heparin[J].Nat Prod Rep,2014,31(12):1676-1685.
[3] LIU H Y,ZHANG Z Q,LINHARDT R J.Lessons learned from the contamination of heparin[J].Nat Prod Rep,2009,26(3):313-321.
[4] LINHARDT R J.2003 Claude S.Hudson Award address in carbohydrate chemistry.Heparin:Structure and activity[J].J Med Chem,2003,46(13):2551-2564.
[5] HAO C,XU H M,YU L F,et al.Heparin:An essential drug for modern medicine[J].Prog Mol Biol Transl Sci,2019,163:1-19.
[6] GUERRINI M,BECCATI D,SHRIVER Z,et al.Oversulfated chondroitin sulfate is a contaminant in heparin associated with adverse clinical events[J].Nat Biotechnol,2008,26(6):669-675.
[7] WANG T,LIU L,VOGLMEIR J.Chemoenzymatic synthesis of ultralow and low-molecular weight heparins[J].BBA-Proteins Proteom,2020,1868(2):1-11.
[8] PETERSON S,FRICK A,LIU J.Design of biologically active heparan sulfate and heparin using an enzyme-based approach[J].Nat Prod Rep,2009,26(5):610-627.
[9] ROY A,MIYAI Y,ROSSI A,et al.Metabolic engineering of non-pathogenic Escherichia coli strains for the controlled production of low molecular weight heparosan and size-specific heparosan oligosaccharides[J/OL].Biochim Biophys Acta Gen Subj,2021,1865(1)[2021-01-17].https://doi.org/10.1016/j.bbagen.2020.129765
[10] XU Y M,MOON A F,XU S Q,et al.Structure based substrate specificity analysis of heparan sulfate 6-O-sulfotransferases[J].ACS Chem Biol,2017,12(1):73-82.
[11] CHEN J H,JONES C L,LIU J.Using an enzymatic combinatorial approach to identify anticoagulant heparan sulfate structures[J].Chem Biol,2007,14(9):986-993.
[12] IROBALIEVA R N,FOGG J M,CATANESE D J,et al.Structural diversity of supercoiled DNA[J].Nat Commun,2015,6(1):1-11.

