联合消融的综合疗法在进展期胰腺癌中的应用现状与进展
张宸恺,张 彬,顾玉青,李亚男,钱祝银
南京医科大学第二附属医院胰腺中心,江苏 南京 210023
胰腺癌是一种恶性程度较高的消化系统肿瘤,具有起病隐匿、进展迅速的特点。2020年胰腺癌患者中位生存期仅6个月,5年生存率仅8%[1],在所有胰腺癌患者中,仅20%的患者为可切除胰腺癌[2],剩余患者已经失去根治手术机会(不可切除胰腺癌包括40%~50%的局部进展期胰腺癌和50%转移性胰腺癌)。调查统计显示,局部进展期及转移性胰腺癌患者中位生存期仅3~6个月[3]。针对进展期胰腺癌患者,最普遍的方案为化疗、放疗或两者结合,然而效果不理想。如何减轻患者痛苦、延长患者寿命无疑是进展期胰腺癌最为关心的问题。对于进展期胰腺癌,国内外指南一致推荐需要多学科、多手段联合治疗,并开展相应技术的临床研究[4--5]。
1 胰腺癌常用的消融方法
消融技术治疗实体肿瘤历史悠久,在进展期胰腺癌中应用消融技术一直是近年来的研究热点。诸多学者开展了各类消融技术的实验及临床研究,并形成了具有特色的以消融为核心的综合治疗手段,其中主要包括如下几类消融技术:射频消融(radio-frequency ablation,RFA)、微波消融(microwave ablation,MWA)、冷冻消融(cryoablation)、不可逆电穿孔(irreversible electroporation,IRE)和高强度聚焦超声(high intensity focused ultrasound,HIFU)。热消融技术一直是研究的焦点:例如RFA、MWA 是基于高温技术,通过射频电极产生交流电或电磁波等一系列效应产生热量,使蛋白质发生变性,毁坏肿瘤组织,产生杀伤肿瘤的效果[6-7]。冷冻消融则是基于低温技术,自1960 年起应用于临床,利用深低温形成冰晶,损伤肿瘤周边血管,促使局部血栓形成等一系列机制杀伤肿瘤,且可通过诱导急性炎症产生各类细胞因子从而诱导肿瘤免疫反应(这一现象通常称为冷冻免疫)[8]。近来特殊的消融技术也逐渐应用于该领域,HIFU 在概念上类似于高温消融,但研究相对较少。HIFU是唯一的无创疗法,它使用多个超声波束探头,并将他们聚焦在选定的焦点区域,焦点区在超声波的热效应下发生凝固性坏死,从而产生抗肿瘤效应[9]。IRE 则依靠其插在肿瘤及周围组织的针电极产生高压电脉冲,破坏细胞膜产生纳米孔,从而诱导程序性的细胞凋亡[10]。
各类消融技术优缺点各有不同,应用时,由于胰腺解剖方位深,临近器官较多,热消融可能会导致周围关键血管、胆管、十二指肠损伤,因此非热消融如IRE 具有优势,几乎不会对周围组织及血管构成伤害[11],亦不存在“热沉效应”(指在消融靶区域附近的血流因对流导热使组织温度相对下降的现象,出现热消融效果低于预期情况)的负性影响[12]。但IRE在合并心律失常、心脏起搏器植入及胆道支架置入患者中应用有限制[13-14],IRE设备厂商Nanoknife®在其说明书中亦提到金属支架区域消融是绝对禁忌。此外,冷冻消融对于较大血管(通常直径大于3 mm)具有保护作用,由于其消融区域附近的大血管血流速度快,对流导热效应强,能迅速将冷量带走,因此安全性高,但是低温仍对胰腺及周围组织有潜在损伤可能,胰腺炎、胃排空延迟均有报道[15]。总之,临床实际应用中,应根据患者自身状况选择合适的方法,且单一消融治疗效果相对有限,联合各种抗肿瘤治疗可以提高生存率、减少复发或转移,更合理地治疗胰腺癌。
消融患者术后并发症一直是临床医生所关心的问题(表1)。张彬等[8]回顾性分析了30例接受冷冻消融患者的术后并发症类型及严重程度,8 例患者出现胰瘘(7例A级,1例B级),7例患者出现胃排空延迟,均予以对症治疗后顺利出院。Martin 等[16]在其前瞻性研究中发现,200 例接受IRE 治疗的患者中,不良事件总发生率为37%,死亡率为2%(1例为术后肿瘤侵犯所致消化道溃疡出血,1例为完全门静脉及肠系膜上静脉闭塞所致的肝功能衰竭,1 例肺动脉栓塞),最常见的并发症为胃肠道不良反应(46 例,恶心呕吐、腹水形成、厌食等),血管相关并发症(11例,假性动脉瘤、深静脉血栓、非闭塞性门静脉或肠系膜上静脉血栓等),胰腺相关并发症(2例,胰腺炎、胰瘘等)并不多见,所有患者并发症在经过处理后均顺利出院,无复发。Saccomandi 等[17]在对热消融技术的总结报告中分析了279例RFA患者的术后并发症,12 例胰瘘,10 例门静脉血栓形成,8 例胰腺炎,3 例十二指肠损伤,2 例患者因腹腔出血行二次手术。死亡2 例,1 例术后化疗引起肝功能衰竭,1 例十二指肠穿孔引起败血症。总体而言,消融患者术后常见并发症类似,症状轻微,尽管发生率不低,却大多以胃肠道反应、轻度的胰腺炎、胰瘘等短期并发症为代表,常予以保守治疗好转,甚至患者自行治愈,血管并发症、假性囊肿等症状通过血管介入或微创引流手术亦可解决,不影响预后。死亡患者常常为肿瘤进展、其他治疗带来的严重并发症所致,而非技术本身的缺陷。因此,消融术后并发症并不是消融技术在临床应用中的阻碍,且不影响预后。

表1 各类消融患者术后并发症类型及死亡情况Table 1 Different types of postoperative problems and mortality in ablation patients
2 以消融为主体的综合治疗
热消融覆盖区域中,中心致死温度外的过渡带为亚致死区域,在这边缘肿瘤细胞通常不能完全破坏,因此需要辅助治疗来进一步增强肿瘤消融效果。同样,研究发现,利用IRE 形成纳米孔道的特点,联合纳米技术,将细胞毒性或肿瘤免疫药物带入肿瘤细胞[18],可进一步增强IRE 的抗肿瘤效果。辅助治疗通常包含了传统放化疗、免疫治疗或125I粒子植入、中医等方案。
2.1 消融联合化疗
化学治疗是胰腺癌治疗最普遍的手段,以吉西他滨或氟尿嘧啶为基础的一线方案如白蛋白结合型紫杉醇联合吉西他滨方案(AG 方案),体力较好的患者推荐使用FOLFIRINOX(伊利替康、氟尿嘧啶、亚叶酸钙及奥沙利铂)方案[5]。消融患者的化疗方案与之类似,可接受术前诱导或术后辅助化疗。Liu 等[19]在其开展的前瞻性研究中发现,58 例Ⅲ/Ⅳ期患者接受了IRE 治疗,其中31 例接受术后化疗(5 例FOLFIRNOX 方案,26 例吉西他滨单药),结果显示,Ⅲ期、Ⅳ期联合治疗组中位生存期分别为20.3、3.5 个月,单纯IRE 组仅16.2、11.6 个月(P<0.05)。同样,局部进展期胰腺癌患者接受诱导化疗后行RFA 或IRE 的回顾性临床试验中,所有患者接受以吉西他滨为基础的方案或FOLFIRINOX 方案,在诱导化疗后,两组患者1 年及2 年生存率达到60.7%及42.5%[20]。在针对转移性胰腺癌的治疗研究中,Li 等[21]将所有患者分为HIFU 联合化疗组及单纯化疗组,所有患者均为S-1 化疗方案(2~6 个周期),观察发现,联合组中位生存期为10.3 个月,显著优于单药化疗(中位生存期6.6个月)。
2.2 消融联合放化疗
放疗可以有效降低胰腺癌局部复发率,缓解患者疼痛及局部梗阻症状,但临床很少单独对胰腺癌使用放疗。实践中,通常联合化疗形成同步放化疗方案。在前瞻性LAP07 实验研究中,449 例进展期胰腺癌患者预先接受4 个月吉西他滨(或加用厄洛替尼)方案,所有未进展患者分为放化疗组(卡培他滨,50.4 Gy)及化疗组,结果显示,放化疗组的中位生存期与化疗组相差不大(15.2 个月vs.16.5 个月,P>0.05),但放化疗在局部控制方面显著优于单独化疗(46%vs.32%,P<0.05)[22]。因此接受消融的患者通常也多联合术前/后放化疗。一项IRE 联合放疗的回顾性临床研究阐述了消融与放疗的协同作用,放疗的细胞毒性依赖于氧,肿瘤中心区域为乏氧区,效果有限。而消融中心肿瘤细胞基本死亡,但热消融的“亚致死温度”区肿瘤细胞存活率较高,放疗可针对杀伤亚致死区剩余肿瘤细胞,形成“互补治疗区域”[23]。一项24例术前放化疗(方案未指出)的局部进展期胰腺癌患者后续行IRE的回顾性生存分析指出,该方案患者自诊断后总中位生存期为17.9个月(IRE后的中位生存期为7.0个月)[24]。术后放化疗联合消融治疗研究结果也指出,8例局部进展期胰腺癌患者统一接受吉西他滨(600 mg/m2,6周方案)单药化疗,患者在化疗后行三维适型放射疗法(50.4 Gy,常规分割),其中23例患者生存期达12个月,最长生存时间为18个月[25]。
2.3 消融联合免疫疗法
现有指南指出,对具有微卫星不稳定/错配修复分子特征且转移性胰腺癌患者,新型药物PD-1抗体是推荐的选择[4]。但相比于其他实体肿瘤而言,免疫检查点抑制剂在胰腺癌患者中的反应较差[26],这与胰腺癌肿瘤微环境有关,胰腺癌细胞周围包围着大量基质,这些基质参与调控肿瘤局部微环境,阻碍药物发挥作用[27]。消融治疗的原理除了原位破坏肿瘤,还有形成肿瘤“原位疫苗”,刺激先天性及适应性免疫[28]。所有方式的消融均可以引起肿瘤免疫,基于高温消融技术的免疫效应通常较弱,冷冻消融及IRE两项技术均因低温或非热消融效应使肿瘤抗原得以保存并释放入血,诱导的免疫反应比RFA 或MWA 更强,因此消融技术联合免疫治疗比单纯免疫治疗具有优势。然而肿瘤消融释放的抗原难以精确衡量,消融后免疫指标难以量化分级,不同患者之间异质性较高,消融的抗肿瘤免疫反应强度不足,因此联合免疫治疗是未来的趋势。
RFA 消融后出现明显的局部炎症反应,伴有局部丰富的T 细胞浸润,表明RFA 引起的热休克传递和大量坏死细胞导致免疫激活和其他抗原的呈递,从而诱导肿瘤特异性T细胞反应[29]。胰腺癌热消融联合免疫治疗的临床试验尚未见报道,但在RFA联合PD-1抗体治疗转移性肝癌的回顾性临床研究中发现,RFA治疗后可以上调患者术后免疫细胞中PD-1受体数量,从而增强患者免疫效应[30]。
消融联合免疫治疗的临床研究多见于IRE 术后,Sheffer等[31]发现,接受IRE消融后的胰腺癌患者外周血中观察到与免疫抑制有关的调节性T 细胞(Treg)数量明显下调,PD-1阳性T细胞增加,这意味着IRE提供了免疫活化“窗口期”,给应用PD-1抗体提供了机会。一项IRE联合自然杀伤细胞治疗胰腺癌的前瞻性研究中,共40 例患者接受了IRE 治疗,术后一半患者接受免疫疗法,研究表明,联合组患者的生存质量明显提高,且观测到更明显的CA19-9、CA-242 下降,术后免疫细胞比例增加,生活质量改善,短期临床效果可靠[32]。
冷冻消融联合免疫疗法的研究亦是热点,冷冻消融诱导的免疫效应强烈,冷冻免疫存在不稳定性,原因在于免疫抑制或激活取决于凋亡与坏死细胞的比例。通常而言,坏死更利于免疫的激活,而随着时间的推移,细胞凋亡及坏死的比例也会变化,免疫状态也随之改变[33]。因此,单纯依靠冷冻消融实现抗肿瘤效应具有局限性,联合免疫疗法具有很好的潜力。在实际临床试验中,姚飞等[34]回顾性分析了冷冻消融联合DC-CIK 免疫疗法治疗转移性胰腺癌的疗效,研究中联合组中位生存期最长,为13 个月,显著长于单独冷冻组、免疫组及化疗组(中位生存期分别为7、5及3.5个月)。
2.4 消融联合125I粒子植入
125I 粒子是近年来发展起来的新型低剂量粒子源,有效辐照半径为15~20 mm,半衰期59.43 d,植入人体后通过低剂量连续辐照导致靶器官区域高剂量辐射聚集,破坏肿瘤细胞DNA 产生抗肿瘤效应,同时对周围正常组织没有显著影响[35],具有较高的安全性,因此在实体恶性肿瘤中取得较好的治疗效果。因此,125I粒子植入联合消融手术可以进一步巩固消融后的抗肿瘤效应。仝昊等[36]纳入26 例进展期胰腺癌患者行IRE 联合125I 粒子植入进行前瞻性研究,单纯行IRE 组的无进展生存期及中位生存期仅7 个月和8 个月,而联合治疗组具有更长的无进展生存期及中位生存期(分别为9.5 个月和13 个月)。
2.5 消融联合中医疗法
中医研究中,局部晚期胰腺癌常见证型为肝郁脾虚毒聚,因而中医研究常使用以大柴胡汤为基础方的调肝理脾化积方,能达到较理想的效果,李娜等[37]通过将HIFU和调肝理脾化积方结合治疗局部晚期胰腺癌患者(对照组使用吉西他滨化疗6 个周期),使用QOL-C30 评价临床受益率,联合组患者受益更高,但1年治疗组中位生存期与对照组相似(253 d和246 d),并未见显著差异(表2)。
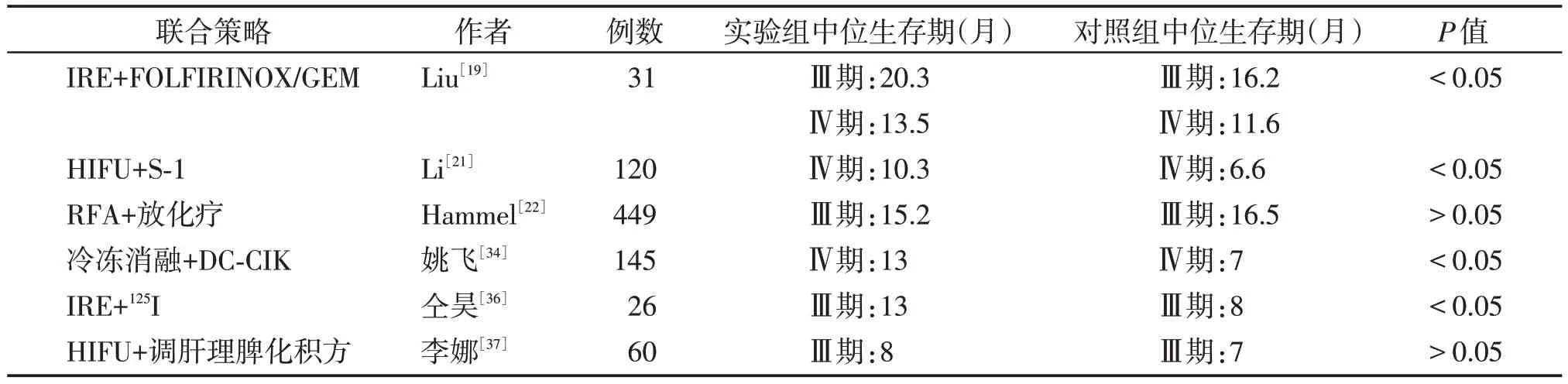
表2 联合疗法治疗的胰腺癌患者总体生存期情况Table 2 Overall survival of pancreatic cancer patients treated with combination therapy
3 总结
综上所述,目前各种消融手段的使用,填充了进展期胰腺癌补充治疗的空白。消融的安全性及有效性确切,目前联合消融治疗,建立多种治疗为一体的多学科方案,从动物实验至临床应用已经证实了其安全性、有效性。目前不足在于,尽管最近已有由荷兰胰腺小组(DPCG)发起了多中心、随机对照临床实验(PELICAN),旨在探究RFA与化疗联合的有效性[38],但目前仍缺少消融综合治疗的高级别循证医学证据。总体而言,消融联合各类抗肿瘤手段治疗进展期胰腺癌充满前景,具有推广意义。

