HBV X 区A1762T/G1764A 突变对肝癌细胞增殖、迁移和侵袭及PI3K/AKT/mTOR 信号通路的影响
于飞 杨育华 赵阳 黄天壬


摘要:目的:探究HBV X区A1762T/G1764A突变对人肝癌HepG2细胞磷脂酰肌醇-3-激酶(the phosphatidylinositol 3-kinase,PI3K)/丝氨酸/苏氨酸蛋白激酶B(serine/threonine protein kinase B, AKT)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路的影响。方法:体外培养人肝癌 HepG2细胞;将HepG2细胞随机分为慢病毒空白载体(阴性对照)组、HBX-wt(野生型)组,HBX-A1762T/G1764A(实验)组。实时荧光定量 PCR(RT-qPCR)法检测各组细胞PI3K、AKT、mTOR的表达情况;蛋白印迹分析法检测各组细胞磷酸化磷脂酰肌醇-3-激酶(p-PI3K)、磷酸化丝氨酸/苏氨酸蛋白激酶B(p-AKT)、磷酸化哺乳动物雷帕霉素靶蛋白(p-mTOR)表达情况。CCK8和平板克隆形成实验检测细胞增殖情况,Transwell实验检测细胞迁移和侵袭情况。结果:与阴性对照组和HBX-wt组相比,HBX-A1762T/G1764A组PI3K AKT、mTOR基因表达水平升高(P<0.05);p-AKT及p-mTOR水平升高(P<0.05);HBX-A1762T/G1764A组HepG2细胞增殖速率、迁移和侵袭细胞数升高(P<0.05)。结论:HBVX区A1762T/G1764A双突变可能调控了肝癌HepG2激活了PI3K/AKT/mTOR信号通路,同时增强了HepG2细胞的增殖、迁移和侵袭。HBVX区A1762T/G1764A突变可能是HBV所致HCC诊断和治疗的潜在靶点。
关键词:肝癌,HBV,HBX区A1762T/G1764A突变,PI3K/AKT/mTOR
【中图分类号】R735.7 【文献标识码】A 【文章编号】1673-9026(2022)06--02
肝细胞癌(hepatocellular carcinoma, HCC简称肝癌)是世界最常见的恶性肿瘤之一。乙型肝炎病毒(Hepatitis B virus, HBV)慢性感染是HCC发生的主要危险因素。根据流行病学调查显示,全球HCC病例中大约53%与HBV感染有关[1],其中95%以上的感染者有不同程度的HBV突变[2]。HBx由HBV的X开放阅读框编码,在肝癌的发生过程中起着至关重要的作用[3]。HBx还可以促进HBV的复制,调节生物过程,如宿主基因转录、细胞周期进程和氧化应激[4-6]。结合国内外研究进展与本课题组前期研究发现,HBV X 区的A1762T/G1764A突变为有差异的热点突变,差异有统计学意义[7]。
PI3K/AKT/mTOR信号通路在生理和病理条件下对细胞生长和存活的许多方面都是十分重要的[9]。本研究在体外建立了人肝癌细胞HBX突变模型,以探讨HBV X区A1762T/G1764A突变对人肝癌HepG2细胞株增殖、迁移和侵袭及PI3K/AKT/mTOR通路影响,为肝癌治疗提供可能的新靶点。
1 材料与方法
1.1主要材料与试剂
人肝癌HepG2细胞株,课题组前期购买。特级澳洲胎牛血清、DMEM高糖型细胞培养基:美国Gbico公司。逆转录试剂盒以及qRT-PCR试剂盒:日本TaKaRa 公司。慢病毒表达載体HBX-A1762T/G1764A突变组、HBx野生型组、阴性对照组。HBX、PI3K、AKT、mTOR基因引物:上海生工生物工序股份有限公司。乙型肝炎病毒X多克隆抗体:美国Abcam公司。beta-ActinRabbit mAb、PI3Kinase plloalpha Rabbit mAb、Phospho-PI3 Kinase Rabbit mAb、AKT Rabbit mAb、p-AKTRabbitmAb、mTORRabbitmAb、p-mTORRabbitmAb:美国CST公司。
1.2 细胞分组和转染
HepG2细胞用含10%胎牛血清的DMEM高糖型细胞培养基培养。取对数生长期细胞接种于6孔板中。待细胞密度约为30%-50%时,按慢病毒使用说明书进行转染。实验分组:(1)转染慢病毒空白载体的阴性对照组(NC),转染含HBX野生基因型序列的野生型组(WT),转染含HBX野生基因序列发生A1762T/G1764A位点联合突变的实验组(EG)。
1.3 RT-qPCR实验检测HBX、PI3K、AKT、mTOR的表达
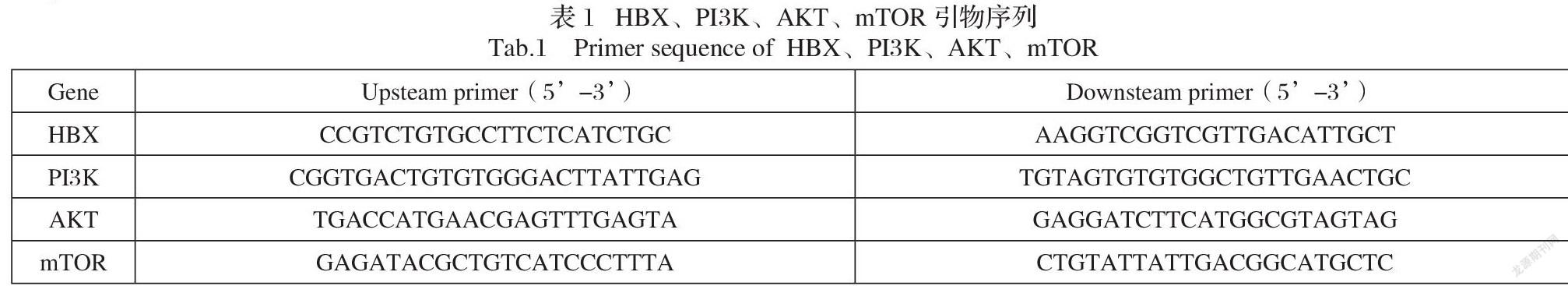
按照Trizol试剂盒说明书提取各组细胞总RNA,逆转录得cDNA,然后按照qRT-PCR试剂盒说明进行PCR扩增。PCR反应条件为:95 °C变性10min,60°C退火 30s、72 °C延伸 40min,共40个循环。以GAPDH为内参,2-ΔΔCt法计算HBX、PI3K、AKT、mTOR表达水平。引物序列见表1。
1.4Western blot检测HBx、p-PI3K、p-AKT、p-mTOR蛋白表达
收集各组细胞,加入RIPA裂解液提取各组细胞总蛋白。取30μg蛋白样品行SDS-PAGE凝胶电泳,转膜、快速封闭液封闭后,加入一抗HBx、PI3K、p-PI3K、AKT、p-AKT、mTOR、p-mTOR、β-actin (1∶1 000), 4℃摇床孵化过夜;次日洗膜后加入1∶2000稀释的山羊抗兔IgG作为二抗,室温孵化1 h,TBST洗涤后,加入ECL显色发光,凝胶成像仪成像。以为β-actin内参, Image J软件测定蛋白灰度值,计算各组各蛋白相对表达量。
1.5CCK-8实验检测细胞的增殖能力
将各组细胞接种至96孔板中常规培养,每组设置5个复孔。分别于培养24h、48h、72h时,向每孔加入CCK-8试剂,于37℃培养箱中孵育2h后,使用多功能酶标仪检测450nm波长处的光密度(OD)值。
1.6平板克隆形成实验检测细胞的增殖能力
将各组细胞接种至6孔板(约1000/孔)中,每组设置3个复孔。加入2m L完全培养基,置于37℃、5%CO2的细胞培养箱中培养,每隔4~5d更换1次培养基。培养11~15d后,当孔中出现肉眼可见细胞克隆球时,弃去培养基,PBS清洗后,用4%多聚甲醛固定20min,0.1%结晶紫染色10min,洗去染色液,室温干燥。拍照并计数各孔中的克隆球(>50细胞)数目。
1.7Transwell小室实验检测细胞的迁移和侵袭能力
使用Transwell小室进行细胞迁移和侵袭实验。对于侵袭实验,预先在Transwell小室上室铺被基质胶。将各组细胞接种至Transwell小室上室(约8×105/孔),培养基体积为300μL,不含血清;下室加入700μL含有20%胎牛血清的培养基。37℃孵育48h后取出小室,用4%多聚甲醛固定20min,用0.1%结晶紫染色10min,用棉签拭去小室内表面细胞。在显微镜下观察并计算5个随机视野中的细胞数。
1.8统计学方法
以统计学软件GraphPad Prism 8.0分析实验数据并进行绘图,计量资料以平均数±标准差() 描述,多组间比较使用单因素方差分析,进一步两组间比较行LSD-t检验,当P<0.05时,差异有统计学意义。
2 结果
2.1HepG2细胞慢病毒转染验证
将提取的总蛋白进行Western blot分析,结果如图1所示:阴性对照转染组未见任何条带,而HBX-wt、HBX-A1762T/G1764A组在相对分子质量约为17KD处存在显著条带,见图1。以上结果说明成功构建了HepG2细胞模型。
2.2 HBX突变对HepG2细胞PI3K/AKT/mTOR通路基因表达的影响
与阴性对照组和HBX-wt组相比,HBX-A1762T/G1764A组细胞PI3K、AKT、mTOR的表达水平均显著升高(P<0.05);与阴性对照组相比,HBX-wt组PI3K、AKT、mTOR的表达水平也均升高(P<0.05),见表1。
Note:Compared with negative control group, aP<0.05. Compared with HBX-wt, bP<0.05. Three independent repeated experiments.
2.3 HBXA1762T/G1764A突变对HepG2细胞p-PI3K、p-AKT 及 p-mTOR表达情况表达的影响
与阴性对照组和HBX-wt组相比,HBX-A1762T/G1764A组细胞p-PI3K、p-AKT、p-mTOR的表达水平显著升高(P<0.05);与阴性对照组相比,HBX-wt组p-AKT/AKT、p-mTOR/mTOR的表达水平升高(P<0.05);与阴性对照组相比,HBX-A1762T/G1764A组细胞p-PI3K/ PI3K表达水平升高(P<0.01),见图1。
2.4HBX A1762T/G1764A突变对HepG2细胞增值、迁移和侵袭的影响
CCK-8实验结果显示,HBX-A1762T/G1764A组细胞增殖速率增高(F24 h=106.3,P<0.01;F48 h=364.7,P<0.01;F72 h=183.4,P<0.01),平板克隆形成數目增多(F=58.96,P<0.01),提示HBX A1762T/G1764A突变可促进HepG2细胞增殖,见图2、图3。Transwell小室实验显示,HBX-A1762T/G1764A组细胞的迁移细胞数和侵袭细胞数增多(F=59.28, P<0.01;F=44.35, P<0.01),提示HBX A1762T/G1764A突变可促进HepG2细胞迁移和侵袭,见图4。
3 讨论
在所有诱导 HCC 的因素中, HBV慢性感染最为常见和重要。长期 HBV 感染的人患 HCC 的风险可能会增加5至15倍[10]。因此,探究 HBV 在 HCC 发生发展中的作用及机制,并在此基础上寻找有效的措施防治HCC尤为重要。由于HBV复制过程的特点导致HBV DNA基因变异率较一般DNA病毒高10倍左右[11]。
PI3K/AKT通路是细胞应激期间的关键调节因子。由于肿瘤存在于内在的压力环境中,例如营养和氧气供应不足等,在此类环境下这一途径在癌症的发生发展中有着关键作用。mTOR是一种在哺乳动物细胞中普遍表达的丝氨酸/苏氨酸激酶。它拾取并整合各种细胞刺激启动的信号,以调节下游信号和蛋白质合成。它的激活导致细胞生长和存活调控的严重紊乱,最终导致竞争生长优势、转移能力、血管生成和治疗耐药[9]。本研究发现,与阴性对照组、HBX-wt组相比,HBX-A1762T/G1764A组HepG2细胞PI3K、AKT、mTOR基因表达量均升高,p-AKT/AKT、p-mTOR/mTOR的表达水平均显著升高。与此同时HBX-A1762T/G1764A组HepG2细胞的增殖、迁移和侵袭也均增强。提示HBX的A1762T/G1764A双突变可能在HBV所致的HCC中起到了一定的促进作用。
综上所述HBV X区A1762T/G1764A突变可能通过磷酸化PI3K/AKT信号通路中的AKT,上调mTOR的表达,并增强了HepG2细胞的增殖、迁移和侵袭,从而可能促进HCC的发生发展。
参考文献:
1. Brown A. Hepatitis B-associated fibrosis and fibrosis/cirrhosis regression with nucleoside and nucleotide analogs[J].Expert review of gastroenterology & hepatology, 2012,6(2): 187-198.
2. Shepard CW, Simard EP, Finelli L, et al. Hepatitis B virus infection: epidemiology and vaccination[J].Epidemiologic reviews,2006,28:112-125.
3. Chiu AP, Tschida BR, Sham TT, et al. HBx-K130M/V131I Promotes Liver Cancer in Transgenic Mice via AKT/FOXO1 Signaling Pathway and Arachidonic Acid Metabolism[J]. Mol Cancer Res. 2019,17(7):1582-1593.
4. Zhang Q, Cao G. Genotypes, mutations, and viral load of hepatitis B virus and the risk of hepatocellular carcinoma: HBV properties and hepatocarcinogenesis[J]. Hepat Mon. 2011 ,11(2):86-91.
5. Gong DY, Chen EQ, Huang FJ, et al. Role and functional domain of hepatitis B virus X protein in regulating HBV transcription and replication in vitro and in vivo[J]. Viruses. 2013 ,5(5):1261-1271
6. Ghany M, Liang TJ. Drug targets and molecular mechanisms of drug resistance in chronic hepatitis B. Gastroenterology. 2007 ,132(4):1574-1585.
7.郑丹,邓伟,黄天壬,李曦亮,李召发.广西壮族自治区肝癌高发区HBV基因型、BCP/前C区突变与肝癌相关性的研究[J].中华流行病学杂志,2015,36(07):725-729.
8.Porta C, Paglino C, Mosca A. Targeting PI3K/Akt/mTOR Signaling in Cancer[J]. Front Oncol. 2014 ,14(4):64.
9.Tsai WL, Chung RT. Viral hepatocarcinogenesis[J]. Oncogene, 2010, 29(16): 2309-2324.
10.Besharat S, Katoonizadeh A, Moradi A. Potential Mutations Associated With Occult Hepatitis B Virus Status[J]. Hepat Mon. 2014,14(5): e15275.
11.杨伟, 李增彩, 倪秀瑩, 等. 乙型肝炎病毒X 区基因变异与原发性肝癌的关系研究[J]. 肝脏, 2016, 21(01): 45-48
基金项目:广西自然科学基金资助(编号:2019GXNSFDA245001)

