电化学沉淀法净化含氰废水研究
李名新,李斌川,陈建设,刘奎仁,韩庆




摘要:含氰废水绿色、低成本处理制约着黄金氰化企业的可持续发展。以锌板为牺牲阳极,采用电化学沉淀法处理含氰废水,考察了电流密度、pH和初始总氰化合物浓度对氰化物去除效果的影响。结合循环伏安法、pHpzc、X射线衍射法、扫描电镜/能谱法和X射线光电子能谱法表征结果阐释氰化物去除机理。试验结果表明:在最佳条件下,工业含氰废水中总氰化合物、铜和铁去除率分别达到98 %、91 %和96 %。游离氰化物主要以Zn(CN)2形式进入电解沉淀渣中;Zn2+发生置换和电化学还原,使得含氰废水中72 %铜在阴极得到回收;铁主要形成Zn2[Fe(CN)6]进入电解沉淀渣中。
关键词:含氰废水;锌阳极;电化学沉淀;氰化锌;去除率
中图分类号:TD926.5文献标志码:A开放科学(资源服务)标识码(OSID):
文章编号:1001-1277(2022)03-0081-10doi:10.11792/hj20220317
引 言
作为一种高效和环境友好型技术,电化学法在工业废水处理中得到了广泛研究与应用\[1-5\]。近些年,电化学法在含氰废水处理中的应用同样得到众多研究者关注。根据处理方法和目的的不同,电化学法处理含氰废水可分为电化学氧化法(以氧化分解CN-为目的)、电化学回收法(以回收CN-和有价金属为目的)和电凝法(以形成絮凝体吸附CN-为目的)\[6-7\]。电凝法(以Fe或Al为牺牲阳极)不仅能够实现氰化物和重金属的去除,同时还具有低能耗和产渣量少等优点\[8\]。JIMNEZ等\[9\]研究揭示了Fe和Al阳极去除氰化物作用机理的区别,当pH值超过9.0时,铝絮凝体会形成多阴离子配体(\[Al(OH)4\]-),而铁絮凝体表面并不会形成带有负电荷的物质,且Fe易与CN-形成Fe-CN络合物从而利于CN-去除;试验过程中,使用Fe-Al阵列电极(铁为阳极,铝为阴极),在最佳条件下获得的CN-去除率超过98 %;同时也解释了铁作为牺牲阳极好于铝阳极的原因。因此,在处理含氰废水时,铁阳极获得的关注及应用比铝更为广泛。然而,含氰废水处理过程中CN-主要以Fe(OH)3@M-CN或Al(OH)3@CN形式进入沉淀渣中,缺乏行之有效的后续处理方法,特别是对于大量稳定的Fe-CN络合物难以降解。鉴于此,需要研究一种可替代Fe的牺牲阳极,使氰化物和有价金属便于后续回收循环利用,同时降低处理成本。过渡金属锌是一种潜在的替代材料,其能够与CN-形成不溶的白色沉淀氰化锌(Zn(CN)2)\[10\];弱稳定性Zn(CN)2沉淀可通过后续电沉积或AVR法进行回收利用,从而实现资源循环利用。
本文利用锌牺牲阳极处理含氰废水(含铜/铁),考察了电流密度、pH和初始总氰化合物浓度对试验结果的影响;同时,在最佳条件下,评估了处理工业含氰废水的能耗和阳极消耗。利用循环伏安法表征含氰溶液中锌阳极电化学行为,结合X射线衍射法(XRD)、扫描电镜/能谱法(SEM-EDS)和X射线光电子能谱法(XPS)表征沉淀渣物相组成和微观结构,提出锌阳极电化学去除氰化物机理。
1 试验部分
1.1 材料及设备
试剂及原料:氰化亚铜、氢氧化锌、亚铁氰化钠、硝酸铁,均为分析纯,购于国药集团化学试剂有限公司;硫酸锌、氢氧化钠、硫酸,均为分析纯,购于天津大茂化学试剂厂;硝酸银,分析纯,购于天津市风船化学试剂科技有限公司;试银灵,分析纯,购于天津市致远化学试剂有限公司;磷酸、硝酸、盐酸,均为分析纯,购于天津市化学试剂有限公司;锌片(w(Zn)> 99.99 %)。使用超纯水制备溶液。
工业含氰废水由某黄金冶炼企业提供,其成分分析结果如表1所示。
1.2 分析检测方法
溶液中金属离子采用原子吸收光谱法测定。总氰化合物测定为样品经过浓磷酸酸化(pH<2)后进行蒸馏,以试银灵为指示剂,利用0.20 mol/L或0.02 mol/L AgNO3溶液进行滴定。测定零点电荷(PZC)对应pH[11]。电解沉淀渣物相利用X射线衍射仪表征(λ=1.541×10-10 m,扫描速度10°/min,扫描范围10°~90°);表面微观结构和成分通过扫描电子显微镜-能谱仪(加速电压15 kV)表征;金属离子(Fe和Cu)化学价态通过X射线光电子能谱仪表征,在分析之前进行C 1s谱(284.8 eV)校正,并使用XPSPEAK 4.1软件进行Cu 2p峰的拟合分峰,根据拟合峰面积比值计算各价态含量。
1.3 电化学试验
将200 mL初始浓度为50 mmol/L总氰化合物溶液加入250 mL圆柱形玻璃反应器中,反应器置于恒温磁力搅拌器内;溶液pH通过pH计监测,利用氢氧化钠和硫酸溶液调节pH。分别配制含铁氰化溶液、含铜氰化溶液,控制总氰化合物浓度为50 mmol/L,铁和铜分别以Na4[Fe(CN)6]和CuCN形式加入溶液中。锌阳极尺寸为90 mm×60 mm×1 mm,有效面积24.0 cm2,阴极板、阳极板间距为30.0 mm,并平行放置于溶液中。电化学试验设备如图1所示。电解过程中,每隔固定时间移取5.0 mL溶液离心分离(10 000 r/min),分析上清液。在最佳电解条件下每隔30 min取出阳极超声清洗10 min,然后用无水乙醇清洗,在80 ℃真空干燥箱中烘干,记录前后质量变化,计算阳极消耗。试验完成后收集电解沉淀渣,酸化-蒸馏测定渣中总氰化合物。总氰化合物、金属去除率及渣中总氰化合物质量分数计算公式为:
2022年第3期/第43卷 安全与环保安全与环保 黄 金
η=c0-ctc0×100 %(1)
w=cAgNO3VAgNO3c0V0×100 %(2)
式中:η为总氰化合物(金属)去除率(%);c0和ct分别为初始和某时刻总氰化合物(金属)浓度(mol/L);w为渣中总氰化合物质量分数(%);cAgNO3为硝酸银标准溶液浓度(mol/L);VAgNO3为硝酸银标准溶液体积(mL);V0為溶液体积(mL)。
1.4 电化学测试
采用三电极体系进行循环伏安(CV)测试,电解池连接至配有稳压器的电化学工作站。工作电极(S=1.32 cm2)和对电极分别采用锌板(w(Zn)> 99.99 %)和石墨板。参比电极为配有盐桥鲁金毛细管的饱和甘汞电极(SCE)。每次试验前,利用0.5 μm α-氧化铝 (w(Al)>99.99 %)将工作电极抛光至镜面,再用超纯水超声洗涤5 min去除残留氧化铝,最后用超纯水洗涤,待用。将150 mL电解液加入到电化学装置中,随后调节pH,以10.0 mV/s扫描速度在电势-1.60~-0.80 V下进行测试。如不作特别说明,所有电极均为SCE。
2 结果与讨论
2.1 电解试验
2.1.1 游离氰离子溶液
2.1.1.1 电流密度
pH固定时,锌氰络合物物种分布主要依赖于Zn2+浓度变化[12]。然而,根据法拉第定律(如式(3)所示),其浓度又依赖于电流密度的大小。
Δm=ΚIt(3)
式中:Δm为阳极溶解量(g);K为电化当量[g/(A·h)];I为电流(A);t为电解时间(h)。
在pH值10.0和总氰化合物50 mmol/L的条件下,考察电流密度(2.0~8.0 mA/cm2)对总氰化合物去除率的影响,结果如图2所示。随着电流密度的增加,锌阳极溶解速率显著增加,从而促进CN-氧化和Zn(CN)2沉淀形成。电解240 min后,电流密度为2.0 mA/cm2、4.0 mA/cm2、6.0 mA/cm2和8.0 mA/cm2时,总氰化合物去除率分别为22 %、54 %、73 %和96 %。虽然电流密度为6.0 mA/cm2和8.0 mA/cm2时的总氰化合物去除率高于4.0 mA/cm2,但阴极发生Zn2+电化学还原和CN-阳极氧化,明显不利于阳极消耗和能耗(如图2-b)所示)。实际上,在电流密度为2.0 mA/cm2、6.0 mA/cm2 和8.0 mA/cm2时,能耗均约为0.8 kW·h/kg,比电流密度为4.0 mA/cm2高2倍。根据法拉第定律,在电流密度4.0 mA/cm2时,锌阳极溶解约7.2×10-3 mol(理论用量为5×10-3mol)。因此,最佳电流密度为4.0 mA/cm2,后续需要考虑pH的作用。
2.1.1.2 酸堿度
固定电流密度4.0 mA/cm2时,考察pH对总氰化合物去除率的影响,结果如图3所示。
由图3-a)可知:在所考察pH范围内,前40 min总氰化合物去除率没有明显变化。随着时间的延长,pH值从8.0增加至10.0时,总氰化合物去除率从97 %降低至54 %。值得注意的是,在pH值为9.0~10.0时,电解240 min后继续延长时间有利于总氰化合物去除(图中未显示);但是,能耗和锌阳极消耗较高。在pH值为11.0时,总氰化合物去除率较低。由图3-b)可知:pH值为8.0时,约84 %的总氰化合物存在于电解沉淀渣中,而约13 %和3 %分别被氧化和残留在溶液中。随着pH增加,以Zn(CN)2形式存在于电解沉淀渣中的氰化物显著降低。pH变化对CN-氧化比例影响不大,其保持在18 %~20 %。综上所述,随着pH增加,以Zn(CN)2形式沉淀于渣中的氰化物显著降低,这种趋势与图3-a)基本一致。因此,最佳pH值为8.0。
2.1.1.3 初始总氰化合物浓度
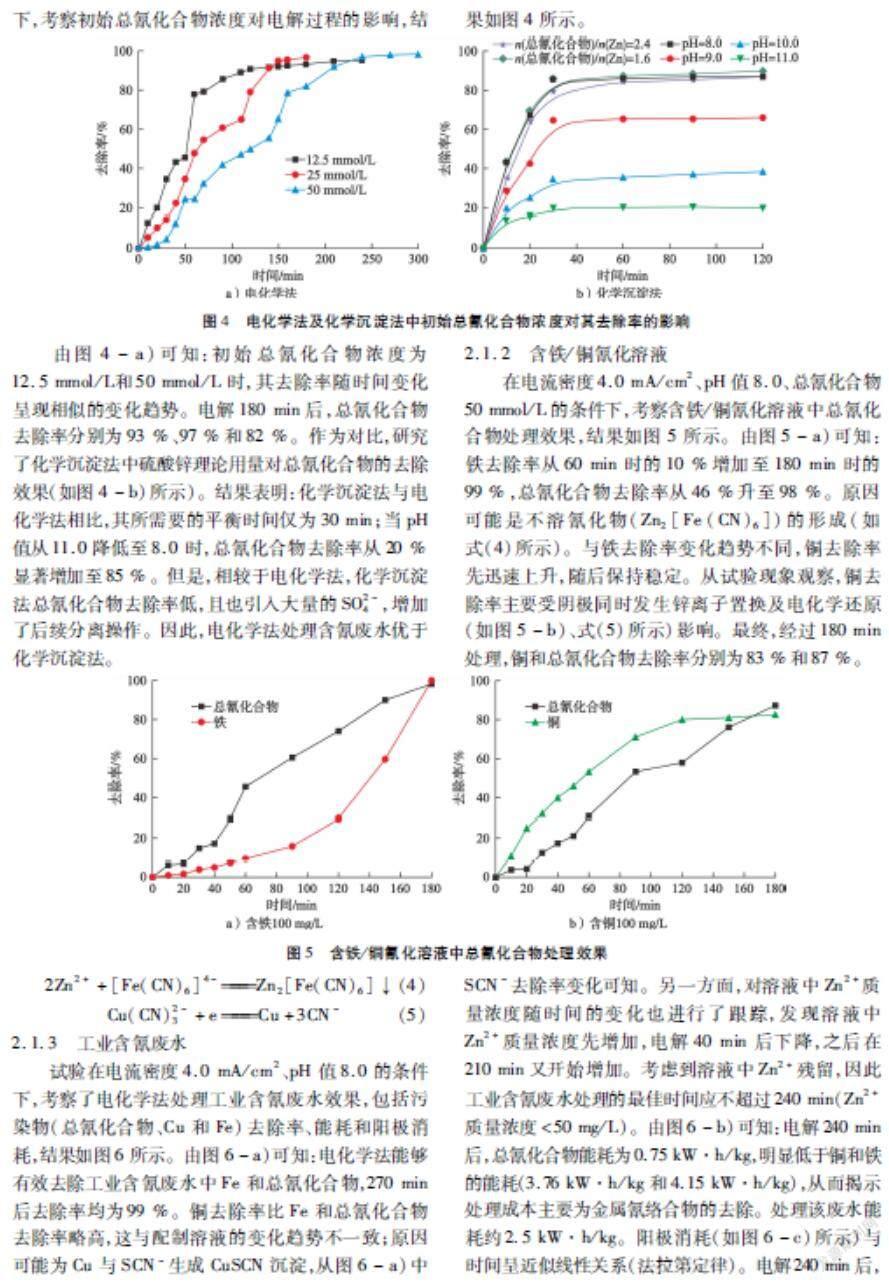
固定电流密度4.0 mA/cm2和pH值8.0的条件下,考察初始总氰化合物浓度对电解过程的影响,结果如图4所示。
由图4-a)可知:初始总氰化合物浓度为12.5 mmol/L和50 mmol/L时,其去除率随时间变化呈现相似的变化趋势。电解180 min后,总氰化合物去除率分别为93 %、97 %和82 %。作为对比,研究了化学沉淀法中硫酸锌理论用量对总氰化合物的去除效果(如图4-b)所示)。结果表明:化学沉淀法与电化学法相比,其所需要的平衡时间仅为30 min;当pH值从11.0降低至8.0时,总氰化合物去除率从20 %显著增加至85 %。但是,相较于电化学法,化学沉淀法总氰化合物去除率低,且也引入大量的SO2-4,增加了后续分离操作。因此,电化学法处理含氰废水优于化学沉淀法。
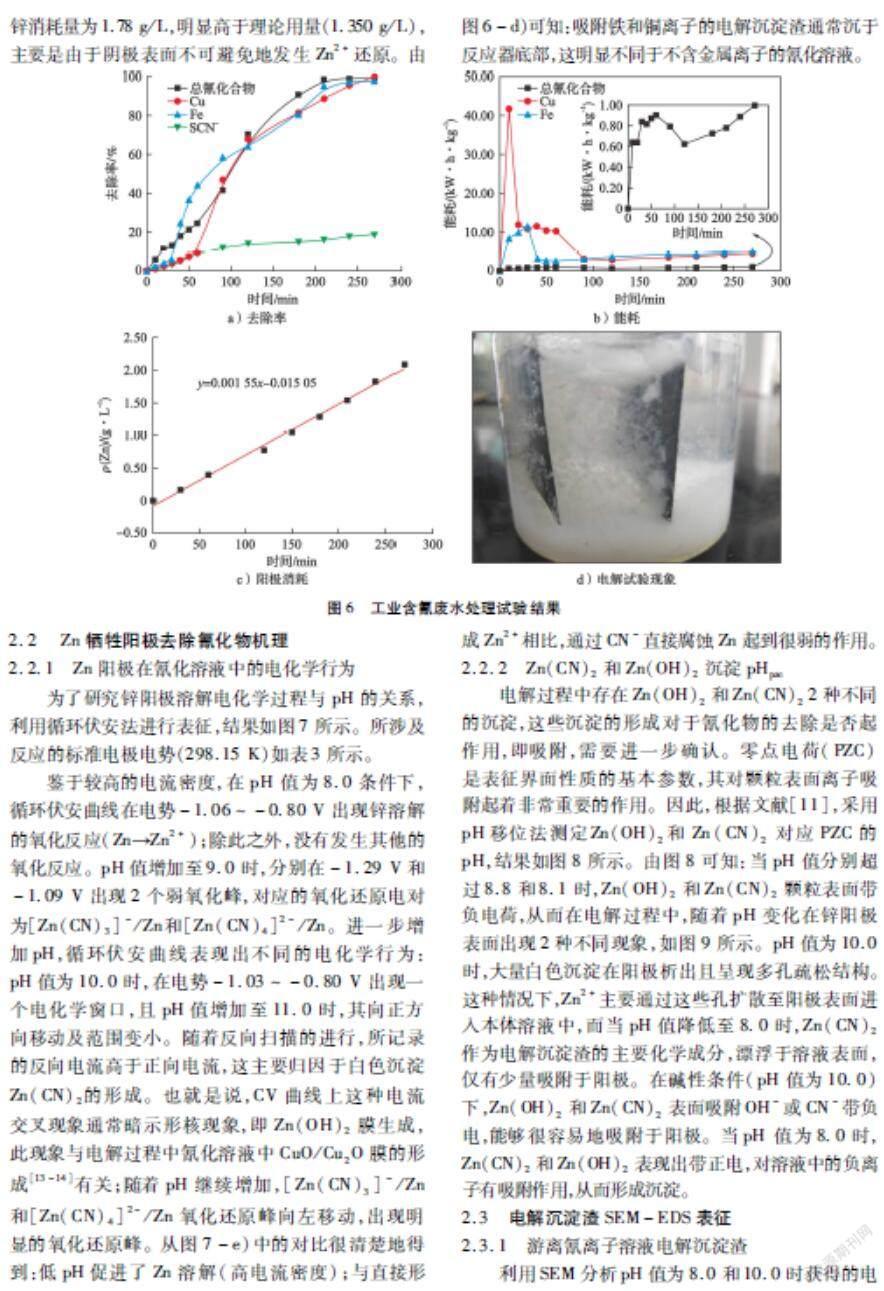
2.1.2 含铁/铜氰化溶液
在电流密度4.0 mA/cm2、pH值 8.0、总氰化合物50 mmol/L的条件下,考察含铁/铜氰化溶液中总氰化合物处理效果,结果如图5所示。由图5-a)可知:铁去除率从60 min时的10 %增加至180 min时的99 %,总氰化合物去除率从46 %升至98 %。原因可能是不溶氰化物(Zn2[Fe(CN)6])的形成(如式(4)所示)。与铁去除率变化趋势不同,铜去除率先迅速上升,随后保持稳定。从试验现象观察,铜去除率主要受阴极同时发生锌离子置换及电化学还原(如图5-b)、式(5)所示)影响。最终,经过180 min处理,铜和总氰化合物去除率分别为83 %和87 %。
2Zn2++[Fe(CN)6]4-Zn2[Fe(CN)6]↓(4)
Cu(CN)2-3+eCu+3CN-(5)
2.1.3 工业含氰废水
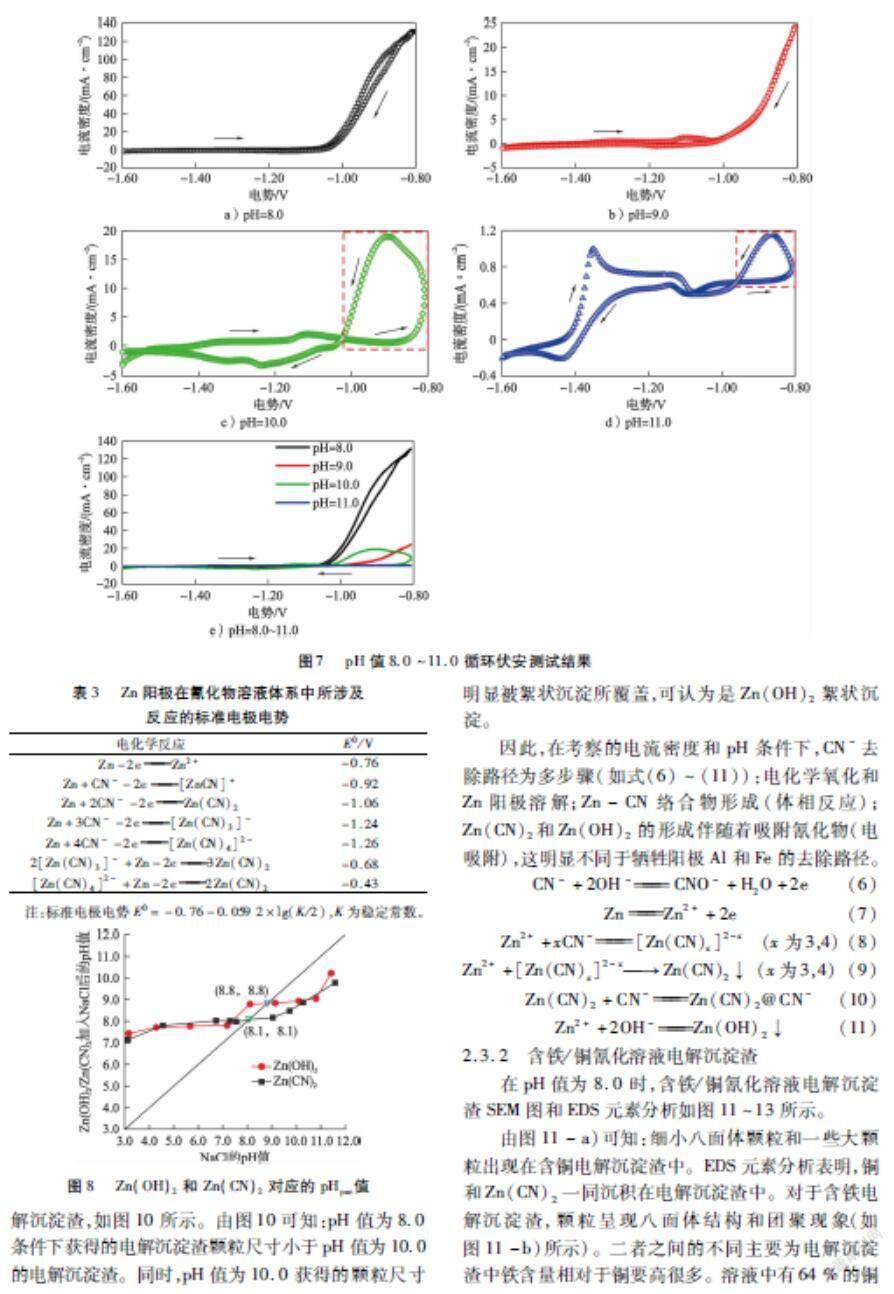
试验在电流密度4.0 mA/cm2、pH 值8.0的条件下,考察了电化学法处理工业含氰废水效果,包括污染物(总氰化合物、Cu和Fe)去除率、能耗和阳极消耗,结果如图6所示。由图6-a)可知:电化学法能够有效去除工业含氰废水中Fe和总氰化合物,270 min后去除率均为99 %。铜去除率比Fe和总氰化合物去除率略高,这与配制溶液的变化趋势不一致;原因可能为Cu与SCN-生成CuSCN沉淀,从图6-a)中SCN-去除率变化可知。另一方面,对溶液中Zn2+质量浓度随时间的变化也进行了跟踪,发现溶液中Zn2+质量浓度先增加,电解40 min后下降,之后在210 min又开始增加。考虑到溶液中Zn2+残留,因此工业含氰废水处理的最佳时间应不超过240 min(Zn2+质量浓度<50 mg/L)。由图6-b)可知:电解240 min后,总氰化合物能耗为0.75 kW·h/kg,明显低于铜和铁的能耗(3.76 kW·h/kg和4.15 kW·h/kg),从而揭示处理成本主要为金属氰络合物的去除。处理该废水能耗约2.5 kW·h/kg。阳极消耗(如图6-c)所示)与时间呈近似线性关系(法拉第定律)。电解240 min后,锌消耗量为1.78 g/L,明显高于理论用量(1.350 g/L),主要是由于阴极表面不可避免地发生Zn2+还原。由图6-d)可知:吸附铁和铜离子的电解沉淀渣通常沉于反应器底部,这明显不同于不含金属离子的氰化溶液。
2.2 Zn牺牲阳极去除氰化物机理
2.2.1 Zn阳极在氰化溶液中的电化学行为
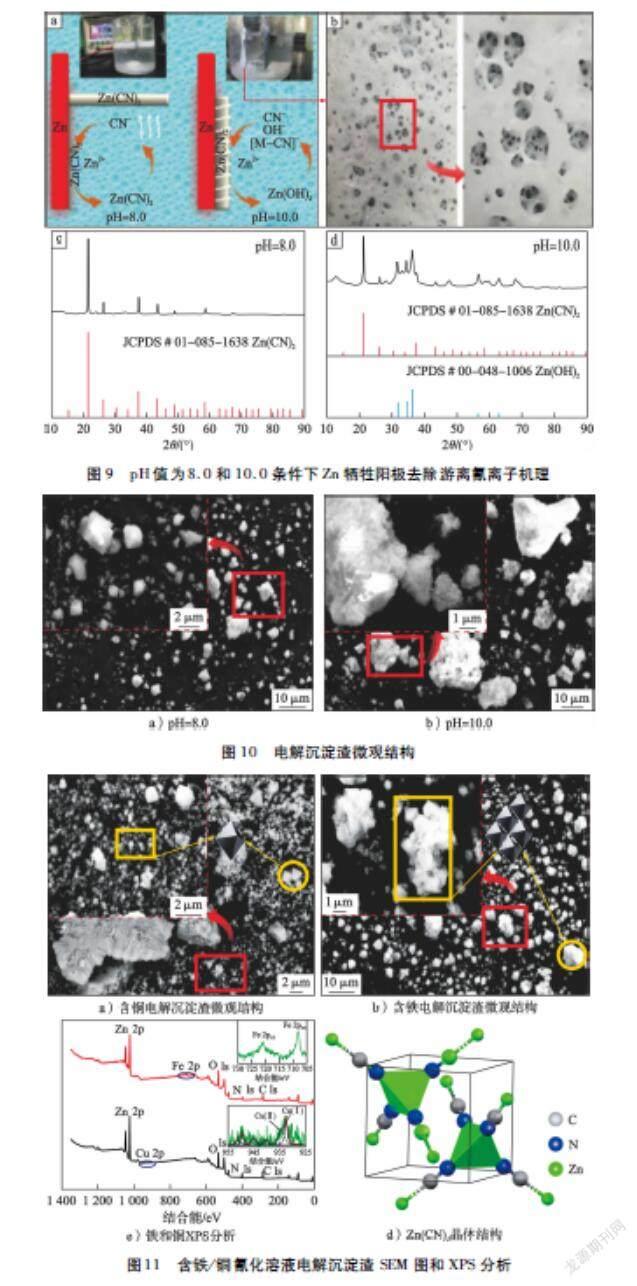
为了研究锌阳极溶解电化学过程与pH的关系,利用循环伏安法进行表征,结果如图7所示。所涉及反应的标准电极电势(298.15 K)如表3所示。
鉴于较高的电流密度,在pH 值为8.0条件下,循环伏安曲线在电势-1.06~-0.80 V出现锌溶解的氧化反应(Zn→Zn2+);除此之外,没有发生其他的氧化反应。pH值增加至9.0时,分别在-1.29 V和-1.09 V 出现2个弱氧化峰,对应的氧化还原电对为[Zn(CN)3]-/Zn和[Zn(CN)4]2-/Zn。进一步增加pH,循环伏安曲线表现出不同的电化学行为:pH值为10.0时,在电势-1.03~-0.80 V出现一个电化学窗口,且pH值增加至11.0时,其向正方向移动及范围变小。随着反向扫描的进行,所记录的反向电流高于正向电流,这主要归因于白色沉淀Zn(CN)2的形成。也就是说,CV曲线上这种电流交叉现象通常暗示形核现象,即Zn(OH)2膜生成,此現象与电解过程中氰化溶液中CuO/Cu2O膜的形成[13-14]有关;随着pH继续增加,[Zn(CN)3]-/Zn和[Zn(CN)4]2-/Zn氧化还原峰向左移动,出现明显的氧化还原峰。从图7-e)中的对比很清楚地得到:低pH促进了Zn溶解(高电流密度);与直接形成Zn2+相比,通过CN-直接腐蚀Zn起到很弱的作用。
2.2.2 Zn(CN)2和Zn(OH)2沉淀pHpzc
电解过程中存在Zn(OH)2和Zn(CN)2 2种不同的沉淀,这些沉淀的形成对于氰化物的去除是否起作用,即吸附,需要进一步确认。零点电荷(PZC)是表征界面性质的基本参数,其对颗粒表面离子吸附起着非常重要的作用。因此,根据文献[11],采用pH移位法测定Zn(OH)2和Zn(CN)2对应PZC的pH,结果如图8所示。由图8可知:当pH值分别超过8.8和8.1时,Zn(OH)2和Zn(CN)2颗粒表面带负电荷,从而在电解过程中,随着pH变化在锌阳极表面出现2种不同现象,如图9所示。pH值为10.0时,大量白色沉淀在阳极析出且呈现多孔疏松结构。这种情况下,Zn2+主要通过这些孔扩散至阳极表面进入本体溶液中,而当pH值降低至8.0时,Zn(CN)2作为电解沉淀渣的主要化学成分,漂浮于溶液表面,仅有少量吸附于阳极。在碱性条件(pH 值为10.0)下,Zn(OH)2和Zn(CN)2表面吸附OH-或CN-带负电,能够很容易地吸附于阳极。当pH 值为8.0时,Zn(CN)2和Zn(OH)2表现出带正电,对溶液中的负离子有吸附作用,从而形成沉淀。
2.3 电解沉淀渣SEM-EDS表征
2.3.1 游离氰离子溶液电解沉淀渣
利用SEM分析pH值为8.0和10.0时获得的电
解沉淀渣,如图10所示。由图10可知:pH值为8.0条件下获得的电解沉淀渣颗粒尺寸小于pH值为10.0的电解沉淀渣。同时,pH值为10.0获得的颗粒尺寸明显被絮状沉淀所覆盖,可认为是Zn(OH)2絮状沉淀。
因此,在考察的电流密度和pH条件下,CN-去除路径为多步骤(如式(6)~(11)):电化学氧化和Zn阳极溶解;Zn-CN络合物形成(体相反应);Zn(CN)2和Zn(OH)2的形成伴随着吸附氰化物(电吸附),这明显不同于牺牲阳极Al和Fe的去除路径。
CN-+2OH-CNO-+H2O+2e(6)
ZnZn2++2e(7)
Zn2++xCN-[Zn(CN)x]2-x (x为3,4)(8)
Zn2++[Zn(CN)x]2-xZn(CN)2↓(x为3,4)
(9)
Zn(CN)2+CN-Zn(CN)2@CN-(10)
Zn2++2OH-Zn(OH)2↓(11)
2.3.2 含铁/铜氰化溶液电解沉淀渣
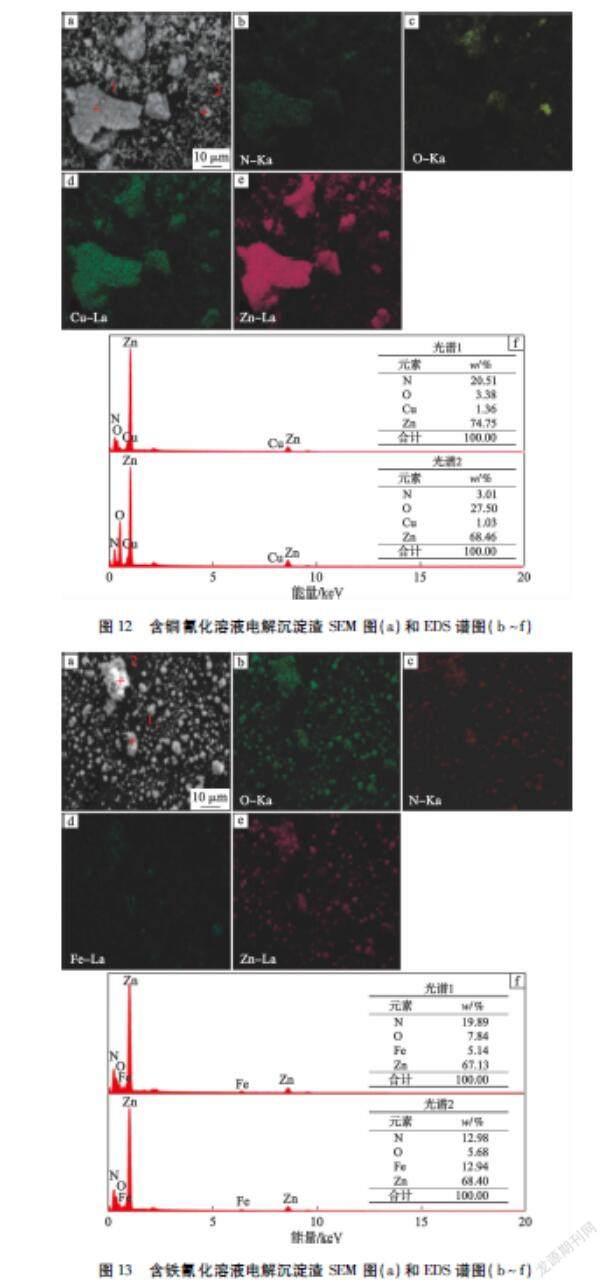
在pH值为8.0时,含铁/铜氰化溶液电解沉淀渣SEM图和EDS元素分析如图11~13所示。
由图11-a)可知:细小八面体颗粒和一些大颗粒出现在含铜电解沉淀渣中。EDS元素分析表明,铜和Zn(CN)2一同沉积在电解沉淀渣中。对于含铁电解沉淀渣,颗粒呈现八面体结构和团聚现象(如图11-b)所示)。二者之间的不同主要为电解沉淀渣中铁含量相对于铜要高很多。溶液中有64 %的铜沉积于阴极,19 %进入渣中,剩余铜在溶液中。为了表征电解沉淀渣中Fe和Cu的化学态,对电解沉淀渣进行了XPS分析,如图11-c)所示。电解沉淀渣中Fe 2p谱图显示,Fe 2p1/2和Fe 2p3/2的差值为12.91 eV,这与[Fe(CN)6]4-结构相一致[15]。与Fe 2p谱图相比,Cu 2p的XPS谱图呈现更加复杂的形式。因此,应用曲线拟合(高斯(80 %)-洛伦兹(20 %))整个峰(包括卫星峰)。众所周知,Cu 2p特征卫星峰暗示Cu(Ⅱ)存在;另一方面,Cu 2p3/2峰拟合结果也证明了这一点。通过峰面积比值定量分析电解沉淀渣中Cu(Ⅰ)和Cu(Ⅱ)含量。在932.15 eV Cu(Ⅰ)占据Cu 2p3/2峰的44.98 %,这表明55.02 %的Cu(Ⅰ)-CN被氧化为Cu(Ⅱ)氧化物进入电解沉淀渣中[16]。
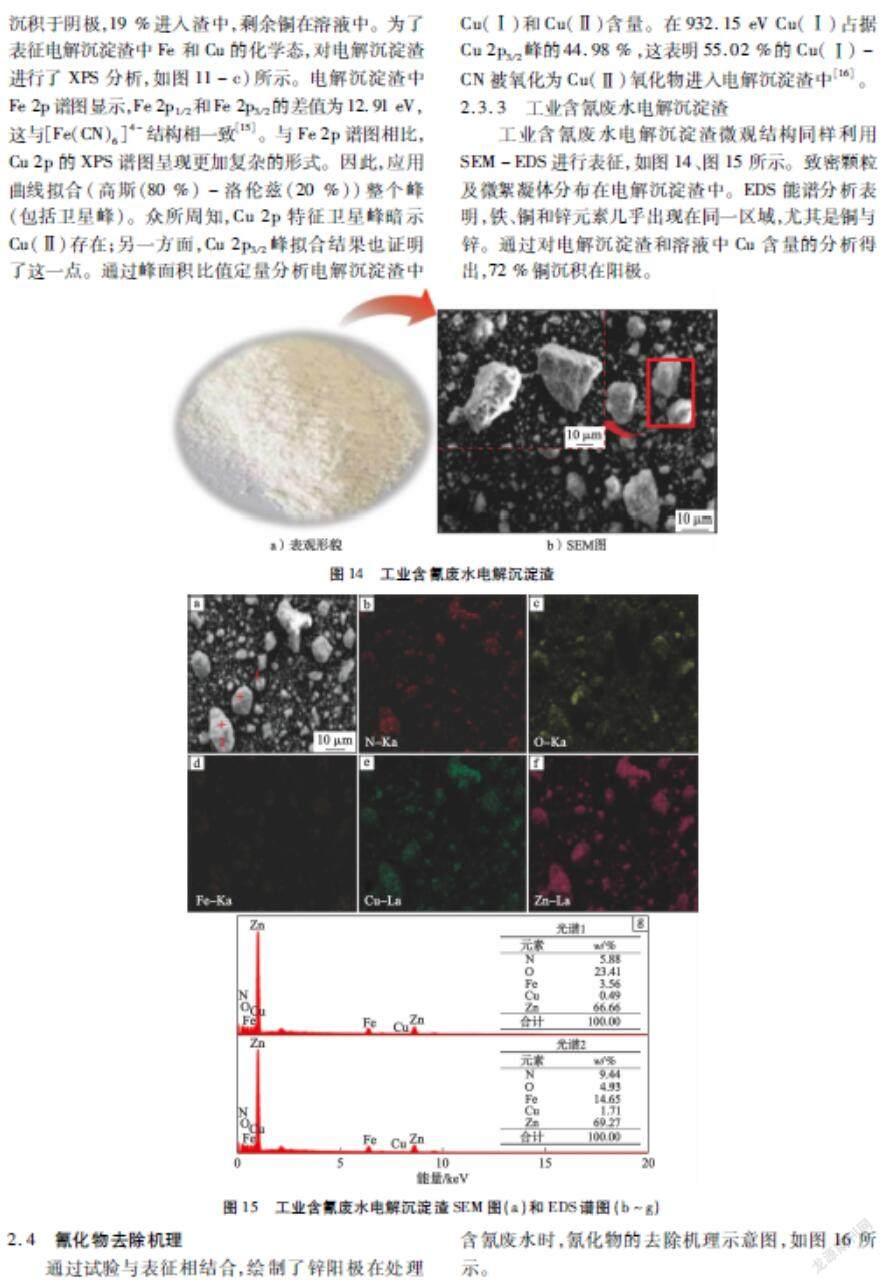
2.3.3 工业含氰废水电解沉淀渣
工业含氰废水电解沉淀渣微观结构同样利用SEM-EDS进行表征,如图14、图15所示。致密颗粒及微絮凝体分布在电解沉淀渣中。EDS能谱分析表明,铁、铜和锌元素几乎出现在同一区域,尤其是铜与锌。通过对电解沉淀渣和溶液中Cu含量的分析得出,72 %铜沉积在阳极。
2.4 氰化物去除機理
通过试验与表征相结合,绘制了锌阳极在处理含氰废水时,氰化物的去除机理示意图,如图16所示。
3 结 论
1)在pH 值为8.0时,游离氰离子主要以Zn(CN)2形式去除。在电流密度4.0 mA/cm2、pH值为 8.0和电解时间240 min条件下,总氰化合物去除率达到97 %。
2)含铁/铜氰化溶液中铁去除主要归结于Zn2[Fe(CN)6]或Zn(CN)2@Fe(CN)4-6的形成;铜则以电化学还原为主;Fe、Cu去除率分别达到99 %和83 % 。
3)采用本方法处理工业含氰废水240 min后,总氰化合物、Fe、Cu能够同时去除,去除率分别为98 %、96 % 和91 %,能耗2.5 kW·h/kg,而残留的Zn2+质量浓度低于50 mg/L。
4)锌牺牲阳极电化学法是一种高效、可靠的可实现氰化物去除的技术。在后续工作中,Zn(CN)2沉淀渣回收利用及阴极产物的分离是重点研究方向。
[参 考 文 献]
[1] 李森,王海峰.电化学法处理冷却循环水技术的应用[J].化工进展,2013,32(10):2 514-2 517.
[2] 王祎,崔韬,谷青青,等.管式电化学反应器中试处理高浓度含氰废水与经济分析[J].环境工程学报,2021,15(8):2 639-2 650.
[3] 胡素荣,邓三平,唐曦.含氰电镀废液的电化学氧化预处理研究[J].电镀与精饰,2020,42(8):43-46.
[4] 宋永辉,雷思明.含氰废水的电化学处理技术研究进展[J].黄金科学技术,2016,24(4):137-143.
[5] BERENGUER R,ROSA-TORO A L,QUIJADA C,et al.Electrocatalytic oxidation of cyanide on copper-doped cobalt oxide electrodes[J].Applied Catalysis B:Environmental,2017,207:286-296.
[6] DUTRA A J B,ROCHA G P,POMBO F R.Copper recovery and cyanide oxidation by electrowinning from a spent copper-cyanide electroplating electrolyte[J].Journal of Hazardous Materials,2008,152(2):648-655.
[7] LEMOS F A,SOBRAL L G S,DUTRA A J B.Copper electrowinning from gold plant waste streams[J].Minerals Engineering,2006,19(5):388-398.
[8] HAKIZIMANA J N,GOURICH B,CHAFI M,et al.Electrocoagulation process in water treatment:a review of electrocoagulation modeling approaches[J].Desalination,2017,404:1-21.
[9] JIMNEZ C,SEZ C,MARTNEZ F,et al.Electrochemical dosing of iron and aluminum in continuous processes:a key step to explain electro-coagulation processes[J].Separation and Purification Technology,2012,98:102-108.
[10] KONIGSMANN E,GOODWIN E,LARSEN C.Water management and effluent treatment practice at the golden giant mine[C]∥Canadian Institute of Mining,Metallurgy and Petroleum.Canadian mineral processors proceedings 1989.Montreal:Canadian Institute of Mining,Metallurgy and Petroleum,1989.
[11] QUESADA-PE-ATE I,JULCOUR-LEBIGUE C,JUREGUI-HAZA U,et al.Comparative adsorption of levodopa from aqueous solution on different activated carbons[J].Chemical Engineering Journal,2009,152(1):183-188.
[12] YNGARD R,DAMRONGSIRI S,OSATHAPHAN K,et al.Ferrate(VI)oxidation of zinc-cyanide complex[J].Chemosphere,2007,69(5):729-735.
[13] SZPYRKOWICZ L,KELSALL G H,SOUTO R M,et al.Hydrodynamic effects on the performance of an electrochemical reactor for destruction of copper cyanide—Part 1:in situ formation of the electrocatalytic film[J].Chemical Engineering Science,2005,60(2):523-533.
[14] FLETCHER S,HALLIDAY C S,GATES D,et al.The response of some nucleation/growth processes to triangular scans of potential[J].Journal of Electroanalytical Chemistry and Interfacial Electrochemistry,1983,159(2):267-285.
[15] OKU M.Kinetics of photoreduction of Fe(Ⅲ)in solid solution K3(Fe,M)(CN)6(where M is Cr,Co)during XPS measurement[J].Journal of Electron Spectroscopy and Related Phenomena,1994,67(3):401-407.
[16] AN P D,WEI L,LI H J W,et al.Enhancing CO2 reduction by suppressing hydrogen evolution with polytetrafluoroethylene protected copper nanoneedles[J].Journal of Materials Chemistry A,2020,8(31):15 936-15 941.
Study on the cyanide-bearing wastewaters purification by electrochemical precipitation method
Li Mingxin,Li Binchuan,Chen Jianshe,Liu Kuiren,Han Qing
(School of Metallurgy,Northeastern University)
Abstract:Green and cost-effective treatment of cyanide-bearing wastewaters(CBWs) restricts sustainable development of gold cyanidation plants.Electrochemical precipitation method is used to treat CBWs with Zn plate as galvanic anode.The effects of current density,pH,and initial total cyanide concentration on cyanide removal performance were discussed.Then,the removal mechanisms of cyanide were elucidated by a combination of cyclic voltammetry,pHPZC,XRD,SEM-EDS and XPS characterization.The experimental result demonstrated that the removal rates of total cyanide,Cu and Fe in industrial CBWs are respectively 98 %,91 % and 96 % under optimal conditions.Removal mechanisms suggested that free cyanide,mainly in the form of Zn(CN)2,goes into the electrolytic residue.The effect of Zn2+ replacement and electro-reduction promoted 72 % of Cu from CBWs to be reduced and recovered in the cathode.Fe,mainly in the form of Zn2[Fe(CN)6] precipitate,goes into the residue.
Keywords:cyanide-bearing wastewaters;Zn anode;electrochemical precipitate;zinc cyanide;removel rate

