胆固醇与肝再生关系及其在肝衰竭治疗中的意义和潜在价值
林 镛,颜耿杰,冯 逢,彭子明,龙富立,,韦艾凌,王明刚,姚 春
1 广西中医药大学 研究生院,南宁 530200;2 广西中医药大学第一附属医院 肝病二区, 南宁530023;3 广西中医药大学,南宁 530000
肝衰竭是多种因素引起的严重肝脏损害,导致合成、解毒、代谢和生物转化功能严重障碍或失代偿[1]。随着人工肝技术的不断革新,综合治疗手段在改善机体内环境方面已基本接近极限,但目前仍未发现特效药物和干预手段[2]。近一个世纪以来,各国学者从免疫反应、炎症损伤和细胞因子等方面进行了剖析,对该病发病机制已有了较为清晰的了解。但该病仍维持着较高的病死率,归根结底是目前临床上仍缺乏有效促进肝细胞再生的药物问世,多等待肝细胞的“自救”[3]。近年来,胆固醇的循环代谢在肝再生过程中发挥的作用引起了学者的极大兴趣。其中涉及胆固醇平衡对肝细胞周期的影响、胆固醇-胆汁酸代谢通路、胆固醇相关代谢物等[4-8]。
1 肝再生反应与肝衰竭
肝脏为了避免由有毒物引起的肝功能丧失以及由肝炎病毒引起的损伤,生物体已经进化出显著的肝脏再生反应以保证存活[9]。根据肝脏损伤程度及参与肝再生的响应范围,再生模式主要分为2种:(1)肝细胞自身分裂、增生,(2)肝脏干细胞增殖、分化。当肝实质丧失或肝功能受损后,肝细胞再生迅速开始,在2/3部分肝切除术小鼠模型中的实验观察确定了细胞肥大的初始阶段,随后是肝细胞增殖[10]。深入了解这种反应的发生机制,可以有效地在急慢性肝损伤中发展保护和促进肝再生的治疗策略[11]。其中根据损伤程度肝源性干细胞(卵圆细胞)及非肝源性干细胞被激活或招募到肝脏更新分化为肝细胞,作为肝细胞再生的组成部分以代偿肝脏功能[12]。当肝功能和/或肝实质的大小满足机体代谢需要时,肝再生反应即停止,这是一种固有特性[13]。在肝切除术大鼠模型中残存肝细胞先进入细胞周期,20~48 h步入DNA复制高峰,随后复制率逐步下降并适时终止[14]。但此过程中涉及的反应和机制尚不完全清楚。近一个世纪的研究,已经确定了一些分子和反应过程在控制肝再生的激活及终止中起着核心作用。这些分子可分为三类,包括细胞因子和先天免疫系统、生长因子和代谢产物[15-16](图1)。肝脏再生的介质可以起源于肝实质内,也可以源自其他组织并通过循环到达肝脏[17]。肝细胞再生潜能强大,按照常规理论发展,肝衰竭应有更好的治愈预期。新近多数研究亦将促进肝衰竭良好转归的生理基础指向肝细胞的有效再生,肝再生对肝衰竭的重要性已不言而喻。
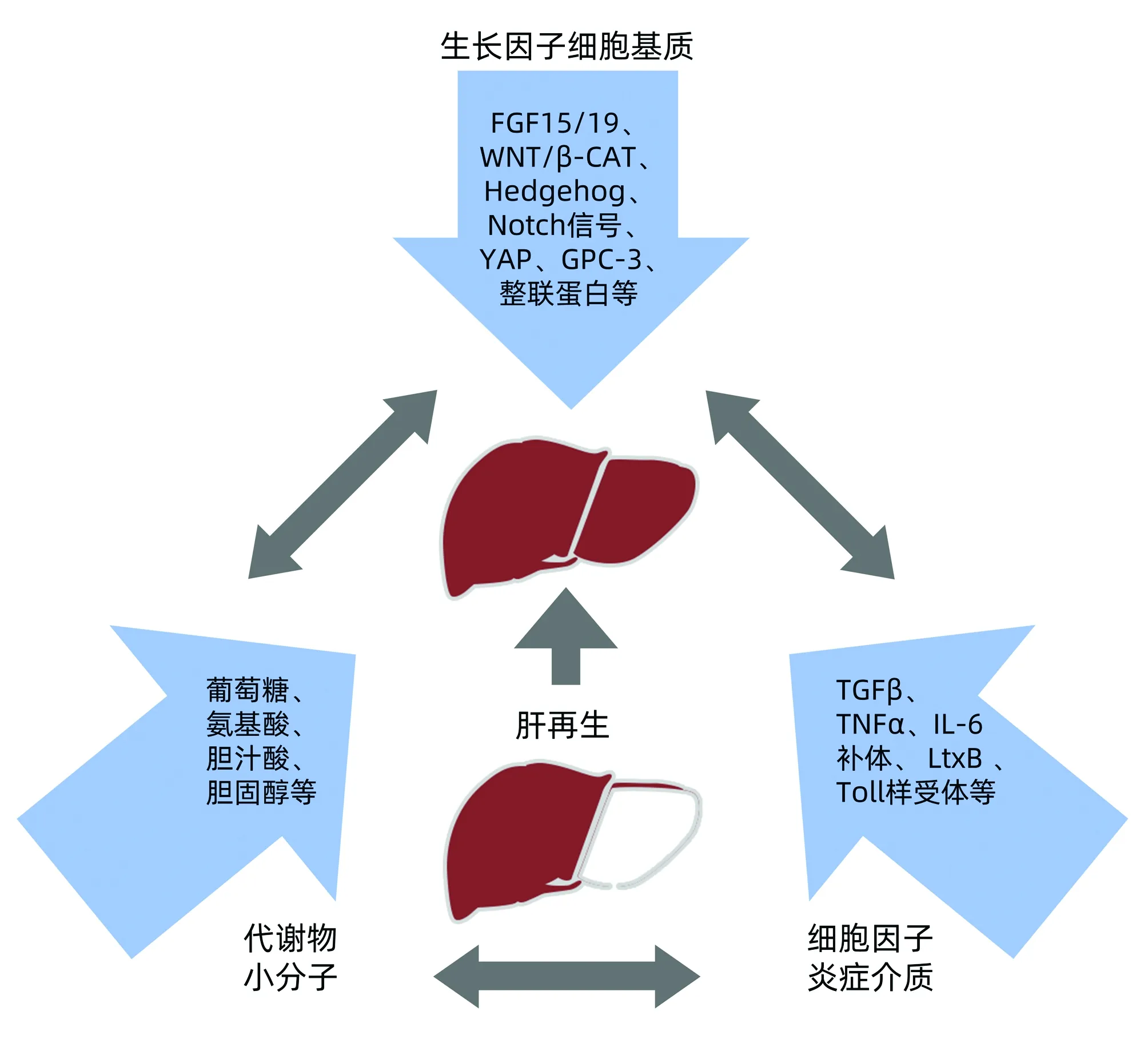
注:FGF,成纤维细胞生长因子;YAP、GPC-3为靶点蛋白;LtxB,P450单加氧酶。
2 胆固醇与肝再生的关系
肝脏具有强大的再生能力,可在受损或切除后迅速触发。肝再生反应在其起始和终止过程中进行了本质上的调节,这一特性称为“hepatostat”[18]。如上所述,多种分子均以不同形式参与了肝再生,但现阶段研究多集中于胆汁酸对肝再生的影响,其中包括法尼醇X受体(FXR)调控的一系列反应[5]、FGF15/19的表达[6]、胆固醇7α-羟化酶(cholesterol 7-alpha hydroxy-lase,CYP7A1)转录[7]等,而忽视了胆固醇在整个过程的关键作用。例如胆汁酸的生物合成主要是通过其本身的反馈作用进行调控,但其合成主要来源于内源性胆固醇代谢;再者肝细胞通过依靠胆汁酸的乳化及形成混合微团的作用运输胆固醇,而胆固醇的合成与循环均对胆汁酸的生成和分泌产生影响。
2.1 胆固醇循环 胆固醇合成过程复杂,有近30步酶促反应,大致划分为甲羟戊酸、鲨烯、胆固醇合成3个阶段。其中在肝脏内部的胆固醇循环主要与FXR-SHR信号、FGF家族及胆汁酸关系密切[19-20]。简而言之,生命体摄入营养后,脂肪在小肠被分解为甘油和脂肪酸,然后由小肠黏膜细胞合成为甘油三脂,再与食物中吸收的胆固醇、载脂蛋白(Apo)B48组成乳糜微粒(chylomicron,CM),CM进入小肠附近的淋巴小管,通过淋巴系统总管道汇入血液循环[21]。在血液循环中,CM中的甘油三脂会被肌肉等各种组织吸收分解为甘油和脂肪酸,以供组织细胞作为能源或原料使用,余下的CM再通过ApoB48传输至肝脏,被肝细胞吸收分解为胆固醇、氨基酸、甘油三脂等;进行分解后再与ApoB100蛋白组成极低密度脂蛋白(VLDL)进入血液循环;在血液循环过程中,VLDL中的甘油三脂和胆固醇会被组织吸收利用一部分,而甘油三脂经卸载后密度提高,VLDL变为低密度脂蛋白(LDL)。LDL在血液循环后进入肝脏,ApoB100被肝细胞表面LDL受体识别,LDL被吸收分解成氨基酸、胆固醇、甘油三脂等[22]。同时,肝脏和小肠会合成高密度脂蛋白(HDL),HDL通过血液循环收集游离的胆固醇并运回肝脏,肝脏细胞经CYP7A1合成胆汁酸排入胆囊和小肠中,用于消化脂肪,而小肠能够重新将胆汁酸吸收以循环使用[23](图2)。在整个过程中胆汁酸可调节肝代谢,也可促进肝细胞增殖[24]。FXR-SHP信号在肝细胞和肠细胞中均可表达,其主要是通过信号反馈作用进行胆汁酸调控,确保胆汁池的最佳大小。肠细胞中胆汁酸的质与量会影响FXR-SHP信号刺激FGF的表达,并释放到门静脉血中进一步调节肝脏胆汁酸的合成及肝再生[25]。综上,胆固醇正常合成与循环影响胆汁酸生成,而胆汁酸的质和量与循环又影响着肝再生的整个过程。
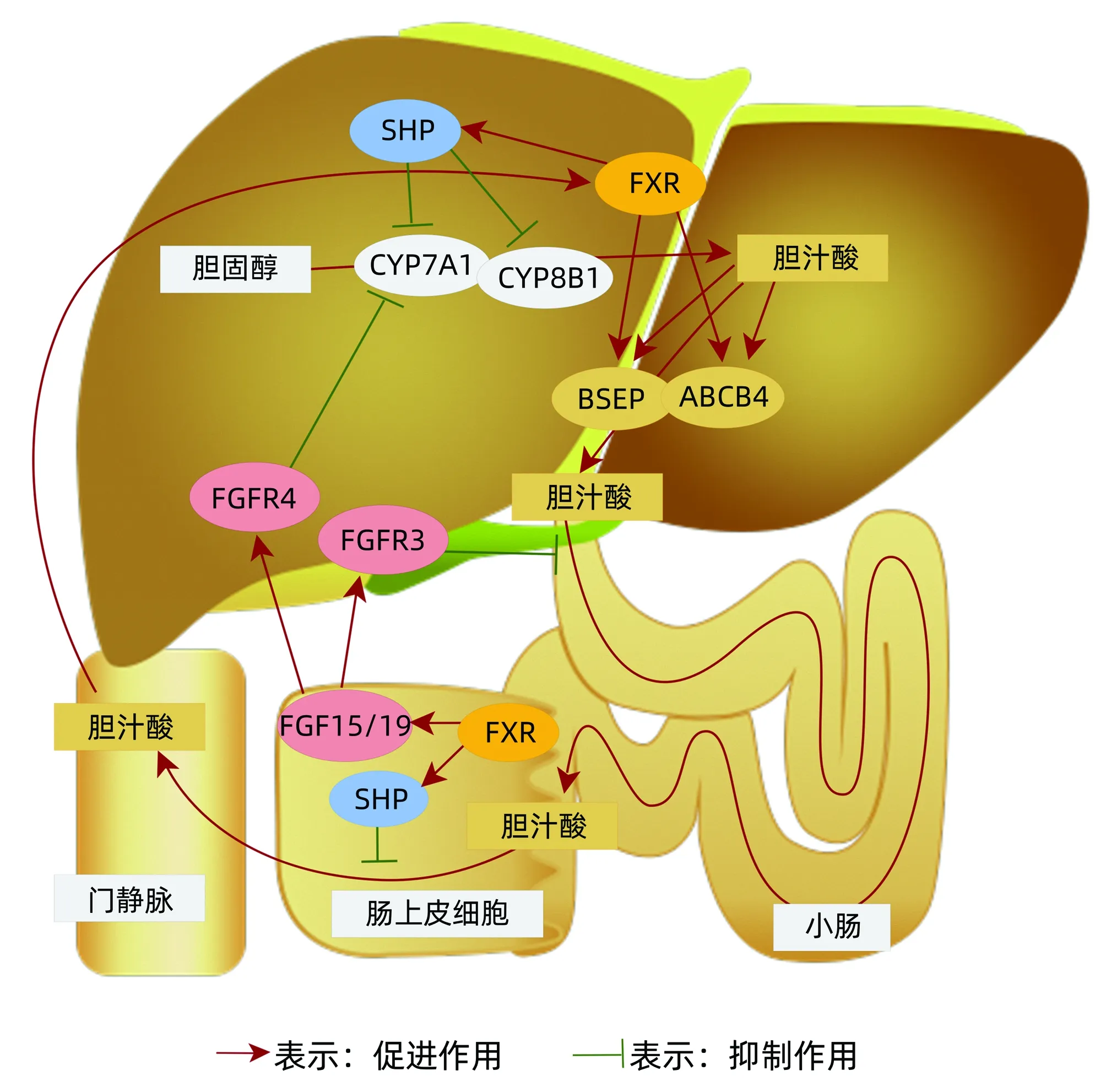
注:SHP,小异二聚体伴侣;CYP8B1,胆固醇12α-羟化酶;BSEP,胆盐输出泵;ABCB4,胆汁酸合成基因;FGFR,成纤维细胞生长因子受体。
2.2 HMG-CoA还原酶(HMGCR) HMG-CoA是合成胆固醇及酮体的重要中间产物。HMG-CoA经HMGCR还原后可生成甲羟戊酸,是胆固醇合成的关键阶段。同时,HMGCR亦是甲烷酸通路中的限速酶,该反应是合成胆固醇的限速反应,而胆固醇主要是通过抑制HMGCR的合成反馈来抑制肝脏胆固醇的合成[26],这也是他汀类药物调节胆固醇水平的经典作用机制。HMG-CoA与肝再生的正向关系在以往研究[27]中已有论述,该实验发现在实施部分肝切除术的大鼠中,肝再生伴随着HMG-CoA合成酶显著增加;而新近研究[28]通过构造新的基因模型发现,HMGCR基因缺失可导致肝细胞凋亡和补偿性肝再生。此外,在生化水平上观察到除胆固醇外,HMGCR的其他所需物质水平下降和耗竭;进一步实验发现当多萜醇耗竭后,可以出现有效的HMGCR抑制、内质网应激和肝细胞的再生。此外,他汀类药物作为HMGCR抑制剂,同样涉及对肝再生反应的调节。在一项骨桥蛋白敲除小鼠的实验[29]中发现,阿托伐他汀可增加脂质摄取,提供再生所需的代谢前体进而改善小鼠肝再生。辛伐他汀与间充质干细胞联合治疗可降低硫代乙酰胺诱导的肝硬化大鼠肝胶原分布,增加肝细胞再生[30]。而氟伐他汀也被证明可通过抑制肝星状细胞的激活和改善血管内皮功能,促进大面积肝切除大鼠模型的肝再生和微循环[31]。综上,调控肝脏胆固醇HMGCR的合成和抑制与肝再生有着密切联系。
2.3 胆固醇7α-羟化酶(CYP7A1) CYP7A1是在肝脏内胆固醇分解成胆汁酸的限速酶,占总胆汁酸合成的90%,是胆汁酸最重要的合成途径。同时CYP7A1受到FGF15/19和FXR-SHP信号的抑制,被称为胆汁酸的负反馈调节(图2),在促进胆固醇-胆汁酸循环、肝再生和新陈代谢中发挥着重要作用[5-6]。已有研究[32]发现在70%的肝切除术中,肝脏特异性过度表达的外源性CYP7A1基因伴随着肝细胞凋亡和肝损伤增加。新近发现CYP7A1过度表达会导致胆汁酸积累,影响肝脏的再生,而FGF15可降低CYP7A1及肝胆酸毒性水平,并促进肝再生[7]。Ibrahim等[33]发现肝再生增强剂可降低CYP7A1 mRNA表达和胆汁酸水平,进而降低胆汁酸累积引起的细胞凋亡,促进肝再生。由此可见抑制胆固醇代谢物CYP7A1对肝再生的保护意义,一是促进胆固醇的分解,二是减少胆汁酸的累积。
3 胆固醇在肝衰竭治疗中的潜在价值
体内70%~80%胆固醇由肝脏合成,是血浆胆固醇的主要来源,因而胆固醇的高低能够直接反映肝脏的储备功能[34]。血清胆固醇水平低的肝衰竭患者其病死率极高,即肝衰竭患者死亡伴随胆固醇的消耗殆尽[35]。但作为肝细胞合成代谢指标其与肝细胞再生的关系并未引起足够的重视,未曾考虑胆固醇与肝再生可能存在交互关系。近年来研究[24]发现,肝衰竭时肝细胞胆固醇合成功能与肝细胞再生速率呈正相关,并且胆固醇可能通过脂质水平、胆固醇硫酸化、核受体等途径参与肝衰竭的发生。
3.2 胆固醇硫酸化 胆固醇硫酸化在许多生物事件的调节中起着基本作用,其产物25-羟基胆固醇(25HC)、3-硫酸-25-羟化胆固醇(25HC3S)和25-羟化胆固醇硫酸酯(25HCDS)被证明是脂质代谢、炎症反应、肝细胞凋亡和肝细胞再生的有效调节剂[48]。25HC3S/25HCDS在体内和体外可以抑制胆固醇及甘油三酸酯的生物合成,并通过胆固醇调节元件结合蛋白(sterol-regulatory element binding protein,SREBP)信号传导减少肝脏组织中的脂质蓄积和循环中的脂质水平[8];同时通过抑制肝X受体(LXR)信号通路促进肝再生并制约部分肝切除术后的细胞凋亡[49]。有报道[50]显示25HC3S和25HC协同调节核过氧化物酶体增殖物激活受体(PPAR)γ易位,与25HC相比,25HC3S增加核PPARγ和胞质IκBα表达,降低NF-κB核易位,并抑制TNFα和LPS诱导的促炎基因的释放。PPARγ主要分为PPARγ1和PPARγ2,PPARγ2的主要作用是负责分化脂肪细胞[51]。Ning等[52]研究认为PPARγ1/IκBα/NF-κB是25HC3S诱导的炎症抑制的可能途径,其原因是25HC3S/25HCDS抑制了肝脏促炎反应和细胞凋亡以及诱导涉及细胞存活的基因表达。另一项报道[53]则是对Ⅰ型IFN、胆固醇25-羟化酶(CH25H)和25HC展开研究。Ⅰ型IFN具有强大的抗病毒活性和免疫抑制作用,该作用有助于预防不受控制的炎症,对自身免疫性疾病具有重要作用。CH25H可在25位羟基酶化胆固醇以生成25HC[54]。该研究发现25HC可通过拮抗SREBP来减少IL-1β转录,该反应主要是通过CH25H诱导IFN的关键基因来下调胆固醇生物合成,不依赖LXR机制;同时25HC又可在IFN信号下游通过负反馈调节抑制IL-1家族细胞因子产生和炎症小体的活性。CH25H主要是通过调节SREBP来调节IL-1β表达和炎症水平。另外在LPS处理的CH25H缺陷骨髓源性巨噬细胞中发现Casp-1、Nlrp3和Asc表达上调,包括炎症因子IL-1β、IL-1α、IL-18和pro-IL-1β水平升高,但IL-6水平不受影响。并且经LPS处理的CH25H缺陷小鼠较未用LPS处理的CH25H缺陷小鼠早约12 h死亡[55]。因此,胆固醇硫酸化产物25HC、25HC3S和25HCDS,包括CH25H及新兴的Ⅰ型IFN皆具有抑制炎症、调节自身免疫和抗病毒活性等作用,与肝衰竭的发病机制息息相关,可以为肝再生机制的研究提供帮助。
4 小结与展望
肝衰竭是临床上常见且严重的临床症候群,其病情进展迅速、预后差、病死率极高。胆固醇可能通过参与肝再生影响肝衰竭的发生发展,并决定肝衰竭的预后。胆固醇循环、合成及代谢与肝再生有着密切关联,其中包括胆固醇-胆汁酸循环涉及的一系列调控,HMGCR在胆固醇合成过程的限速反应,CYP7A1对胆固醇分解和胆汁酸累积之间的平衡影响等。此外,胆固醇的合成与循环对肝衰竭发生发展有着多方面的意义和价值,包括其本身及代谢物STARD1对JNK或JNK/P38MAPK信号通路调控肝衰竭肝细胞再生的影响;HDL水平影响肝衰竭肝再生、免疫反应和炎症过程;以及胆固醇硫酸化产物25HC、25HC3S和25HCDS等具有抑制炎症、调节自身免疫和抗病毒活性等作用。
综上,胆固醇循环过程及其代谢衍生物涉及肝再生的启动与调控,与肝衰竭的发病机制密切相关,有望成为肝衰竭和肝再生的下一步切入点。未来可以尝试从胆固醇角度实施对肝衰竭疾病进展的把控和新型药物及治疗靶点的研究,以提高该病临床诊疗水平。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:林镛负责课题设计,资料分析,撰写论文;颜耿杰、冯逢、彭子明、韦艾凌、龙富立参与收集数据,修改论文;王明刚、姚春负责拟定写作思路,指导撰写文章并最后定稿。

