木蝴蝶的组培快繁技术研究
陈瑜珍,莫小路
(广东食品药品职业学院中药学院,广东广州 510520)
中药木蝴蝶来源于紫葳科植物木蝴蝶[Oroxylum indicum(L.)Vent.]的干燥成熟种子,具有清肺利咽、疏肝和胃、敛疮生肌等功效,常用于肺热咳嗽、喉痹、音哑、肝胃气痛等症[1]。木蝴蝶种子外形呈扁圆形,中间有长条状隔膜,边缘具白色透明的膜质翅,似白色蝴蝶,故名木蝴蝶;因其一个果荚内有数百粒种子,层状排列,似千层纸,故又名“千张纸”“千层纸”等[2]。在《全国中药炮制规范》中,规定了木蝴蝶为“净制”,即生品入药,无需盐水炒炙[3]。现代药理学研究表明,中药木蝴蝶提取物具有抗菌、抗氧化、抗炎、镇咳、降血糖及抗癌等作用[4-5]。木蝴蝶植物为落叶小乔木,其野生资源主要分布在我国福建、台湾、广东、广西、四川、贵州及云南等地,在越南、老挝、泰国等东南亚国家也有分布,目前药材主要来源于野生资源收集及进口[6]。
由于木蝴蝶树形和花果都具有较好的观赏性,种子又可作药用,其规模化种植前景可观。国内木蝴蝶种植主要采用播种育苗繁殖[7-9],存在育苗周期长、出芽不整齐、有变异株型等问题。运用植物组织培养技术生产种苗,具有繁殖效率高、出芽整齐、遗传性状稳定等优点,目前已在超过200 种药用植物上取得了成功[10-11],但木蝴蝶组织培养快繁育苗的研究尚未见报道。因此,本项目以木蝴蝶种子为试验材料进行组培快繁技术研究,旨在建立木蝴蝶的组培快繁育苗技术体系,为木蝴蝶种苗的工厂化生产提供研究基础。
1 材料与方法
1.1 植物材料
木蝴蝶种子购自药店,经国家中药特色技术传承人梁永枢鉴定为紫葳科植物木蝴蝶[Oroxylum indicum(L.)Vent.]的干燥成熟种子。
1.2 方法
1.2.1 种子筛选及预处理。从购买的种子中挑选膜衣外观白色、无霉变、无虫害、子叶饱满无破损的种子,按子叶大小分为大(子叶面积≥15mm×10mm)、小(5mm×5mm ≤子叶面积<15mm×10mm)2 组,2 组种子分别按下列2 种方法处理(大、小种子每个处理各50 粒种子):A 是剥去种子外层的膜质种皮,只留子叶和胚;B 是将种皮外围的膜衣剪去,保留种子周围1~2 mm 宽的部分,不撕开膜衣(图1)。
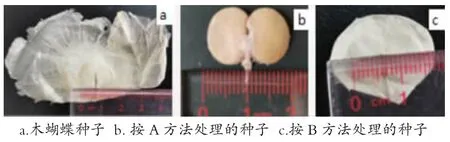
图1 木蝴蝶种子及预处理
1.2.2 外植体消毒及初代培养。分别将A、B 方法处理的大、小种子进行表面消毒,每组处理的种子分别用75%酒精消毒30s 后,再用有效氯为2%和5%的次氯酸钠溶液消毒5~10min,用无菌水清洗4~5 次,无菌滤纸吸干种子表面水分,将种子接种于MS 培养基上诱导种子萌发。
初代培养的容器为30mm×100mm 的平底试管,内装MS 培养基约5mL,每支试管接种1 粒种子。培养条件:25℃,弱光培养(1000Lux),16h 光照/8h 黑暗。2周后,观察、统计污染情况和种子萌发情况,计算污染率和萌发率。

1.2.3 增殖培养。将没有污染、已萌发露出新叶的芽苗取出试管,转接至装有MS 培养基的组培瓶内培养,光照强度2500Lux,待苗高3cm 以上时,以此无菌苗的茎段和顶芽为外植体进行增殖培养。
在超净工作台上,将无菌苗顶芽下的叶片切除,切下长约1cm 的顶芽,茎切割成0.5~1cm 的小段,每段带1 个节,将顶芽和带节茎段分别接种至含有不同浓度和配比的6-BA 和NAA 的MS 培养基上,每瓶接种外植体3~4 个。培养条件:25℃,16h 光照/8h 黑暗,光照强度2500Lux。30d 后统计芽分化的数量,计算增殖系数。

1.2.4 生根壮苗。增殖培养获得的芽苗,经分株培养至苗高3~4cm 时,转入生根壮苗培养基中诱导生根。生根壮苗培养基为添加不同浓度NAA 和IBA 以及不添加生长调节剂的1/2MS 培养基,考查生长素的类型和添加的浓度对木蝴蝶生根率、生根质量的影响。培养条件与增殖培养相同(注:1/2 MS培养基为无机盐含量减半的MS培养基,其他成分含量不变)。
2 结果与分析
2.1 不同外植体及处理方法对木蝴蝶种子初代培养的影响
木蝴蝶种子采用不同消毒方法,经初代培养后的结果显示:体积大的种子萌发率高于体积小的;在大种子中,采用B 方法处理(即保留种子周围1~2mm 宽的膜衣不撕开)的种子,在2%次氯酸钠消毒10min 和5%次氯酸钠消毒5min 的2 种条件下,其萌发率都高于A 方法(剥去种子外层膜衣);而采用5%次氯酸钠消毒5min 的方法,无论是大、小种子,其污染率都很低,仅为4%。
采用A 方法处理的大、小种子,其污染率都较低,其中,用5%次氯酸钠消毒5min 的效果优于用2%次氯酸钠消毒10min 的,但A 方法处理的种子萌发率都低于B 方法处理的。(表1),其中,用75%酒精消毒30s,再用2%次氯酸钠消毒10min 的种子萌发率最高(80%)。
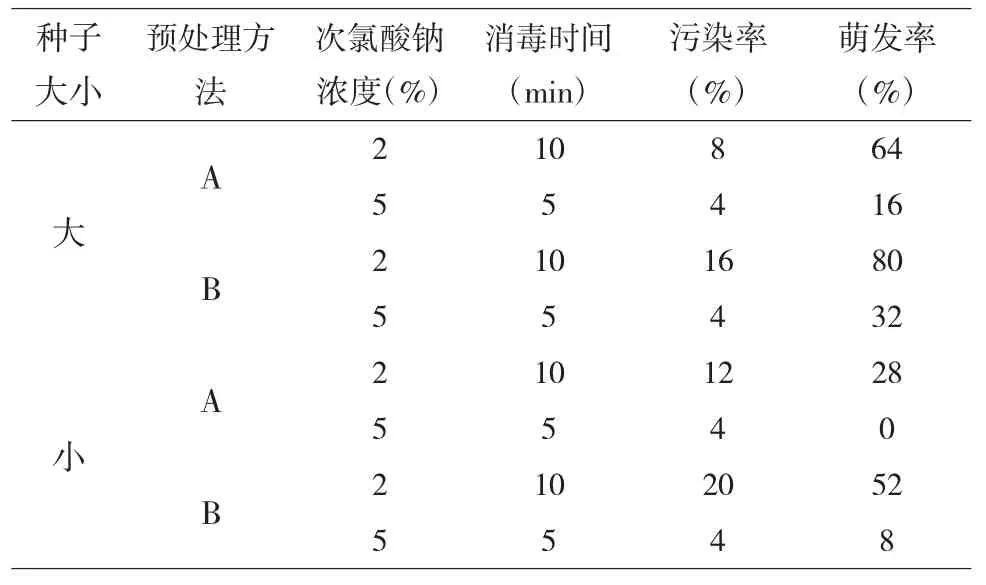
表1 不同外植体及处理方法对木蝴蝶种子初代培养的影响
2.2 培养基中的植物生长调节剂对外植体增殖培养的影响
以木蝴蝶无菌苗的茎段、顶芽为外植体,分别接种到含不同植物生长调节剂的培养基上进行培养。结果显示,木蝴蝶茎外植体类型、培养基中的植物生长调节种类和浓度都对芽生成有影响。顶芽外植体在各组培养基上均未生成丛生芽,只有少数在基部有1~2 个芽,大部分只有顶芽生长;带节茎段外植体在(1)(2)(5)组培养基上,每个外植体出芽数量在1~3 个,而在添加1.0mg/L 6-BA+0.2mg/L NAA 的MS 培养基上,茎段外植体基部先形成愈伤组织,愈伤组织较紧密,30d后陆续分化出芽(图2 h,i),单个外植体出芽数最高为16 个,平均每个外植体的出芽数(增殖系数)为8.24(表2)。

图2 木蝴蝶组培快繁过程
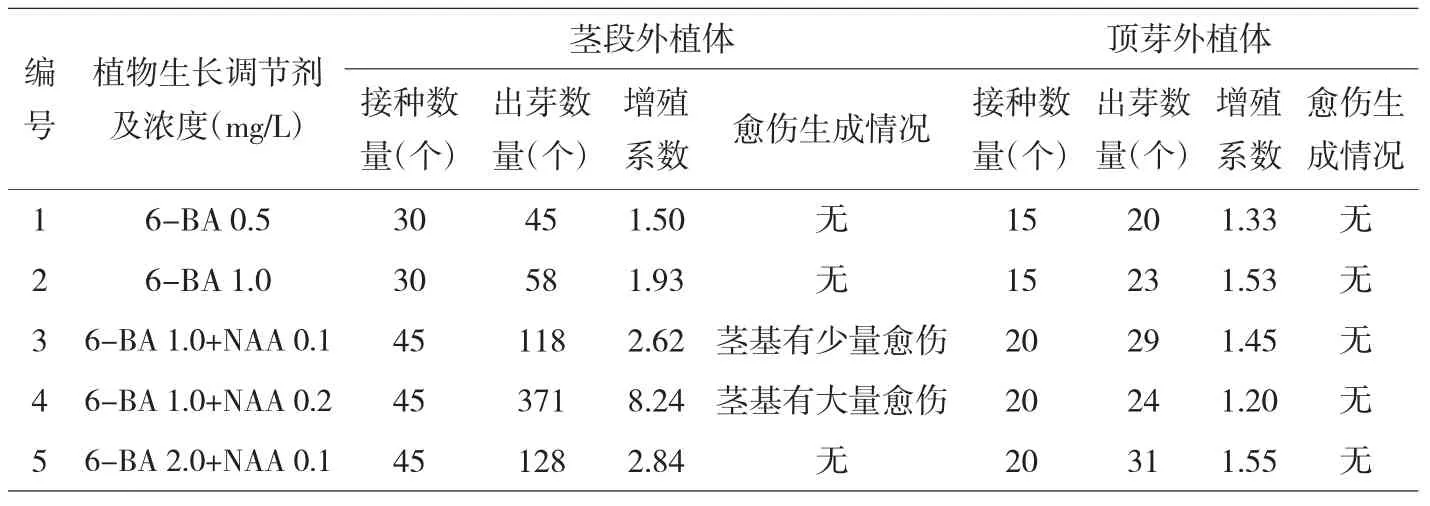
表2 培养基中植物生长调节剂对茎段、茎尖外植体丛生芽形成的影响
2.3 生根壮苗培养
将增殖后的无根芽苗转入各组生根培养基,每组10 瓶,每瓶接种3 株,培养30d 后统计生根结果见表3。在无机盐减半的1/2MS 培养基上,不添加任何生长激素,木蝴蝶的生根率只有36.7%,而在1/2 MS 培养基中添加NAA(浓度0.1~0.3mg/L)或IBA(浓度0.5~1.5 mg/L)都能显著提高木蝴蝶的生根率,其中,添加0.5 mg/L IBA 的生根率最高,为93.3%;在试验的浓度范围内,IBA 对木蝴蝶单株生根的数量以及根长的作用都优于NAA,但添加NAA 能较早启动根的分化,在培养基(3)和(4)中的苗约在接种后15d 开始有根萌出,而培养基(1)和(5)(6)(7)中的无根苗在21d 后才开始生出;并且在(2)(3)(4)培养基上长出的根都粗壮,而(5)(6)(7)培养基上生的根较细长。综合生根率、生根质量,筛选(5)培养基为最佳生根壮苗培养基,即1/2 MS 培养基+0.5 mg/L IBA。
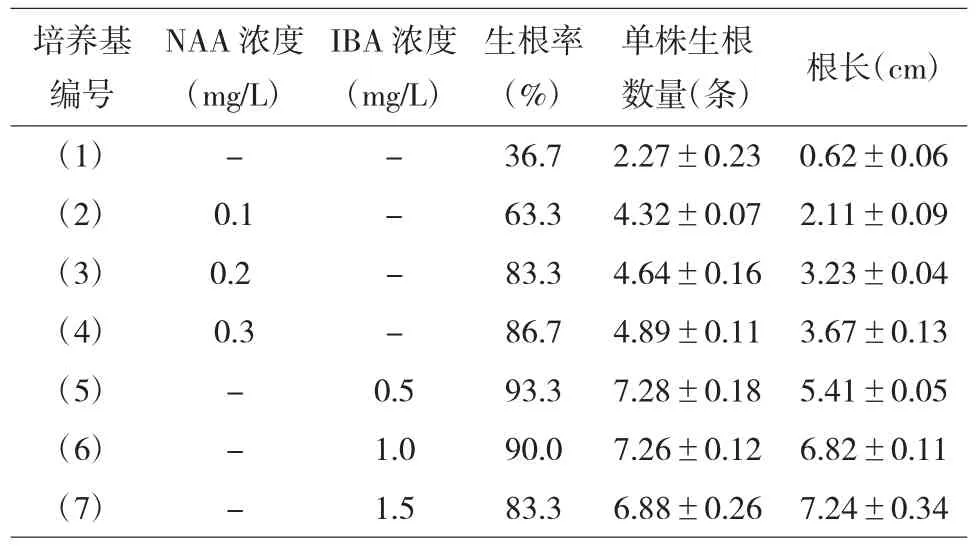
表3 生长调节剂对木蝴蝶生根的影响
3 讨论与结论
植物组织培养中,外植体的消毒是初代培养的重要环节,本试验采用含氯消毒剂次氯酸钠对木蝴蝶种子进行表面消毒。结果表明,选择2%有效氯的次氯酸钠对带少量外膜的种子消毒10min,可以达到较好消毒效果,并且种子萌发率最高,达80%。去掉种子外层膜衣虽然可以提高消毒效果,降低污染率(低于12%),但由于种胚直接暴露在消毒液中会有损伤,加上剥外膜所造成的机械性损伤,都会影响种子的活力,种子萌发率很低。
利用种子萌发获得的无菌苗茎段外植体,在附加1.0mg/L BA+0.2mg/L NAA 的MS 培养基上培养约20d,外植体基部形成大量愈伤组织,随后愈伤组织分化出芽,单个外植体的增殖系数达到8.24。生根诱导试验中,木蝴蝶无根苗在无机盐减半但没有添加生长调节剂的培养基中生根率较低(36.7%),而添加NAA 和IBA 对木蝴蝶生根有明显促进作用,但二者对木蝴蝶根形态发生的作用效果不同,其中,添加NAA 启动根萌发的时间较快,而IBA 的作用稍迟;并且在添加NAA 的培养基中,木蝴蝶形成的根较粗、短,根的数量较少;而添加IBA 的培养基中,木蝴蝶形成的根细、长而密,根系发达,这与文献[5]报道的IBA 作用相似;但IBA 对木蝴蝶单株生根数量并没有随作用浓度的提高而提高,其原因还有待于进一步探索。
本研究利用木蝴蝶种子无菌萌发获得的无菌苗,将无菌苗带节茎段在附加1.0mg/L BA 和0.2mg/L NAA的MS 培养基上获得大量芽苗增殖,将增殖后的无根芽苗转移至附加0.5mg/L IBA 的1/2 MS 培养基上进行生根壮苗培养,生根率可达93.3%,建立了木蝴蝶高效植株再生体系,该木蝴蝶种苗快繁技术通过后续的炼苗移栽,可实现木蝴蝶组培苗的工厂化生产,为木蝴蝶种植产业提供充足种苗。

