农村三格化粪池尾水原位土壤消纳研究
柳博,杨波,刘丽媛,曹昊宇,郑向群
(农业农村部环境保护科研监测所,天津 300191)
农村生活污水主要分为厨房污水、洗涤污水和厕所污水三类,其中厕所污水内含多种病菌和寄生虫卵[1],污染负荷贡献率极高,其排水量占总污水量的34.2%[2],但污水中的有机物多数易被微生物降解[3]。我国农村人口居住分散、污水收集处理设施欠缺,致使厕所污水集中处理较困难,且清运费用昂贵,农民难以承担。近年来兴起的土地处理系统可通过土壤中微生物及表层种植的经济作物、食用蔬果和景观花卉等有效去除污水中的氮、磷及有机污染物[4],相关研究表明,用土壤系统对农村化粪池尾水进行单独处理[3],无需额外土地及外加动力,成本低廉,管理简单方便,既增加了农户经济收入,又可美化庭院景观,提高人居环境质量,适合于我国广大农村地区推广应用。
一般的土地处理系统由于长期连续进水且污水浓度负荷过高,容易发生堵塞,但这种情况较少发生在“厕所+三格化粪池+庭院消纳+菜园经济”模式中,主要有以下两个原因:一是分散式化粪池尾水排放之前经过中端处理(如三格化粪池)的静置沉降和弯管截流,出水中的颗粒物含量较少;二是分散式化粪池尾水排放量较小,为长期间断渗透出水,减少了出水峰值导致的堵塞。类似于土地处理系统的慢速渗滤(SR)类型[5],在无降雨条件下,尾水在原位土壤中多以扩散蓄积状态少量间断地流入菜园各处[2],因植物根系及土壤截流等作用,尾水在菜园各位置的富集量也不同。目前,国内已经有地区开始尝试大规模地利用土地处理系统来原位消纳化粪池尾水,太湖流域农村将三格化粪池沉淀发酵好的尾水从第三格上方出水口排入表层土壤加以消纳,取得了较好的处理效果[6-7]。
统计数据显示,三格化粪池厕所模式在全国农村改厕中占比最大[8],推行三格化粪池后接土地处理技术,是实现人口稀少、居住分散、地处偏远、交通不便、清掏困难和经济发展落后的农村地区污水处理无害化、资源化的重要途径之一[7]。我国大部分农村居民家中均有家庭菜园,家庭菜园的土壤环境直接关系着广大农民的粮食安全和人体健康[9]。目前大部分研究集中在尾水污染负荷去除效果方面,有关分散式化粪池尾水原位土壤消纳对土壤环境影响的研究则较为鲜见。
本研究以山东省东营市广饶县岳六村为案例,该村现有居民375 户,截至2017 年,无害化卫生厕所已改造213 户,其中,采用“厕所+三格化粪池+庭院消纳+菜园经济”模式的共计194 户,普及率达91.1%。本研究旨在明确“厕所+三格化粪池+庭院消纳+菜园经济”模式对土壤环境的影响,以期为农村三格化粪池尾水原位土壤消纳模式的应用提供科学支撑。
1 材料与方法
1.1 研究区概况
采样点位于山东省东营市广饶县(118°25′E,37°08′N),地处暖温带,属季风气候,历年平均气温12.3 ℃,平均降水量587.4 mm。土壤类型为潮土,其基本理化性质:pH 7.89,有机质7.49 g·kg-1,全氮1.4 g·kg-1,全磷0.285 g·kg-1,全钾18.9 g·kg-1。该系统中三格化粪池尾水理化性质如表1 所示,符合《粪便无害化卫生要求》(GB 7959—2012)的无害化标准。

表1 尾水基础理化性质Table 1 Phsico chemical properties of tail water
1.2 “厕所+三格化粪池+庭院消纳+菜园经济”模式
三格化粪池尾水原位土壤消纳模式工程于2017年上半年完工并投入使用,为降低长期尾水溢流下渗污染地下水的风险(2013—2017 年广饶县地下水位变化范围为3.80~4.12 m[10])及减少氮、磷流失,在庭院菜园底部及内壁做了防渗硬化处理。本系统主要由水冲厕所、三格化粪池和庭院菜园三部分组成。化粪池的有效容积为1.5 m3,水冲式便器一般用水量为3~6 L·次-1,人体每日排泄3~6 次,总排泄量为1~1.5 L[11]。供试农户家常住4人,每日化粪池排污量为4~6L,其中含14~21 g 氮、20.4~30.6 g 磷、12.8~19.2 g 钾及151.9~227.9 g 有机质。如图1 所示,菜园总长度为4.5 m,宽1.5 m,土层深度约30 cm,尾水溢流管埋在土层中间位置,以避免蚊蝇滋生和恶臭对环境的影响。庭院菜园植物主要以空心菜-菠菜轮作的方式种植。
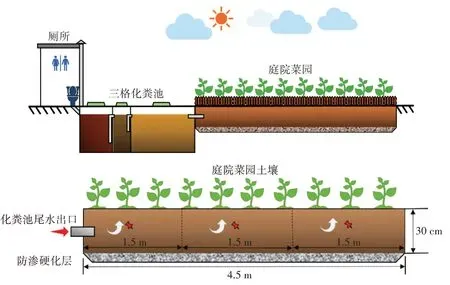
图1 “厕所+三格化粪池+庭院消纳+菜园经济”模式示意图Figure 1 Schematic diagram of“toilet+three-compartment septic tank+yard consumption+vegetable garden economy”mode
1.3 试验方法
试验共设置4 个处理,分别为不施尾水处理(CK)、前段0~1.5 m(S1)、中段1.5~3.0 m(S2)和后段3.0~4.5 m(S3)。采样时间为2020 年11 月1 日,各处理采集三份平行土样(0~20 cm),一部分土壤储存于-80 ℃环境下用于检测土壤微生物,另两份土样自然风干,去除植物残体、石块等杂物,研磨过筛,用于检测土壤化学性质和土壤酶活性。
1.4 土壤化学性质、酶活性及微生物多样性分析
土壤pH 值以2.5∶1 的水土比浸提,使用pH 计(HJ 962—2018)测定;土壤有机质采用重铬酸钾容量法(NY/T 1121.6—2006)测定;土壤全氮采用自动定氮仪测定(NY/T 1121.24—2012);全磷采用NaOH 熔融-钼锑抗比色法测定;全钾采用NaOH 熔融-原子吸收分光光度法测定。粪污pH值测定参照NY/T 1973—2010;有机质采用燃烧氧化-非分散红外吸收法;全氮测定参照GB/T 17767.1—2008;全磷测定参照GB/T 17767.2—2010;全钾测定参照GB/T 17767.3—2010;有效磷测定参照GB/T 8573—2017,氨氮和硝氮测定分别参照HJ 665—2013和HJ/T 346—2007;全盐量测定参照HJ/T 51—1999;卫生学指标测定参照GB 7959—2012。
土壤蔗糖酶活性和土壤纤维素酶活性采用3,5-二硝基水杨酸比色法测定[12-13];土壤脲酶活性采用苯酚钠-次氯酸钠比色法测定[14];土壤过氧化氢酶活性采用紫外分光光度法测定[15]。
本研究采用香农群落多样性指数(Shannon)[16],群落丰富度指数(Ace)和群落均匀度指数(Simpson even)反映各处理土壤细菌和真菌群落多样性、丰富度与均匀度。Shannon 指数越大,土壤中微生物群落多样性越高[17];Ace指数越大,土壤样本中的微生物物种越丰富,且各物种分配越均匀[18];Simpson even 指数则反映样本中物种数量分布的均匀程度[19]。
1.5 统计分析
试验数据采用Microsoft Excel 2019 进行整理,利用SPSS 25 进行单因素方差分析和差异显著性分析,土壤微生物高通量测序数据利用Majorbio 美吉生物云平台分析,分别进行了物种注释与评估、样本比较分析和环境因子关联分析,并使用R 语言及Origin 2019软件绘图。
2 结果与分析
2.1 尾水原位土壤消纳模式对土壤化学性质的影响
如表2所示,不施尾水处理(CK)土壤pH 为7.97,前段0~1.5 m(S1)、中段1.5~3 m(S2)和后段3~4.5 m(S3)这3 个处理组的土壤pH 为7.06~7.14,相比于对照组显著降低(P<0.05),随着溢流距离的增加,pH 值呈递减趋势,依次为S1>S2>S3,但各处理组间无显著性差异(P>0.05)。处理组土壤有机质含量显著高于对照组,增加了29.6%~39.5%,各处理组之间有机质含量由高到低依次是S2=S3>S1,中后段有机质含量显著高于前段(P<0.05)。对照组全氮含量为1.43 g·kg-1,处理组全氮含量为0.93~1.58 g·kg-1,由高到低依次是S3>S1>CK>S2。对照组全磷含量为0.28 g·kg-1,处理组全磷含量为0.63~0.76 g·kg-1,由高到低依次是S2>S3>S1>CK。对照组全钾含量为18.90 g·kg-1,处理组全钾含量为4.90~18.97 g·kg-1,S1 与对照组无显著差异(P>0.05),S2、S3显著低于对照组(P<0.05)。
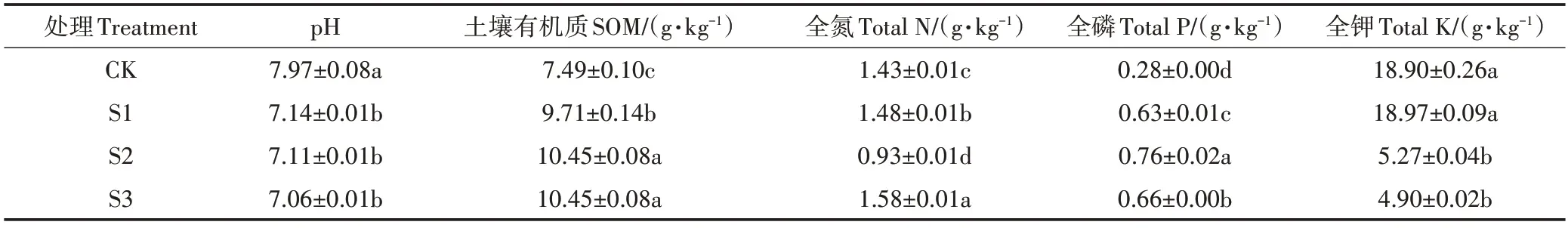
表2 各处理土壤主要化学参数Table 2 Main chemical parameters of soil in different treatments
2.2 尾水原位土壤消纳模式对土壤酶活性的影响
如图2 所示,尾水原位土壤消纳的土壤中蔗糖酶(S-SC)活性相比于对照组提高了157.0%~170.0%,土壤过氧化氢酶(S-CAT)活性和土壤脲酶(S-UE)活性相比于对照组分别降低了12.7%~19.0%和36.0%~43.4%(P<0.05),土壤纤维素酶(S-CL)活性与对照组差异不显著。以上4 种酶活性S1、S2 和S3 处理间均无显著差异。
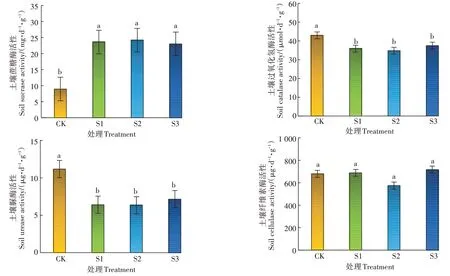
图2 不同处理对土壤酶活性的影响Figure 2 Effects of different treatments on soil enzyme activity
2.3 尾水原位土壤消纳模式对土壤细菌和真菌群落的影响
2.3.1 生态学指数特征分析
对于土壤细菌群落,不同处理12 个土壤样本共获得4 566 个OTUs,物种分类统计结果包括32 个门、90 个纲、239 个目、436 个科和817 个属。对于土壤真菌群落,不同处理12 个土壤样本共获得1 009 个OTUs,物种分类统计结果包括14 个门、31 个纲、67 个目、138个科和239个属。不同处理土壤微生物群落α多样性指数如表3 所示,细菌Shannon 指数在S1 处理最大,CK、S2 和S3 处理间无显著差异,S1、S2 和S3处理的真菌Shannon 指数相比于CK 处理显著增加(P<0.05),在S1处理达到最大。
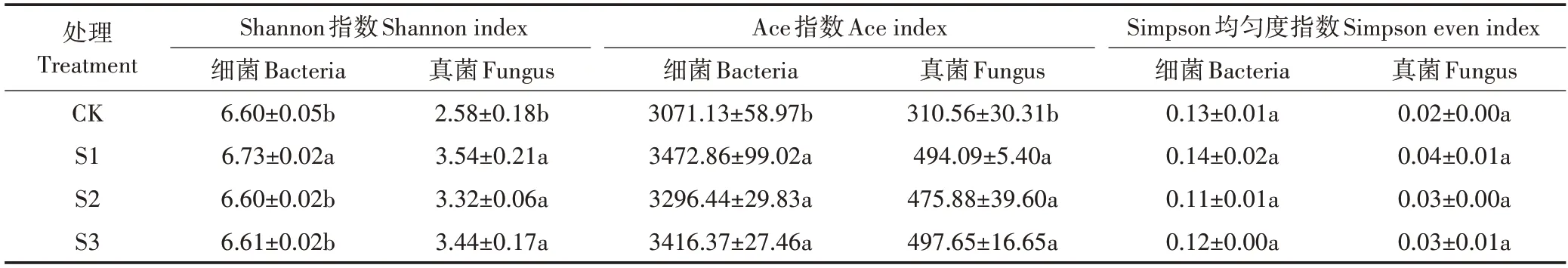
表3 不同处理土壤细菌和真菌生态学指数Table 3 Ecological indices of soil bacteria and fungi in different treatments
S1、S2 和S3 处理中细菌和真菌Ace 指数均显著高于CK 处理(P<0.05),且S1、S2 和S3 处理间无显著差异,细菌Ace 指数最大值出现在S1 处理,真菌Ace指数最大值出现在S3处理。
细菌和真菌Simpson 均匀度指数在各处理组间均无显著差异。
2.3.2 细菌和真菌群落结构分析
各处理的土壤细菌在门分类水平和属分类水平的群落组成如图3 所示。门水平上细菌群落结构高度相似,主要优势群落有变形菌门(Proteobacteria,26.0%~31.7%)、放线菌门(Actinobacteria,23.9%~27.3%)、绿弯菌门(Chloroflexi,13.7%~18.0%)、酸杆菌门(Acidobacteria,8.9%~13.0%)、芽单胞菌门(Gemmatimonadetes,4.0%~6.2%)、拟杆菌门(Bacteroidetes,3.9%~4.8%)、厚壁菌门(Firmicutes,3.5%~5.7%)和浮霉菌门(Planctomycetes,1.2%~1.4%)。这8 个菌群相对丰度占细菌群落的80%以上,其中变形菌门(Proteobacteria)占比最高。尾水原位土壤消纳对土壤细菌群落丰度的影响较小,各处理整体上一致。
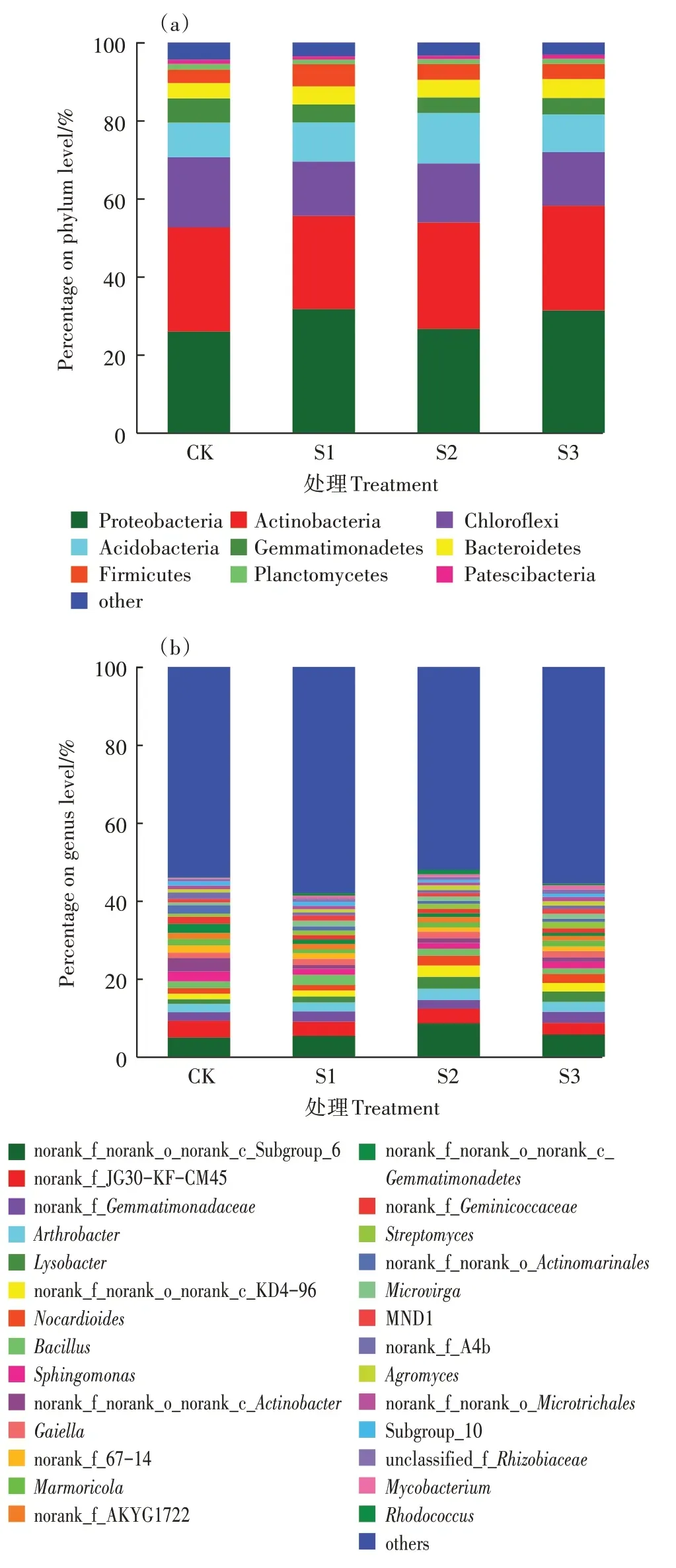
图3 门水平(a)和属水平(b)土壤细菌群落组成相对丰度Figure 3 Relative abundance of soil bacterial community composition at phylum level(a)and genus level(b)
属水平上,各处理间优势属均为norank_f_norank_o_norank_c_Subgroup_6(4.8%~8.6%)、norank_f_JG30-KF-CM45(3.1%~4.2%)、norank_f_Gemmatimonadaceae(2.3%~2.8%)、节杆菌属(Arthrobacter,2.1%~2.9%)、溶杆菌属(Lysobacter,1.2%~3.1%)、类诺卡氏菌属(Nocardioides,1.4%~2.6%)、芽孢杆菌属(Bacillus,1.4%~2.6%)、鞘氨醇单胞菌属(Sphingomonas,1.4%~2.6%)、链霉菌属(Streptomyces,0.8%~1.6%)、微枝形杆菌属(Microvirga,0.7%~2.2%)、壤霉菌属(Agromyces,0.8%~1.2%)、分枝杆菌属(Mycobacterium,0.3%~1.0%)、红球菌属(Rhodococcus,0.1%~1.1%)。
尾水原位土壤消纳的处理中节杆菌属、溶杆菌属、链霉菌属、微枝形杆菌属和红球菌属的相对丰度高于对照组,而鞘氨醇单胞菌属的相对丰度低于对照组。
各处理的土壤真菌在门分类水平和属分类水平的群落组成如图4 所示。门水平上真菌群落组成结构高度相似,主要优势菌群有子囊菌门(Ascomycota,62.0%~66.0%)、球囊菌门(Mortierellomycota,13.3%~28.4%)、担子菌门(Basidiomycota,4.7%~17.4%)、unclassified_k_Fungi(1.0%~4.0%)、油壶菌门(Olpidiomycota,0~2.3%),这5 个菌群相对丰度占真菌群落的70%以上,其中子囊菌门占比最高,施加粪污后球囊菌门的相对丰度降低,担子菌门和unclassified-k-Fungi的相对丰度增加,但组间变幅不等,油壶菌门仅存在于尾水原位土壤消纳的处理组内。

图4 门水平(a)和属水平(b)土壤真菌群落组成相对丰度Figure 4 Relative abundance of soil fungal community composition at phylum level(a)and genus level(b)
属水平上,小被孢霉(Mortierella,13.1%~28.4%)、链格孢菌(Alternaria,1.6%~27.2%)、枝孢菌(Cladosporium,3.8%~11.6%)、镰刀菌属(Fusarium,4.6%~6.8%)、耐冷酵母(Guehomyces,0.1%~10.0%)、掷孢酵母属(Sporobolomyces,0.1%~5.9%)、篮状菌属(Talaromyces,0.4%~4.4%)、寡囊盤菌属(Thelebolus,0~2.2%)、无茎真菌属(Acaulium,0.3%~2.2%)、枝顶孢霉属(Acremonium,0.2%~2.2%)、油壶菌属(Olpidium,0~1.2%)。其中小被孢霉、链格孢菌和枝顶孢霉属相对丰度降低,油壶菌属的相对丰度增加,寡囊盤菌属和油壶菌属则是通过尾水土壤消纳引入到菜园土壤环境中的。
2.3.3 细菌群落与真菌群落聚类特征及环境因子相关性分析
基于Bray-Curtis 距离的PCoA 研究不同处理属水平土壤细菌群落组成和真菌群落组成的相似性和差异性。图5 中不同形状图例分别代表对照及不同处理的土壤样本,细菌群落组成(图5A)中对照组位于第一象限和第四象限,处理组位于第二象限和第三象限。属水平PC1 轴和PC2 轴对结果的解释度分别为35.09%和22.16%,P=0.007,不同处理的土壤细菌群落组成更加相似,与未经处理的对照组土壤细菌群落组成存在差异。真菌群落组成(图5B)中对照组位于第一象限和第四象限,处理组S1 位于第二象限,处理组S2 位于第一象限和第三象限,处理组S3 位于第二象限、第三象限和第四象限。属水平PC1 轴和PC2轴对结果的解释度分别为45.45% 和19.98%,P=0.007,不同处理的土壤真菌群落组成更加相似,与未经处理的真菌群落组成存在差异。说明相较于对照组,农村三格化粪池尾水原位土壤消纳对菜园土壤细菌和真菌群落组成影响更大。
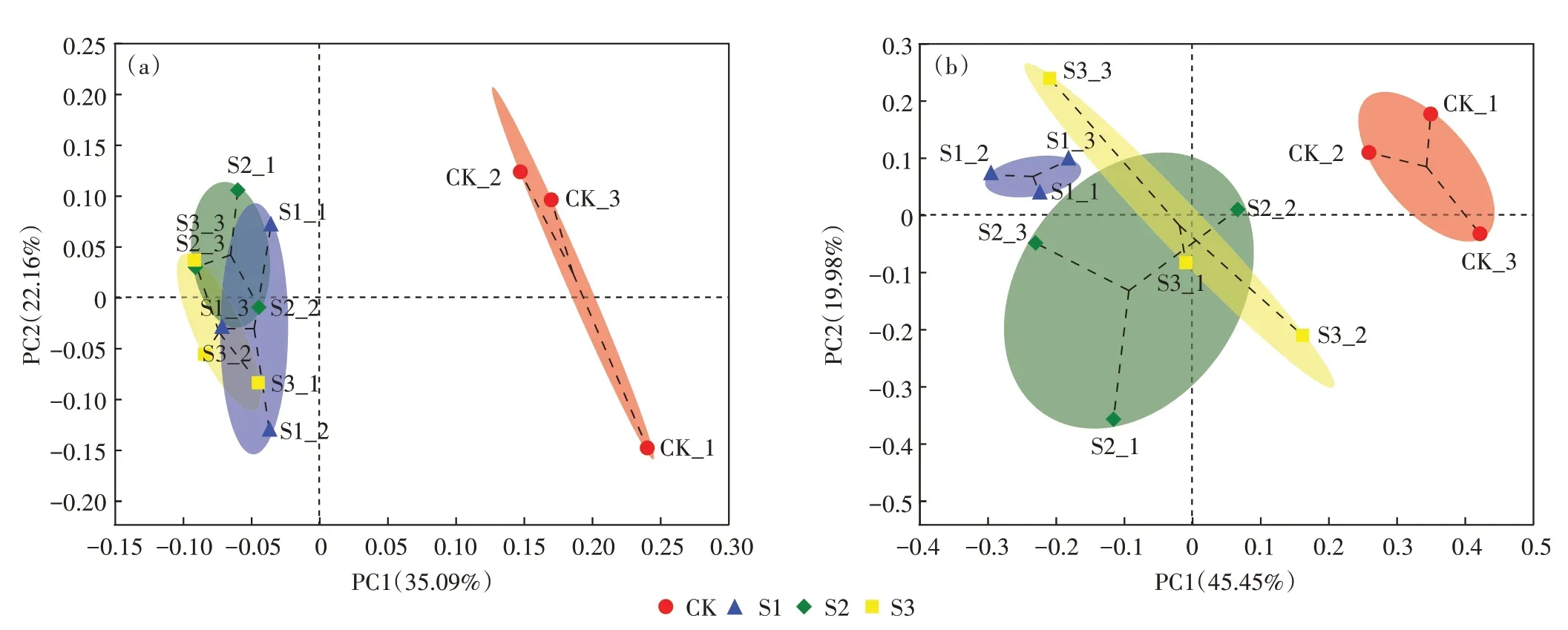
图5 不同处理土壤细菌(a)和真菌(b)PCoA图Figure 5 Principal coordinate analysis(PCoA)diagram of soil bacteria(a)and fungi(b)under different treatments
通过相关性热图分析不同的环境因子对土壤细菌属水平群落组成(图6a)的影响。类诺卡氏菌(Nocardioides)与TP(r=0.608 39)呈显著正相关(P<0.05)。链霉菌属(Streptomyces)与SOM(r=0.735 93)和TP(r=0.797 2)呈极显著正相关,与TK(r=-0.672 51)呈显著负相关(P<0.05),与pH(r=-0.776 22)呈极显著负相关(P<0.01)。
通过相关性热图分析不同的环境因子对土壤真菌属水平群落组成(图6)的影响。无茎真菌属(Acaulium)与TP(r=0.781 71)呈 极显著正相关(P<0.01),与SOM(r=0.914 89)呈极显著正相关(P<0.001),与pH(r=-0.781 71)和TK(r=-0.797 19)呈极显著负相关(P<0.01)。

图6 环境因子与细菌群落组成(a)和真菌群落组成(b)Spearman相关性热图Figure 6 Spearman correlation heat map between environmental factors and bacterial(a)and fungal(b)community composition
3 讨论
3.1 土壤致病微生物的环境风险
土壤细菌中鉴定到的致病菌仅有1 种,即分枝杆菌属(Mycobacterium)。Mycobacterium菌属包括许多已知的在哺乳动物中造成严重疾病的病原菌,这类致病菌可引起肺部感染及麻风等传染性疾病[20-21],经尾水消纳后的土壤样本中Mycobacterium菌属的相对丰度高于对照组,并且对照组中原本就存在此致病菌属,这可能是因为Mycobacterium菌属对各种环境条件具有广泛的适应性[22],长期消纳尾水的土壤更适合其生存。但随着距离的增加,Mycobacterium菌属的相对丰度先降低后升高,这可能与其极易通过气溶胶传播和蔬菜采收过程易被人为扰动有关[22]。土壤真菌中鉴定到的致病菌共5 种,分别为链格孢属(Alternaria)、枝孢菌(Cladosporium)、镰刀菌属(Fusarium)、篮状菌属(Talaromyces)和枝顶孢霉属(Acremonium)。这些致病菌是常见的能够引起食物中毒的菌属,同时这些菌属也易引发人类皮肤过敏性反应[23-27],因此在蔬菜采摘时需特别注意减轻对食用部分的损伤,以免致病菌通过创口进入蔬菜内部危害食品安全。
化粪池尾水原位土壤消纳所产生的土壤致病微生物环境风险难以避免且不容忽视,土壤消纳的尾水随外界因素而变化,因此在推行这种模式的同时需加强对前端化粪池无害化处理粪污技术的优化,以降低环境风险,减轻对人类健康的危害。
3.2 土壤环境容量对系统长期运行的影响
农田常用来作为消纳农业废弃物的场所。本研究中,处理组土壤pH显著低于对照组,可能是由于长期消纳尾水增强了土壤硝化作用,产生了大量H+,降低了土壤pH[28],从距离上看,处理组pH 由近及远逐渐降低,可能是土壤中尾水的消纳量近多远少、硝化作用近强远弱所致。处理组全磷含量显著高于对照组,S1和S3处理组全氮含量显著高于对照组,S2处理组显著低于对照组,S2 和S3 处理组全钾含量显著低于对照组,但在距离上并无规律性,可能是由于试验设计初期部分土壤并非原位回填,加之蔬菜采摘阶段人为扰动,造成土壤分布不均衡。处理组土壤有机质含量显著高于对照组,叶伟宗等[29]的研究发现,公厕粪便制成的沼液可以显著提高土壤有机质含量,且与施用量呈一定的规律性,本试验所用的尾水有机质含量较低,为3.8%,远低于《沼肥》(NY/T 2596—2014)中规定的有机质含量(≥30%)。现今人们生活水平逐渐提高,饮食结构也越来越丰富,伴随厕所节水技术的改进,可预见未来化粪池尾水的有机质含量会比当下水平更高[30]。但尾水中的盐分也会随之增加,随尾水流入土壤后将加重土壤的盐渍化风险。由于本试验埋深较浅且做了防渗处理,故尾水中过量的营养物质和微生物随降雨淋溶污染地下水体的风险较低。菜园土壤环境容量有限,因此系统运行数年之后需更换新的土壤来维护长期运行。
3.3 土壤酶活性和微生物群落变化的环境影响
土壤酶活性是反映土壤肥力和质量的重要指标。化粪池尾水原位土壤消纳后,处理组的S-CAT 活性相比于对照组显著降低,可能是由于土壤pH、含水率和容重发生显著变化,抑制了S-CAT 活性[31],这将导致土壤中H2O2的降解率下降,加剧对植物的毒害[32]。S-SC 参与蔗糖分子的水解,其活性强弱反映了土壤熟化程度和肥力水平,化粪池尾水的排入增强了SSC 酶促反应,增加了土壤环境中微生物的数量,提高了土壤呼吸强度,促进了蔗糖有效向单糖的转化效率,提升了植物吸收利用率,这与宋震震等[33]的研究结果一致。S-UE 活性显著低于对照组,这与徐忠山等[34]的研究结果存在差异,本研究结果可能与采样地土壤温度有关,对照组样地处于开阔处,可以长时间照晒阳光,而庭院菜园位于厕屋后方,光照不足,土壤温度低于对照组样地,从而抑制了相关微生物和植物根系分泌脲酶,进而降低了S-UE 活性。土壤温度对S-UE活性的影响远大于化粪池尾水的影响[35]。S-CL可分解有机残体,其活性表征土壤碳循环状况[36],处理组S-CL 活性与对照组无显著差异,其原因可能是对照组和处理组植被生长密度相当,土壤中所积累的植物残体为S-CL 的酶促反应提供了相当数量的碳源。
相比于对照组,处理组土壤微生物多样性和丰富度显著提高,说明化粪池尾水可以提供丰富的营养物质以改善土壤微生物的生长繁殖环境,其中节杆菌属、溶杆菌属、链霉菌属、微枝形杆菌属和红球菌属等具有降解有机污染物和固氮作用,这些菌属的相对丰度均高于对照组[37-41],说明长期消纳尾水可以改变微生物群落结构,增加功能菌属的数量,这对土壤环境的改善具有积极作用。
4 结论
(1)长期施用化粪池尾水可以改良土壤化学性质,提高土壤肥力,实现厕所污水的减量化和资源化。但系统长期运行会超出土壤环境容量,进而影响系统的消纳效果和使用寿命,故需要定期更换新的土壤来维持系统的正常运行。
(2)化粪池尾水原位土壤消纳方式可以提高土壤中蔗糖酶活性,抑制过氧化氢酶活性和脲酶活性,对纤维素酶活性无显著影响。不同溢流距离之间土壤酶活性无显著差异。
(3)化粪池尾水原位土壤消纳方式可提高土壤微生物丰富度和多样性,改变土壤微生物组成结构,提高了红球菌属、节杆菌属、溶杆菌属和微枝形杆菌属等有益菌数量,但也提高了分枝杆菌属和枝孢菌等致病菌的相对丰度,增加了土壤致病微生物的环境风险。因此该模式应用过程中需加强前端尾水的监测和无害化处理。