灭多威对斑马鱼胚胎抗氧化防御系统的影响
陆妍,陈曦,,裘丽萍,胡庚东,,宋超,,范立民,,郑尧,,孟顺龙,*,陈家长,*
(1.南京农业大学无锡渔业学院,江苏 无锡 214081;2.中国水产科学研究院淡水渔业研究中心,农业农村部水产品质量安全环境因子风险评估实验室(无锡),中国水产科学研究院内陆渔业生态环境和资源重点开放实验室,江苏 无锡 214081)
灭多威(Methomyl,MET),分子式为CHNOS,又称乙肪威、万灵、灭虫快等,属于氨基甲酸酯类农药。灭多威是一种强效的杀虫剂,因其选择性强、高效等特点而被广泛使用。1997年,灭多威被世界野生动物基金会列为雌激素类环境内分泌干扰物(Endocrine disrupting chemicals,EDCs)。EDCs对鱼类的危害主要表现为生殖毒性、遗传毒性、免疫毒性等。野外试验证实鱼类生长发育和生殖障碍与EDCs的暴露有关,处于生命发育早期的胚胎和幼鱼对EDCs尤为敏感,短暂暴露可造成生物体组织器官的不可逆损伤。浙江省16个市级水源地的灭多威浓度达到0.172 0μg·L;多地检测发现灭多威在自然水体中的残留量为0~97μg·L;对吉林省6种食用菌农药残留污染情况进行检测,发现灭多威均有检出并且超出欧盟标准(0.1μg·L)。目前我国有关灭多威在水环境中残留限量标准尚未制定,相关工作亟待开展。
灭多威能影响组织器官抗氧化酶活性,并对生物机体造成损伤效应。以仓鼠为研究对象发现,氧化损伤可能是环境雌激素生殖毒性的作用机理之一;灭多威使雄性大鼠血清、睾丸中丙二醛(MDA)含量显著上升,超氧化物歧化酶(SOD)、还原型谷胱甘肽(GSH)含量有所下降,并且染毒后,大鼠睾丸组织抗氧化能力减弱,抗氧化系统处于失代偿状态,导致脂质过氧化反应增强、氧自由基增多,影响睾丸的生精功能;在鱼体受到外源污染物的胁迫时,体内抗氧化防御系统会作为一种代偿机制来抵消生物体产生的活性氧。鱼类等生物机体中存在一套完备的抗氧化防御体系,其中一类重要的抗氧化防御因子包括:SOD、过氧化氢酶(CAT)、谷胱甘肽还原酶(GR)、GSH、氧化型谷胱甘肽(GSSG)等,它们的活性会因污染物的存在而被诱导或抑制,是指示生物体是否处于污染胁迫状态的重要参数。同时,MDA含量可用于判定胞膜脂质过氧化损伤程度。因此,根据上述抗氧化防御因子活性及含量的变化可以一定程度上反映生物体所受外源环境胁迫的程度。
本文旨在探究灭多威对斑马鱼体内抗氧化防御因子活性水平的影响,进一步了解灭多威对斑马鱼胚胎抗氧化防御系统的损伤效应,以期为斑马鱼作为污染检测指示生物提供理论依据,为了解灭多威对鱼类健康的潜在危害及相关水质标准的制定提供可参考的资料。
1 材料与方法
1.1 试验材料
1.1.1 试验动物
试验用鱼购自上海费曦生物科技有限公司,为AB系野生型斑马鱼。斑马鱼饲养于中国水产科学研究院淡水渔业研究中心养殖室,采用更新式半静态水养殖,饲养于28 cm×38 cm×30 cm规格的缸中。光暗比为14 h∶10 h,水温控制在(28±1)℃,pH为7.2~7.6,溶解氧含量为(7.0±0.2)mg·L,每日喂食3次丰年虾卵,每天更换一半的养鱼用水,养鱼用水为曝气一周的去氯自来水。动物福利按中国水产科学研究院淡水渔业研究中心规定(2011AA1004020012)执行。
1.1.2 主要试剂与仪器
试验所用灭多威原药(纯度97%)购自上海焦点生物技术有限公司。试验中所示浓度为药物的有效成分含量。氯化钠(NaCl,分析纯)购自上海联试化工试剂有限公司。总蛋白(TP)、SOD、CAT、GR、GSH、GSSG、MDA试剂盒购自南京建成生物工程研究所。
试验主要仪器为DW-86L超低温保存箱(海尔,青岛)、PWC 124型分析天平[艾德姆衡器(武汉)有限公司]、BioTek酶标仪(美国伯腾仪器有限公司)、紫外可见分光光度计(上海仪电分析仪器有限公司)、GKC 21-4控温水浴锅(南通沪南科学仪器有限公司)、PGX-150B智能光照培养箱(无锡沃信仪器有限公司)、80 i光学显微镜(Nikon,日本)、小型台式离心机(Sigma,德国)。
1.2 试验方法
1.2.1胚胎收集
繁殖前夜停止喂食,将斑马鱼按照雌雄比例3∶2放入孵化网箱内,用隔板将雌鱼和雄鱼分开过夜。次日待光照刺激后,将隔板抽开,雄鱼和雌鱼开始追逐时,记录产卵时间。收集6 h内的受精卵,放入培养皿中,用养鱼用水清洗两遍,将残饵以及未受精的、发白的死卵挑出,在显微镜下挑选发育健康的胚胎,放在培养皿中备用。
1.2.2 暴露试验
前期试验表明,96 h时灭多威对体长(3.12±0.22)cm、体质量(0.31±0.03)g的斑马鱼的LC为2.119 mg·L,因此,本研究将灭多威浓度分别设置为0(对照)、2、20、200μg·L,每个浓度设置3个平行。将健康的胚胎随机放入装有灭多威溶液的6孔板中,每孔加入5 mL灭多威溶液和30枚胚胎。将6孔板放入28℃的光照培养箱中,光暗比为14 h∶10 h,连续暴露96 h。暴露期间每隔24 h更换一半的灭多威溶液,期间吸去死卵。分别在24、48 h时随机取出25枚胚胎,在72、96 h时随机取出25条仔鱼放入1.5 mL的离心管中,液氮速冻后放入-80℃冰箱备用。
1.2.3 MDA及抗氧化参数测定
按照质量(g)∶体积(mL)=1∶19的比例向样品中加入0.75%的生理盐水,用电动研磨器充分研磨后,放入冷冻离心机(2 500 r·min、4℃)离心10 min,离心后取上清液(5%组织匀浆液),放入1.5 mL离心管中待测。
TP采用考马斯亮蓝法进行测定,MDA含量采用TBA法进行测定。SOD、CAT、GR、GSH、GSSG活性按照试剂盒步骤进行测定。
1.3 统计分析
使用Excel 2016进行数据统计与整理,使用SPSS 25.0进行统计描述,多个样本平均数采用单因素方差分析(One-way ANOVA),以Duncan法进行组间两两比较,<0.05为差异有统计学意义,使用GraphPad Prism 8.0.1做图。
2 结果与分析
2.1 斑马鱼胚胎发育及形态变化
在试验暴露期间,灭多威浓度组斑马鱼胚胎均出现发育畸形,且畸形率呈现随灭多威浓度升高而增大的趋势,主要表现为心包水肿、体轴弯曲、尾部发育畸形等(图1)。96 h时,测得0、2、20、200μg·L浓度组斑马鱼体长分别为(4.04±0.24)、(3.89±0.17)、(3.85±0.19)、(3.83±0.15)cm,2、20、200μg·L浓度组斑马鱼体长小于对照组斑马鱼体长,且斑马鱼个体体长呈现随灭多威浓度升高而缩短的趋势。斑马鱼胚胎在24 h时死亡数最多,斑马鱼累计死亡率呈现随灭多威浓度升高而升高的趋势(表1)。
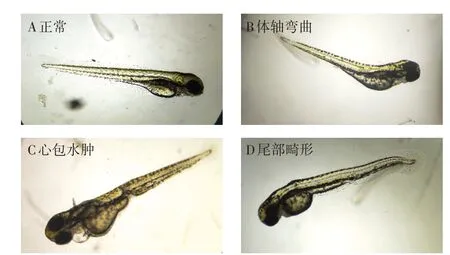
图1 灭多威暴露下引起的斑马鱼畸形(×100倍)Figure 1 Zebrafish deformities caused by methomyl exposure(×100 times)

表1 不同浓度灭多威对斑马鱼胚胎累计死亡率的影响Table 1 Effects of different concentrations of methomyl on cumulative mortality of zebrafish embryo
2.2 灭多威对抗氧化参数变化的影响
灭多威对SOD活性的影响如图2所示。整个试验暴露期间,3个浓度组SOD活性呈现先降低后升高再降低的变化趋势。具体分析,SOD活性在24、72 h时被诱导,2、20、200μg·L浓度组与对照组相比具显著差异(<0.05)。在72 h时,暴露于2μg·L灭多威浓度中的SOD活性达到最大,显著高于对照组(<0.05),为对照组的132.06%。在96 h时,处理组SOD活性呈下降趋势,其中200μg·L浓度暴露下SOD活性值最低,为对照组的63.10%。
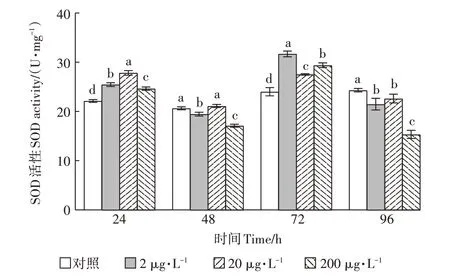
图2 灭多威对SOD活性的影响Figure 2 The effect of methomyl on SODactivity
灭多威对CAT活性的影响如图3所示。整个试验暴露期间,与对照组相比,3个浓度组CAT活性均高于对照组,2μg·L浓度组CAT活性呈先升高后降低的趋势,20、200μg·L浓度组CAT活性与对照组相比具显著性差异(<0.05),且呈现先诱导后抑制减弱效应。具体分析,整个试验期间,20、200μg·L灭多威浓度暴露下CAT活性显著高于对照组(<0.05);20μg·L灭多威暴露下CAT活性值在72 h时达到最大,为对照组的180.84%;200μg·L灭多威暴露下其CAT活性值在48 h时达到最大,为对照组的296.48%。
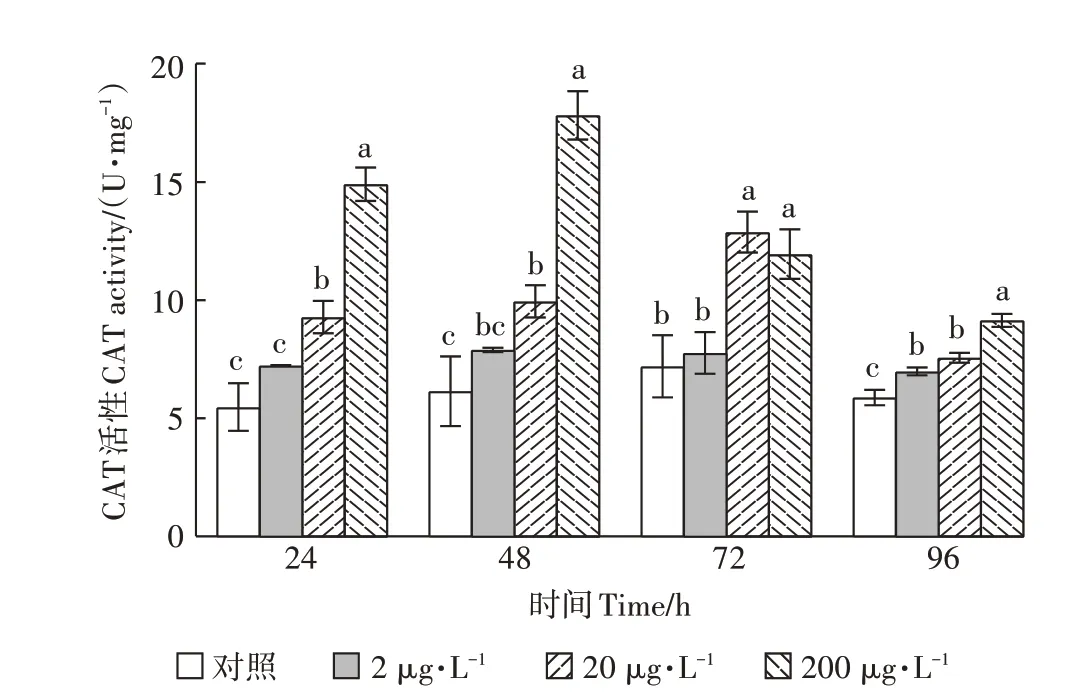
图3 灭多威对CAT活性的影响Figure 3 The effect of methomyl on CATactivity
灭多威对GR活性的影响如图4所示。在整个试验暴露期,除20μg·L浓度组外,GR活性呈先升高后降低的趋势,20μg·L浓度组GR活性呈现先降低后升高再降低的趋势。具体分析,2μg·L浓度条件下,灭多威对GR活性产生诱导作用,且在48 h时,GR活性显著升高(<0.05)达到最大值,为对照组的139.44%。在24、72 h时,20μg·L灭多威浓度暴露下,GR活性显著升高(<0.05),而在48、96 h时低于对照组。在24、48、72 h时,200μg·L灭多威浓度暴露下GR活性显著高于对照组(<0.05),且在48 h时活性达到最高值,为对照组的147.74%。

图4 灭多威对GR活性的影响Figure 4 The effect of methomyl on GRactivity
灭多威对GSH活性的影响如图5所示。整个试验暴露期间,2、20、200μg·L浓度组GSH活性呈先升高后降低的趋势;20、200μg·L浓度组GSH活性低于对照组,且在48~96 h时呈现随灭多威浓度升高而降低的趋势。具体分析,在48 h和72 h时,2μg·L暴露组的GSH活性高于对照组,但与对照组相比无显著性差异(>0.05)。试验期间,20、200μg·L灭多威浓度暴露下,GSH活性显著低于对照组(<0.05)。200μg·L灭多威浓度暴露下,GSH活性在96 h时达到最低值,为对照组的57.86%。

图5 灭多威对GSH活性的影响Figure 5 The effect of methomyl on GSH activity
灭多威对GSSG活性的影响如图6所示。整个试验暴露期间,2、20μg·L浓度下,GSSG活性呈先升高后降低的趋势,200μg·L浓度组GSSG活性呈上升趋势。具体分析,在72 h时,2μg·L暴露条件下灭多威对GSSG活性具显著影响(<0.05)。在48 h时,20μg·L浓度条件下GSSG活性显著高于对照组(<0.05),并且此时GSSG活性达到最大值,为对照组的207.12%。整个试验期间,200μg·L灭多威暴露条件下,GSSG活性高于对照组,并且在24、72、96 h时达到显著水平(<0.05)。
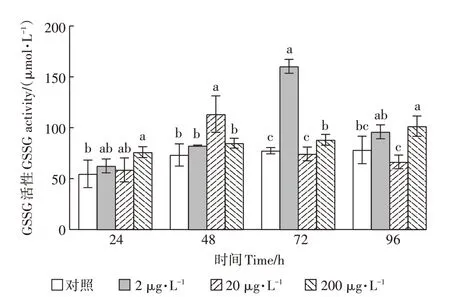
图6 灭多威对GSSG活性的影响Figure 6 The effect of methomyl on GSSGactivity
2.3 灭多威对MDA含量影响
灭多威对MDA含量的影响如图7所示。整个试验暴露期间,2、20、200μg·L浓度组MDA含量高于对照组,呈先增加后减少再增加的趋势。具体分析,在24 h时,20、200μg·L与对照组相比差异显著(<0.05)。48、72、96 h时,2、20、200μg·L浓度组与对照组相比存在显著性差异(<0.05)。其中在96 h时,2μg·L与20μg·L浓度下的MDA含量在整个暴露期间达到最大值,分别为对照组的297.78%和378.43%。

图7 灭多威对MDA含量的影响Figure 7 The effect of methomyl on MDA content
3 讨论
生物体内存在氧化与抗氧化调节机制,受到农药等外源污染物刺激时,抗氧化防御因子水平会发生变化,使生物体处于氧化应激状态。生物体内的抗氧化防御系统在一定程度上能够减轻氧化应激反应,对受损的生物大分子具一定的修复作用。有研究表明,抗氧化防御因子的重要特性之一是在氧化应激状态下其活性或含量能够发生变化,能间接反映出外源污染物的存在。因此,可以通过测定抗氧化防御因子的活性来评判外源污染物对生物体的氧化损伤程度。
3.1 灭多威对抗氧化参数变化的影响
SOD是一种关键的抗氧化酶,它与CAT共同筑起了清除体内活性氧的第一道防线。SOD通过歧化反应将超氧化物转化为氧气和过氧化氢,过氧化氢可以被CAT分解清除,生成水和氧气,从而避免氧自由基对细胞的氧化损伤。研究报道,采用0.05、0.50、1.20μL·L的三唑磷农药对斑马鱼染毒4周后,斑马鱼SOD活性整体呈现先被诱导后抑制的趋势,这与本试验的变化趋势是一致的。本试验中,SOD活性在24 h时被诱导,推测是在受到灭多威刺激后鱼体迅速启动防御机制,产生大量SOD保护细胞免受自由基造成的损伤。灭多威经过一定时间的积累会对斑马鱼正常生长发育造成影响,浓度越高,对鱼体损害越大。同时斑马鱼体内的活性氧自由基随时间的延长在不断积累,使SOD处于激发状态,故在72 h时SOD活性升高且2μg·L浓度组SOD活性值最大。RUDNEVA在研究过程中发现,在卵子发生与胚胎发育的过程中,杜父鱼(和)和鲇鱼()在胚胎发育至Ⅴ期时,其SOD活性会有所下降。斑马鱼胚胎是一个“封闭系统”,发育早期只能通过绒毛膜上的孔洞获取氧气才能满足斑马鱼胚胎的正常生长发育,且胚胎所需耗氧量要比在卵子发生时期大得多,故在本试验中,48 h时SOD活性有所降低。研究表明,在20.39μg·L的灭多威作用下,尼罗罗非鱼()幼鱼SOD活性随时间延长而降低;PETERS等的研究表明,大菱鲆()从胚胎到孵化后第11 d其SOD活性逐渐下降,摄氧量升高3倍左右,上述研究变化趋势与本文结果相似。在本试验中,暴露96 h后,2、20、200μg·L浓度组SOD活性低于对照组,且SOD活性与斑马鱼累计死亡率呈显著负相关(<0.05),表明SOD活性随时间的延长被持续激活,长时间作用会引起代偿失调损伤机体,斑马鱼体内的酶系统因此遭到破坏,导致SOD活性降低。在96 h时200μg·L浓度组SOD活性值最低,可能有以下两种原因:一是高浓度灭多威长时间积累,鱼体不能及时代谢,达到幼鱼机体阈值,导致其抗氧化防御系统受损;二是灭多威与SOD结合导致SOD失活,最终活性降低,且96 h时,3个浓度组中200μg·L浓度组斑马鱼累计死亡率为最高。
CAT是一种内源性氧清除剂,具有强烈的抗氧化特性,对生物机体内羟自由基与超阴离子有很好的抑制效果,也可以抑制MDA的生成,降低生物机体内MDA含量。研究表明,暴露于0.1、0.5、1 mg·L的氟苯虫酰胺中,斑马鱼肝脏CAT活性被诱导;刘存歧等指出,大菱鲆体内CAT活性在卵子发生和细胞发育时会有所升高,这与本试验中在24、48 h时,CAT活性升高且高于对照组的趋势一致。MENG等的研究表明,暴露时间为0~30 d、灭多威暴露浓度高于0.2μg·L条件下,罗非鱼肝脏CAT活性被诱导,在前12 d时,表现为浓度越高,CAT活性越高,这与本文研究结果相似。本试验中,在24、48、96 h时,CAT活性被诱导,且200μg·L浓度组在48 h时CAT活性值最高;而72 h时,200μg·L浓度组CAT活性低于20 μg·L浓度组,可能是高浓度灭多威暴露下斑马鱼体内酶系统受到一定损伤,CAT部分失活导致的。暴露至96 h时,CAT活性与斑马鱼累计死亡率呈显著正相关(<0.05),2、20、200μg·L浓度组CAT活性被诱导。此时CAT活性呈现随灭多威浓度升高而升高的趋势,但随着暴露时间增加诱导效应减弱。王钰钦等的研究发现,经灭多威处理42 d后,吉富罗非鱼肝脏CAT活性降低;李方敏等在研究0.05μg·L的三唑磷对斑马鱼肝脏CAT活性影响时,也观察到相似的变化趋势,本文与以上研究结果相似。CAT活性出现下降趋势可能是由于随着灭多威暴露时间的延长,鱼体内活性氧的调节作用使得CAT活性被抑制。
GSSG与GSH可以相互转化,而GR可以在烟酰胺腺嘌呤二核苷酸磷酸(NADPH)支持下将GSSG还原成为GSH。FELIX等的研究表明,0.2、0.4、0.8 mg·mL氯胺酮处理斑马鱼胚胎,在原肠期(受精后5.5 h)暴露至受精后8 h,GSSG活性升高;西维因和甲基对硫磷的混合物暴露下,鲫鱼脑、肝、鳃、肌肉内GSSG活性显著升高,这与本文试验结果相似。本试验中,24、48 h时3个浓度组GSSG活性升高,2、200 μg·L暴露下,GR活性显著升高(<0.05)。暴露至72 h时,2μg·L浓度组GSSG活性显著升高至最大值,说明低浓度灭多威对鱼体内GSSG产生适应性诱导反应,导致出现上升趋势。此时20、200μg·L浓度组中GSSG活性呈现随灭多威浓度升高而升高的趋势,GR活性呈现随灭多威浓度升高而降低的趋势,说明高浓度灭多威暴露对斑马鱼产生了强氧化胁迫,从而使GR活性代偿性增加,以清除体内因氧化胁迫而产生的过量氧自由基。48 h时,暴露于20μg·L浓度组中的GSSG活性显著升高,GR活性被抑制,其可能是为了维持谷胱甘肽解毒系统的稳定。在暴露至96 h时,2μg·L浓度组中GSSG活性降低,GR活性升高,可能是由于长时间、低浓度灭多威暴露下对斑马鱼幼鱼产生了中毒反应,进而导致GSSG活性降低,而GR活性随着适应性诱导反应有所升高。WU等研究发现,斑马鱼胚胎暴露于双酚A(BPA)中168 h后,斑马鱼胚胎GR活性被抑制,这与本文结果相似。本试验中20、200μg·L处理组在暴露96 h后,GR活性低于对照组,呈现降低趋势。20μg·L灭多威暴露下,GSSG活性有所降低但高于对照组,GR活性下降较明显。同一时间下,GSH活性也明显降低,其原因可能是GR通过催化GSH降低体内氧自由基的含量,从而减少氧化应激带来的损伤。研究表明,GR活性降低,谷胱甘肽过氧化物酶(GPx)活性增强,可催化GSH反应生成GSSG,清除机体内的过氧化物及脂质过氧化物,从而达到保护机体的目的,这与本试验结果一致,即暴露在200μg·L灭多威溶液下,GSSG含量升高,GR含量降低。
GSH与GSSG是一类非常重要的非酶促自由基清除剂,对增强鱼类抗氧化应激能力以及解毒能力发挥着举足轻重的作用。GSH既可以作为一种独立的抗氧化剂,也可以在谷胱甘肽S-转移酶(GST)催化下,与毒物结合生成可溶性无害物质,参与机体的解毒作用。研究发现,暴露在BPA中的斑马鱼仔鱼体内GSH活性受到抑制;暴露于三氯生中的斑马鱼肝脏GSH活性与对照组相比受到抑制,上述试验结果与本研究类似。本试验中,20、200μg·L灭多威暴露下,GSH活性被抑制,显著低于对照组(<0.05),推测高浓度灭多威暴露下,GSH氧化还原状态被破坏,抗氧化防御系统受损。在48、72 h时,暴露于2μg·L灭多威中的GSH活性呈升高趋势。王钰钦等在研究2μg·L灭多威对吉富罗非鱼肝脏14 d GSH活性影响时也发现了类似的趋势,这可能是长时间灭多威刺激下,GSH活性被大量激发所致。发育至96 h后,2、20、200μg·L浓度组GSH活性低于对照组,呈现随灭多威浓度升高而降低的趋势,并且与累计死亡率呈显著负相关(<0.05)。王世豪等将斑马鱼暴露于50μg·L的盐酸四环素溶液中2周,观察到了与本研究类似的结果。这说明随着浓度的升高、暴露时间的延长,在强氧化胁迫下斑马鱼体内GSH合成机制或适应性机能遭到破坏,且浓度越高破坏越严重,造成发育毒性作用,表现为低孵化率、高畸形率、高累计死亡率。
3.2 灭多威对MDA含量影响
脂质过氧化物含量是反映氧化损伤发生程度的重要指标。MDA作为脂质过氧化产物之一,其含量可以反映出生物体内脂质过氧化水平的高低。熊道文等的研究表明膜系统遭受损害与MDA有关。MDA能降低细胞膜的通透性与流动性,与鱼体内蛋白质等生物大分子结合,改变自身结构,从而对机体产生影响。研究表明,随着氧化应激水平升高,MDA含量有所上升。段志文等以3、15、30 mg·kg剂量的呋喃丹对大鼠经口染毒7 d后,大鼠睾丸组织匀浆中MDA含量增加;宋玥颐的研究表明,斑马鱼暴露在0.1、0.5、1 mg·L的氟苯虫酰胺14 d后,斑马鱼肝脏中MDA含量显著增加,这与本研究结果相似。本文研究表明,灭多威处理组MDA含量高于对照组,在48、72、96 h时,2、20μg·L浓度组MDA含量显著高于对照组,MDA含量呈现随灭多威浓度升高而增加的趋势,且在96 h时2、20、200μg·L浓度组的MDA含量均达到最大值。这说明随时间的延长灭多威在鱼体内不断积累,大量脂质过氧化反应发生,机体抗氧化防御系统被破坏,对膜系统造成损伤作用。96 h时,2、20、200μg·L浓度组中,200μg·L浓度组MDA含量最低,推测高浓度灭多威对斑马鱼造成了更为严重的毒性作用,部分MDA与斑马鱼体内生物大分子结合并使其功能结构发生改变,影响斑马鱼正常发育。这与斑马鱼累计死亡率相印证,即灭多威浓度越高,斑马鱼累计死亡率越高。
4 结论
(1)在2、20、200μg·L灭多威浓度暴露下丙二醛含量显著增加(<0.05),脂质过氧化水平升高,扰乱了斑马鱼胚胎抗氧化防御系统的正常功能。
(2)经灭多威暴露后斑马鱼胚胎内超氧化物歧化酶、氧化型谷胱甘肽活性变动不稳定,过氧化氢酶活性先被诱导后抑制减弱,谷胱甘肽还原酶活性总体表现为诱导状态,还原型谷胱甘肽活性整体被抑制。
(3)抗氧化防御因子活性的变化破坏了斑马鱼胚胎自身氧化防御系统的平衡,造成氧化应激及功能异常,对斑马鱼胚胎抗氧化防御系统具有氧化损伤效应。

